10-羟基癸烯酸诱导肝癌细胞凋亡、周期阻滞及迁移抑制的机制
2022-01-06臧延青鞠雪莹翟雨晴王长远
臧延青,鞠雪莹,翟雨晴,姚 笛,朱 磊,王长远,2,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.国家杂粮工程技术研究中心,黑龙江 大庆 163319)
肝癌又称为肝细胞癌,具有恶性程度强、致死率高、浸润和转移性强、预后差的特点[1-2]。在全球范围内,肝癌在癌症发病率和致死率中分别位于第5位和第2位[3],其中,我国肝癌致死率占全球50%以上[4]。肝癌常见的化学治疗药物主要有顺铂、洛铂和5-氟脲嘧啶(5-fluorouracil,5-FU)等,治疗效果较好,但存在价格昂贵、毒副作用强及耐药性高等诸多问题,限制了其在临床上的应用。因此,开发高效、安全、低毒的潜在天然抗肝癌辅助药物或功能因子已成为当前研究热点。有研究表明,大豆异黄酮能够预防肝细胞癌变、抑制肝癌细胞生长[5];苦参碱具有促进人肝癌HepG2细胞凋亡的作用[6]。
凋亡是细胞自主调节导致细胞死亡的生理过程,由线粒体功能障碍和半胱天冬酶(Caspases)的特异性激活介导[7],具有细胞核改变、细胞皱缩、DNA断裂等特征,由Caspase-3的裂解启动和多种信号通路触发[8]。凋亡途径通过不同的信号通路被激活,包括丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、信号转导与转录活化因子(signal transducer and activator of transcription,STAT)3和核因子(nuclear factor,NF)-κB信号通路[9],其中,MAPK信号通路(由细胞外调节蛋白激酶(extracellular-signal-regulated kinase,ERK)、C-Jun氨基末端激酶(C-jun N-terminal kinase,JNK)和P38组成)在细胞生长、发育、分化、凋亡和细胞周期阻滞中起重要作用[10];STAT3信号通路参与肿瘤的发生,是信号转导和转录激活的重要转录因子,也被认为是许多癌细胞的致病因子和治疗靶点[11-12];NF-κB信号通路参与细胞增殖、凋亡、迁移及侵袭,激活NF-κB可促进细胞增殖,抑制细胞凋亡[13]。活性氧(reactive oxygen species,ROS)平衡对细胞发挥正常生理功能有着重要作用,并参与各种信号通路的转导,与癌细胞的存活、增殖和迁移密切相关[14]。多项研究表明,ROS通过调控MAPK、NF-κB和STAT3信号通路,诱导肿瘤细胞凋亡[15-16]。
10-羟基癸烯酸(10-hydroxy-2-decenoic acid,10-HDA)又称为王浆酸,是蜂王浆中特有的有机酸类化合物[17],具有抗菌消炎[18]、增强免疫力[19]、抗肿瘤[20]、抗辐射[21]、抗抑郁[22]等多种生物活性。Miyata等[23]阐明蜂王浆及其主要成分可通过调控多种肿瘤相关因子抑制肿瘤生长和癌细胞侵袭。陈立军等[24]通过噻唑蓝实验发现,蜂王浆能促进瘤组织坏死和细胞凋亡,对黑色素瘤细胞生长有明显的抑制作用。Yang Yuanchang等[25]通过酶联免疫吸附剂测定试验(enzyme linked immunosorbent assay,ELISA)和Western blot实验发现,10-HDA在体外对人结肠癌WiDr细胞具有抗炎活性,同时对细胞内NF-κB信号通路相关蛋白表达水平有抑制作用。郑锦芬等[26]通过细胞增殖活性测定、ROS检测结果发现,10-HDA具有毒性作用,可导致细胞衰老和ROS水平升高,证实了10-HDA调控ROS水平是其发挥抗癌作用的重要方式。而癌细胞内ROS水平的升高,可调控MAPK、STAT3和非受体型酪氨酸蛋白激酶(janus kinase,JAK)2信号通路,引发Caspase-3级联反应,进而诱导细胞发生凋亡和细胞周期阻滞作用[27]。
10-HDA对肿瘤细胞活性的抑制作用已得到了证实,但其诱导肝癌HepG2细胞凋亡和抑制迁移的功效研究鲜见报道,其作用机制尚不清楚。本研究从分子水平上,研究10-HDA对肝癌HepG2细胞的增殖抑制、诱导凋亡、细胞周期阻滞、ROS水平调控的相关信号传导途径和抑制细胞迁移作用,探讨MAPK、NF-κB、STAT3信号通路诱导肝癌HepG2细胞凋亡作用机制,揭示10-HDA对肝癌HepG2细胞的作用靶点,为肝癌发病机理的研究及功能性食品开发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
3 种肝癌细胞株(HepG2、Hep3B、Huh7) 中科院上海细胞库;3 种正常细胞株(L-02、IMR-90、GES-1)上海赛齐生物工程有限公司;10-HDA(纯度≥98%)成都瑞芬思生物科技有限公司; 5-FU、JNK抑制剂、P38抑制剂、ERK抑制剂 美国MedChem Express公司;RPMI 1640培养基、DMEM培养基、青/链霉素(penicillin/streptomycin,P/S)及磷酸盐缓冲液(phosphate buffer solution,PBS) 美国Hyclone公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO)美国Sigma公司;一抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔、抗鼠免疫球蛋白G北京中杉金桥生物技术有限公司;化学发光试剂ECL美国Thermo公司;2’,7’-二氯二氢荧光素二酯(2’,7’-dic hlorodihydrofluorescein diacetate,DCFH-DA)活性氧荧光探针、细胞毒性实验(cell counting kit-8,CCK-8)检测试剂盒、细胞凋亡与坏死检测试剂盒、DNA含量检测试剂盒(细胞周期)、Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒、核蛋白提取试剂盒北京索莱宝生物科技有限公司。
1.2 仪器与设备
MCO-18AIC型CO2培养箱 日本三洋公司;390302型倒置显微镜 德国Leica公司;SynergyHTX型酶联免疫检测仪 美国伯腾仪器有限公司;EVOS FL型全自动智能成像系统 美国Life Technology公司;FACS Calibvr型流式细胞仪 美国贝克曼公司;PowerPac型电泳仪、170-3940型半干转印仪、Amersham Imager 600凝胶成像系统 美国伯乐公司。
1.3 方法
1.3.1 细胞培养
肝癌HepG2、Hep3B、Huh7细胞、正常肺IMR-90细胞及正常胃GES-1细胞的培养基为DMEM(10%(体积分数,下同)FBS、1% P/S),正常肝L-02细胞的培养基为RPMI 1640(10% FBS、1% P/S),在37 ℃、5%CO2、饱和湿度的恒温培养箱中培养,当细胞汇合度达到70%~80%时进行分瓶。
1.3.2 细胞毒性检测
取对数生长期的细胞,以每孔1×104个细胞的密度接种于96 孔板中,放置在37 ℃、5% CO2的培养箱中培养24 h后,用含1% FBS的培养液饥饿处理2 h,加入用DMSO溶解的5-FU或10-HDA,使其终浓度分别为0、1、3、10、30、100 μmol/L,每组有8个复孔,继续培养24 h。根据CCK-8试剂盒说明书,使用酶联免疫检测仪测量490 nm处各孔吸光度,按下式计算细胞存活率。

式中:OD实验组为细胞中加了5-FU或10-HDA和CCK-8溶液时的吸光度;OD空白组为无细胞且只加CCK-8溶液时的吸光度;OD对照组为细胞中只加CCK-8溶液时的吸光度。
通过SPSS 20.0软件分析数据得出半数致死浓度(half maximal inhibitory concentration,IC50)为39.65 μmol/L,作为后续实验处理浓度,并用该浓度(39.65 μmol/L)的5-FU或10-HDA加入96 孔板中处理不同的时间(0、3、6、12、24、36 h)。
1.3.3 细胞凋亡率测定
取对数生长期的HepG2细胞,以每孔1×105个细胞的密度接种于6 孔板中,放置在37 ℃、5% CO2的培养箱中培养24 h后,加入终浓度为39.65 μmol/L的10-HDA或5-FU处理不同的时间(0、3、6、12、24 h),根据细胞凋亡与坏死检测试剂盒,使用EVOS FL型全自动智能成像系统,记录细胞凋亡及坏死的形态特征;使用Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡率,利用线粒体膜电位检测试剂盒中JC-1荧光探针法检测线粒体膜电位的变化情况,再经流式细胞仪检测,分析细胞凋亡情况,每个样本1×104个细胞,采用Cyexpert 1.2软件进行数据分析。并通过Western blot法检测凋亡相关蛋白表达,方法参考1.3.8节。
1.3.4 细胞周期分布检测
HepG2细胞经39.65 μmol/L 10-HDA处理不同的时间(0、3、6、12、24 h),1 000 r/min离心3 min收集细胞,加入1 mL预冷的75%乙醇重悬细胞,在4 ℃下固定12 h。根据DNA含量检测试剂盒(细胞周期)说明书,经流式细胞仪分析,每个样本1×104个细胞,采用Cyexpert 1.2软件进行数据分析得到不同周期细胞的凋亡比例。并通过Western blot法检测周期相关蛋白表达,方法参考1.3.8节。
1.3.5 线粒体凋亡相关信号通路蛋白表达检测
根据核蛋白提取试剂盒说明书,提取HepG2细胞核蛋白,用于Western blot实验分析,进行信号通路相关蛋白检测,方法参考1.3.8节。
MAPK通路(JNK、P38和ERK)抑制剂处理:取对数生长期的HepG2细胞,以每孔1×105个细胞的密度接种于6 孔板中,放置在37 ℃、5% CO2的培养箱中培养24 h后添加抑制剂和10-HDA,分为4 组:对照组;JNK/P38/ERK抑制剂组;10-HDA组(终浓度39.65 μmol/L);JNK/P38/ERK抑制剂+10-HDA组。继续培养24 h,8 000 r/min离心5 min收集细胞,提取细胞蛋白,用于线粒体凋亡相关信号通路蛋白检测,方法参考1.3.8节。
1.3.6 细胞内ROS水平检测
取对数生长期的HepG2细胞,以每孔1×105个细胞的密度接种于6 孔板中,放置在37 ℃、5% CO2的培养箱中培养24 h后,用39.65 μmol/L的10-HDA处理不同的时间(0、3、6、12、24 h),1 000 r/min离心3 min收集细胞,加入终浓度为10 μmol/L DCFH-DA室温孵育30 min,经流式细胞仪检测细胞荧光强度,从而分析细胞内ROS水平,每个样本1×104个细胞,采用Cyexpert 1.2软件进行数据分析。
将细胞分为4个小组进行处理(方法同1.3.5节):对照组;N-乙酰-L-半胱氨酸组(N-Acetyl-L-cysteine,NAC);10-HDA组(终浓度39.65 μmol/L);NAC+10-HDA组。继续培养24 h,8 000 r/min离心5 min收集细胞,根据试剂盒说明书,经流式细胞仪分析细胞凋亡数量。同时,采用上述方法收集细胞,提取细胞蛋白,用于相关信号通路蛋白检测,方法参考1.3.8节。
1.3.7 细胞划痕实验检测细胞迁移情况
取对数生长期的HepG2细胞,以每孔1×105个细胞的密度接种于6 孔板中,放置在37 ℃、5% CO2的培养箱中培养至细胞汇合度80%左右,在培养孔中划出3 道竖线,分别在培养孔中加入39.65 μmol/L的10-HDA或5-FU,并处理不同的时间(0、3、6、12、24 h),使用EVOS FL型全自动智能成像系统,记录细胞迁移情况。
1.3.8 Western blot法检测蛋白表达
收集处理后的HepG2细胞,加入裂解液,在4 ℃下,12 000 r/min离心30 min,得到蛋白上清液,通过考马斯亮蓝法测定蛋白含量,取蛋白样品30 μg,加入5×buffer上样至8%~12%的聚丙烯酰胺凝胶电泳进行分离,再将蛋白质转至硝酸纤维素膜上,室温下5%脱脂乳封闭2 h后,分别加入相应的一抗(Bax、Bcl-2、Cyt c、C-Caspase-3、靶向聚二磷酸腺苷核糖聚合酶(poly adenosine diphosphate-ribose polymerase,PARP)、ERK、P-ERK、JNK、P-JNK、P38、P-P38、P-STAT3、STAT3、NF-κB P65、NF-κB PP65、IκB-α、Cyclin B1、CDK1/2、转化生长因子β1、磷酸化糖原合酶激酶3β、糖原合酶激酶3β、锌指转录因子、Twist转录因子、钙黏蛋白E、钙黏蛋白N、抗波形丝蛋白、β-actin、AKT、P-AKT、P21、Cyclin A、P-IκB和Lamin B1),4 ℃过夜孵育。再加入HRP标记的二抗,室温孵育2 h,使用ECL化学发光试剂显色,通过Amersham Imager 600凝胶成像系统成像,目的条带使用Image J软件分析相对灰度值。
1.4 数据统计与分析
实验数据以平均值±标准差表示,采用SPSS 20.0软件进行统计学分析,组间数据比较采用t检验,P<0.05为差异显著。
2 结果与分析
2.1 10-HDA和5-FU处理对肝癌细胞增殖的影响
如图1A所示,与5-FU处理相比,10-HDA对3 种肝癌细胞具有抑制增殖作用,其抑制作用呈剂量依赖性。经计算可知,HepG2细胞的IC50为39.65 μmol/L,且对10-HDA的敏感度高于其他肝癌细胞,因此,后续实验以HepG2细胞为主要的研究对象。此外,10-HDA处理对3 种正常细胞的毒性均低于5-FU(图1B)。经39.65 μmol/L 10-HDA和5-FU处理后,肝癌细胞和正常细胞的存活均受到了明显的抑制,且抑制作用呈时间依赖性(图1C)。对于人正常细胞L-02、IMR-90、GES-1的存活率,在处理24 h时,5-FU处理后细胞存活率分别为42.11%、40.77%、48.07%,10-HDA处理后细胞存活率分别为58.45%、60.42%、60.07%,由此看出,与5-FU组相比,10-HDA对正常细胞系的毒副作用更小。当处理36 h时,10-HDA处理后细胞人正常细胞L-02、IMR-90、GES-1的存活率分别为44.77%、40.33%、46.06%,此时细胞存活率过低,药物对人正常细胞有明显的杀伤作用,因此,后续研究药物处理时间均为24 h(图1D)。
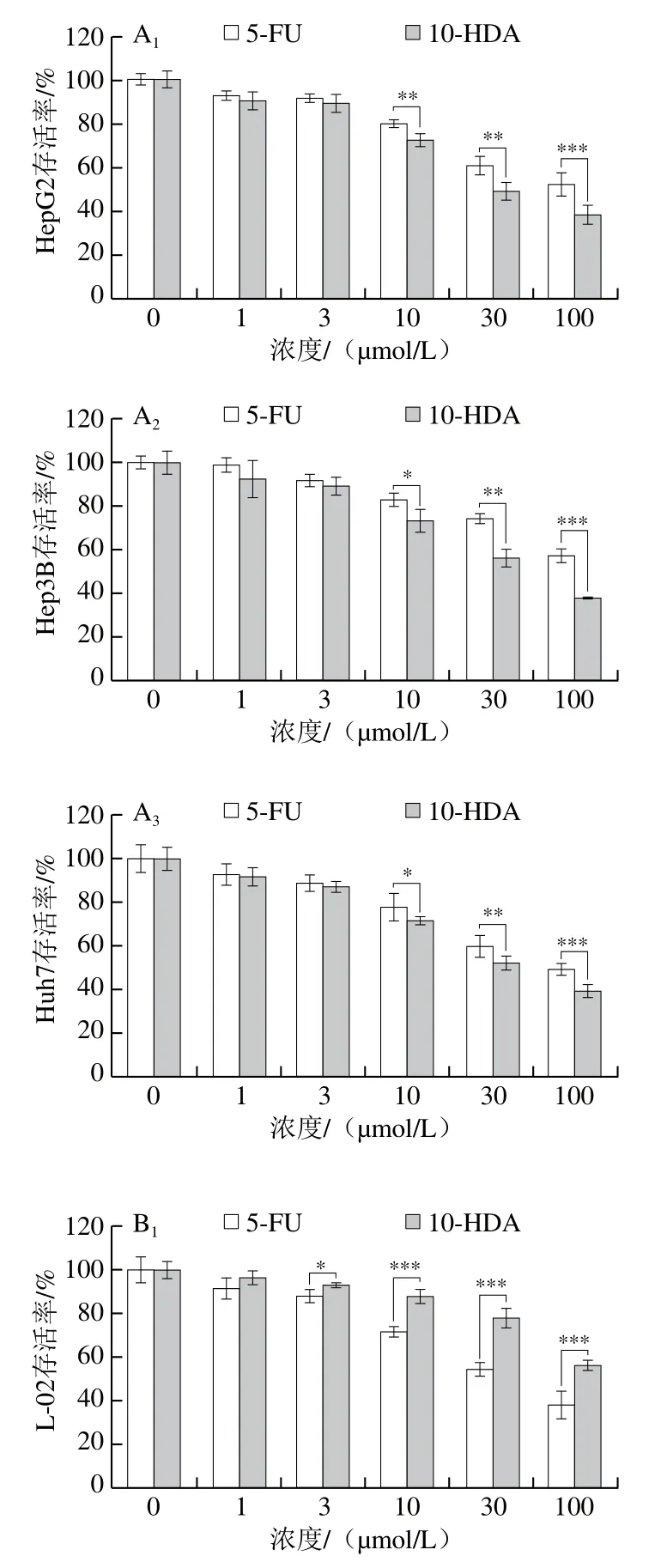

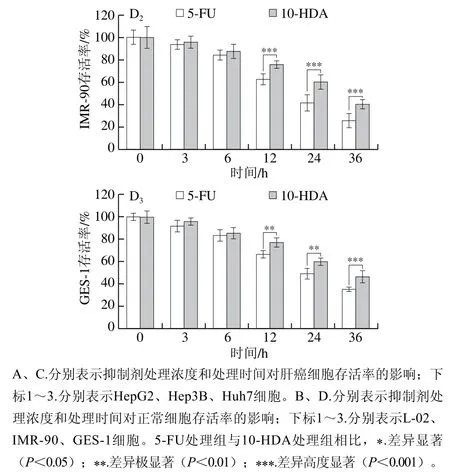
图1 10-HDA对细胞存活率的影响Fig. 1 Effect of 10-HDA on cell viability
2.2 10-HDA对HepG2细胞凋亡的影响
HepG2细胞经10-HDA处理后,进行了Hoechst 33342/碘化丙啶(propidium iodide,PI)双染,随着药物处理时间的延长,HepG2细胞发生皱缩,具有凋亡形态学特征。通过荧光显微镜观察,荧光强度随10-HDA处理时间的延长逐渐增大,与5-FU处理后的细胞荧光强度有明显差异(图2A)。流式细胞术结果显示,10-HDA处理24 h后HepG2细胞凋亡率高达49.24%(图2B);JC-1是一种检测线粒体膜电位的荧光探针,当线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物(红色);当线粒体膜电位较低时,JC-1不能够聚集在线粒体基质中,此时为单体(绿色);用聚合体与单体荧光强度比值来表示线粒体的去极化作用。JC-1荧光探针法检测结果显示(图2C),10-HDA处理后线粒体膜电位下降导致细胞凋亡。Western blot结果显示,随着药物处理时间的延长,促凋亡蛋白Bax、Cyt c、C-Caspase-3和PARP的蛋白表达水平升高,而抗凋亡蛋白Bcl-2的蛋白表达水平明显降低(图2D)。
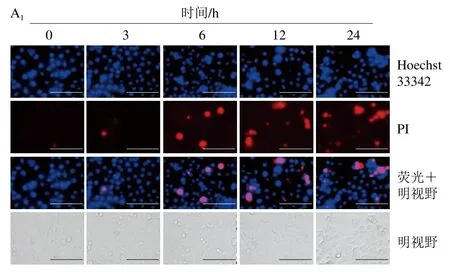
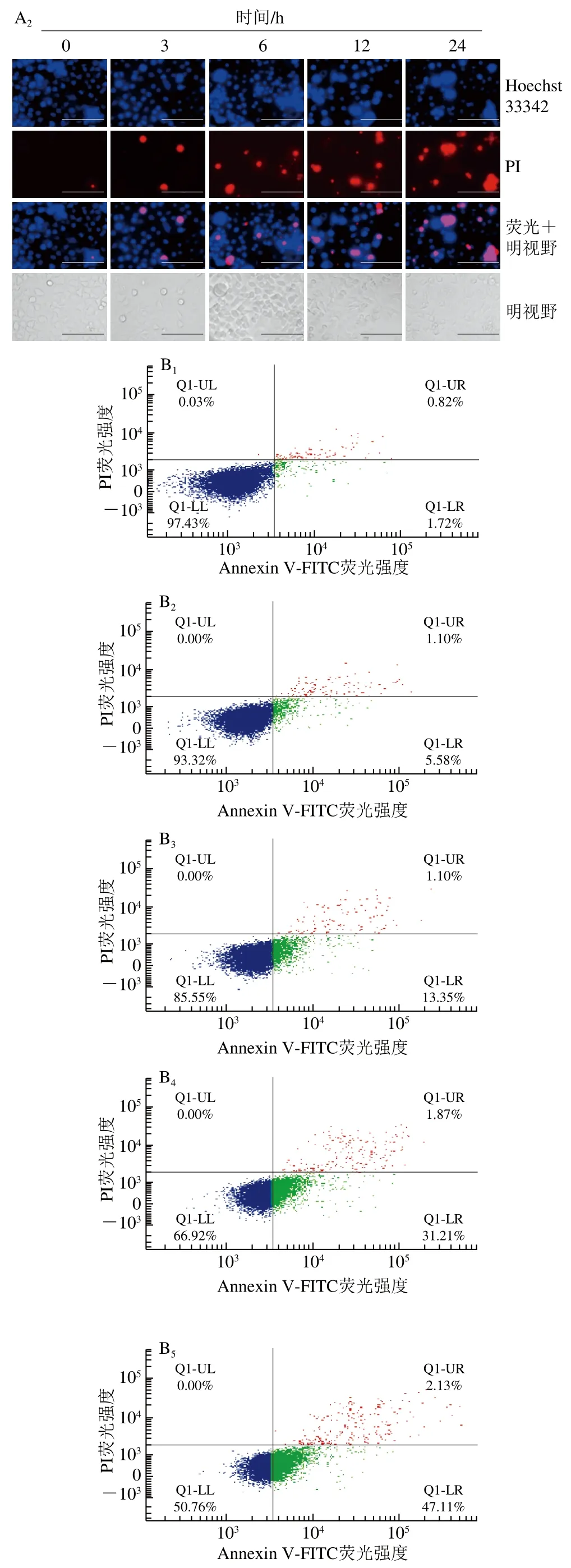
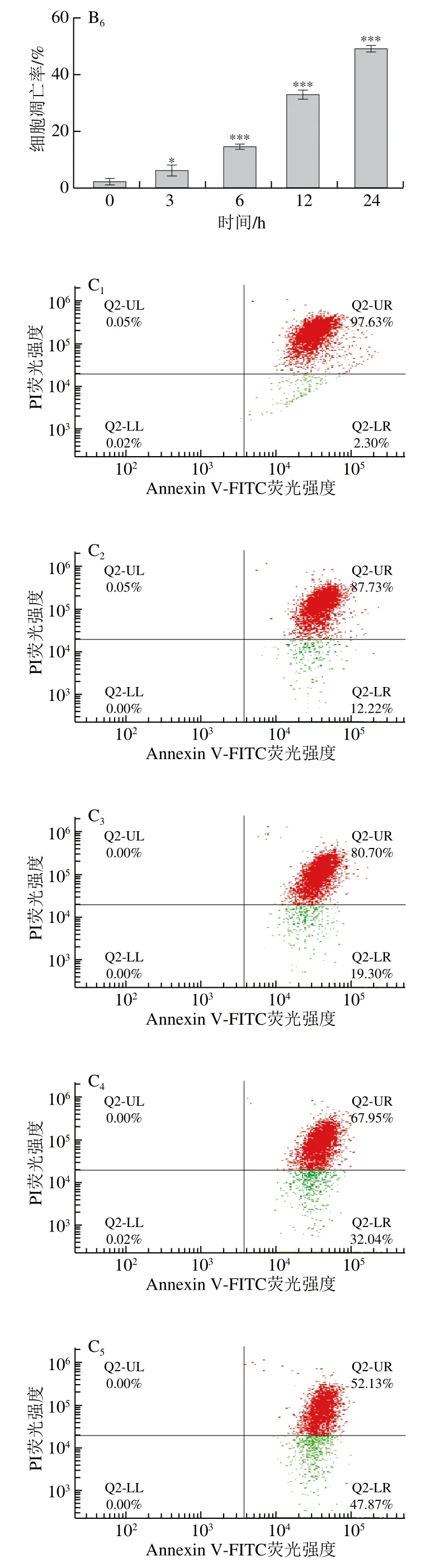
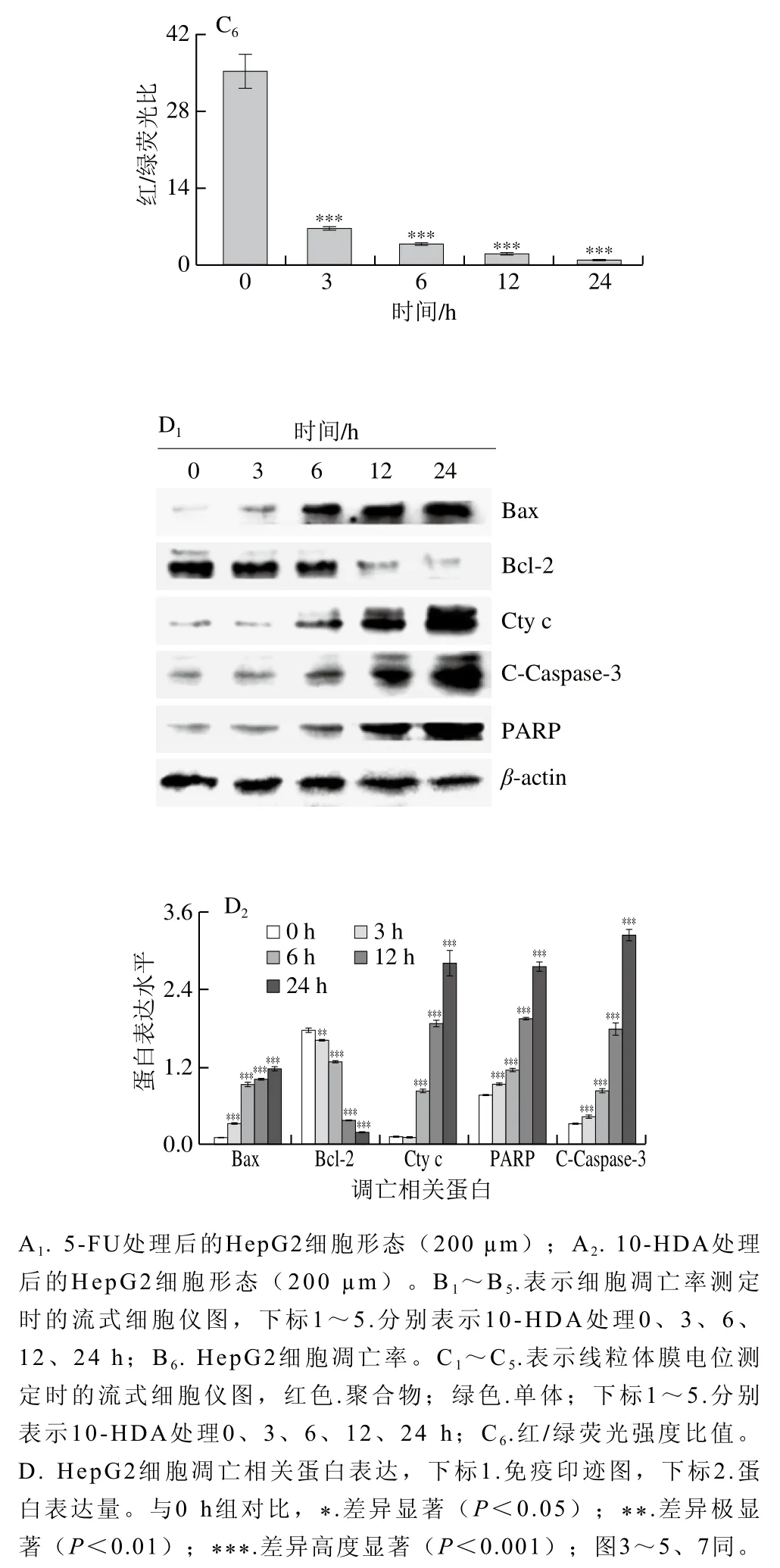
图2 10-HDA对HepG2细胞凋亡及其相关凋亡蛋白表达的影响Fig. 2 The effect of 10-HDA on the apoptosis of HepG2 cells and the expression of apoptotic proteins
2.3 10-HDA对HepG2细胞周期分布的影响
流式细胞术结果显示,G2/M期细胞凋亡率明显升高,G0/G1期细胞凋亡率下降,且呈时间依赖性(图3A)。Western blot检测结果显示,G2/M期相关蛋白P-AKT、Cyclin B1、CDK1/2和Cyclin A的表达水平降低,P21的蛋白表达水平升高(图3B)。综上所述,10-HDA通过调控HepG2细胞周期相关蛋白的表达,诱导HepG2细胞在G2/M期发生细胞周期阻滞。
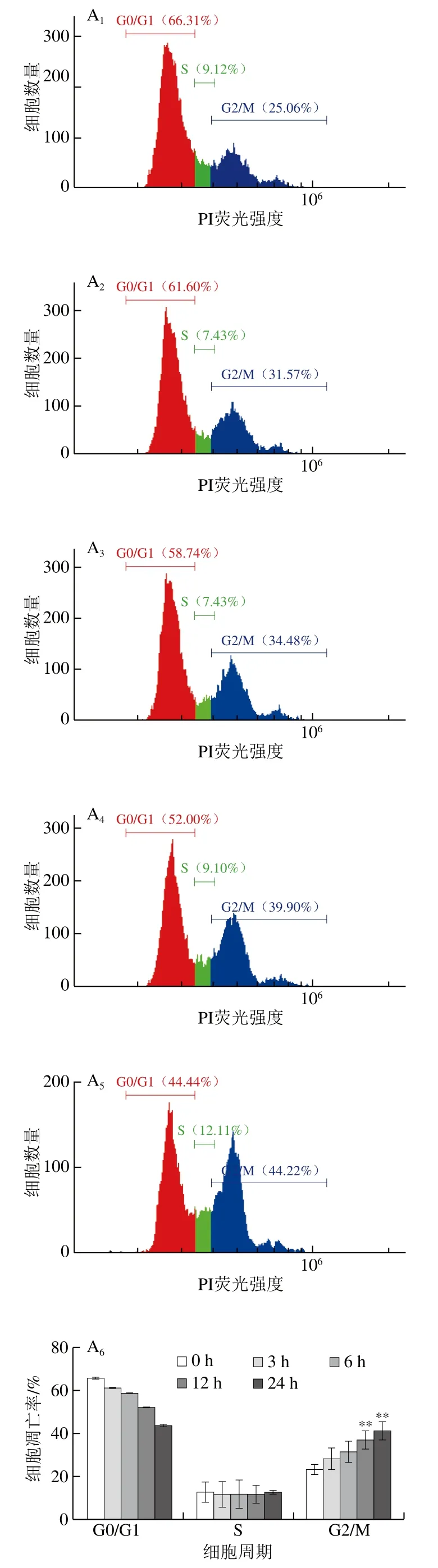
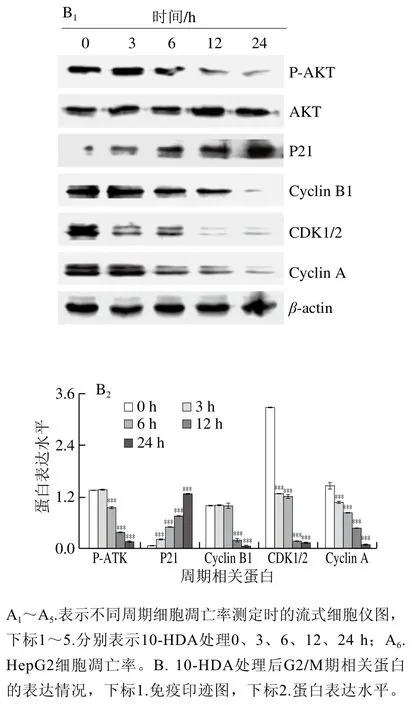
图3 10-HDA对HepG2细胞周期阻滞的影响Fig. 3 Effect of 10-HDA on cycle arrest in HepG2 cells
2.4 10-HDA对HepG2细胞线粒体凋亡的影响
HepG2细胞经10-HDA处理后,Western blot检测结果显示,P-ERK、P-STAT3、NF-κB P65和NF-κB PP65的蛋白表达水平降低,P-JNK、P-P38、IκB-α的蛋白表达水平增加,且呈时间依赖性(图4A)。细胞核内STAT3、NF-κB和P-IκB的蛋白表达水平明显降低(图4B)。此外,利用MAPK抑制剂验证MAPK和STAT3信号通路在细胞凋亡中的作用,结果显示(图5A~C),10-HDA处理组的P-STAT3、NF-κB的蛋白表达量降低,P-JNK、P-P38、IκB-α、Caspase-3蛋白水平升高,在加入JNK或P38抑制剂与10-HDA共同处理后,P-STAT3、NF-κB蛋白表达水平明显升高,P-JNK、P-P38、IκB-α、Caspase-3蛋白水平明显下降。但加入ERK抑制剂后的蛋白表达量的变化与加入其他两组抑制剂的结果不一致,P-ERK、P-STAT3、NF-κB的蛋白表达量明显更低,IκB-α、Caspase-3蛋白表达量明显升高,表明10-HDA通过调控MAPK、STAT3和NF-κB信号通路诱导HepG2细胞线粒体依赖性凋亡。
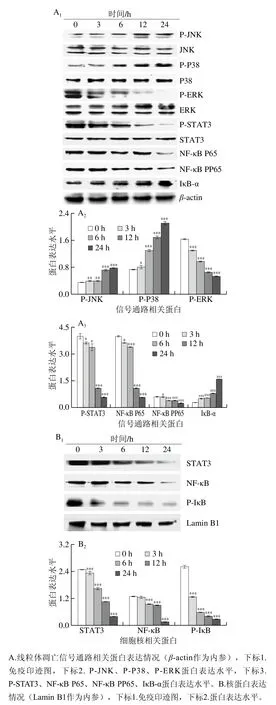
图4 10-HDA对HepG2细胞线粒体依赖性凋亡的影响Fig. 4 Effect of 10-HDA on mitochondria-dependent apoptosis of HepG2 cells
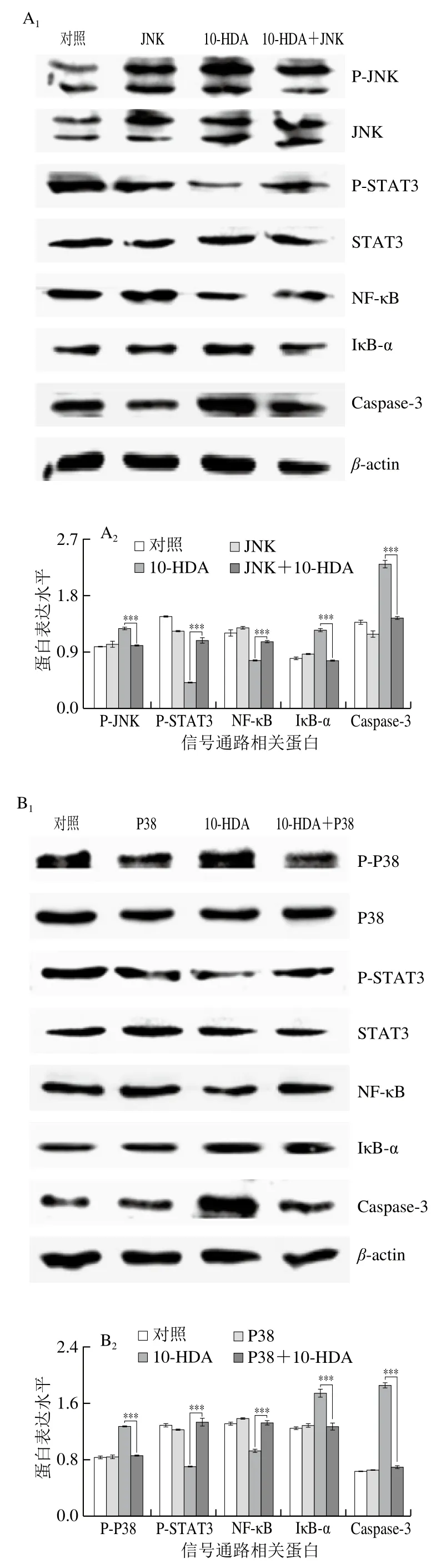
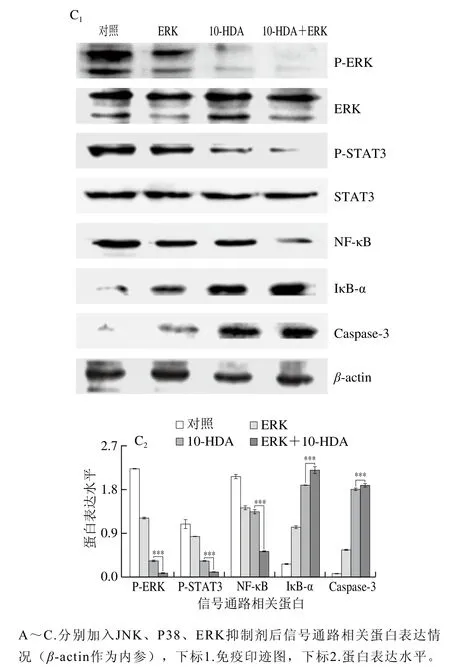
图5 加入MAPK抑制剂的蛋白表达情况Fig. 5 Effect of MAPK inhibitors on the expression of proteins
2.5 10-HDA对ROS水平诱导HepG2细胞凋亡的影响
与对照组相比,HepG2细胞经10-HDA处理后,细胞内ROS水平呈时间依赖性增加(图6A)。NAC和10-HDA共同处理组细胞凋亡率与10-HDA处理组相比显著降低,表明加入NAC后抑制了10-HDA诱导细胞内ROS的积累引起的HepG2细胞凋亡(图6B)。Western blot结果显示,与NAC处理组相比,10-HDA处理组细胞质中P-JNK、P-P38、IκB-α和Caspase-3蛋白表达水平明显升高,P-ERK、P-STAT3和NF-κB蛋白表达水平明显下降。而与10-HDA处理组相比,NAC与10-HDA共同处理组的P-JNK、P-P38、IκB-α和Caspase-3蛋白表达水平显著下降,P-ERK、P-STAT3和NF-κB蛋白表达水平明显回升(图6C)。10-HDA明显抑制了细胞核中STAT3、NF-κB和P-IκB的蛋白表达水平,加入NAC处理后,蛋白表达水平明显回升(图6D)。综上所述,10-HDA通过上调ROS水平激活MAPK、STAT3和NF-κB信号通路,触发细胞线粒体凋亡。
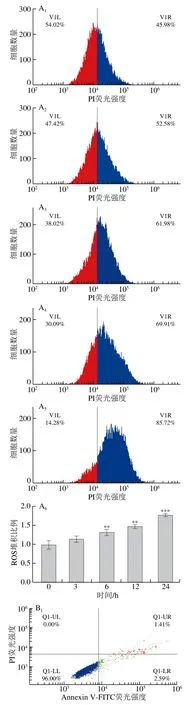
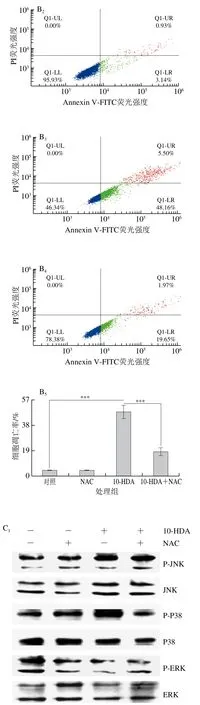
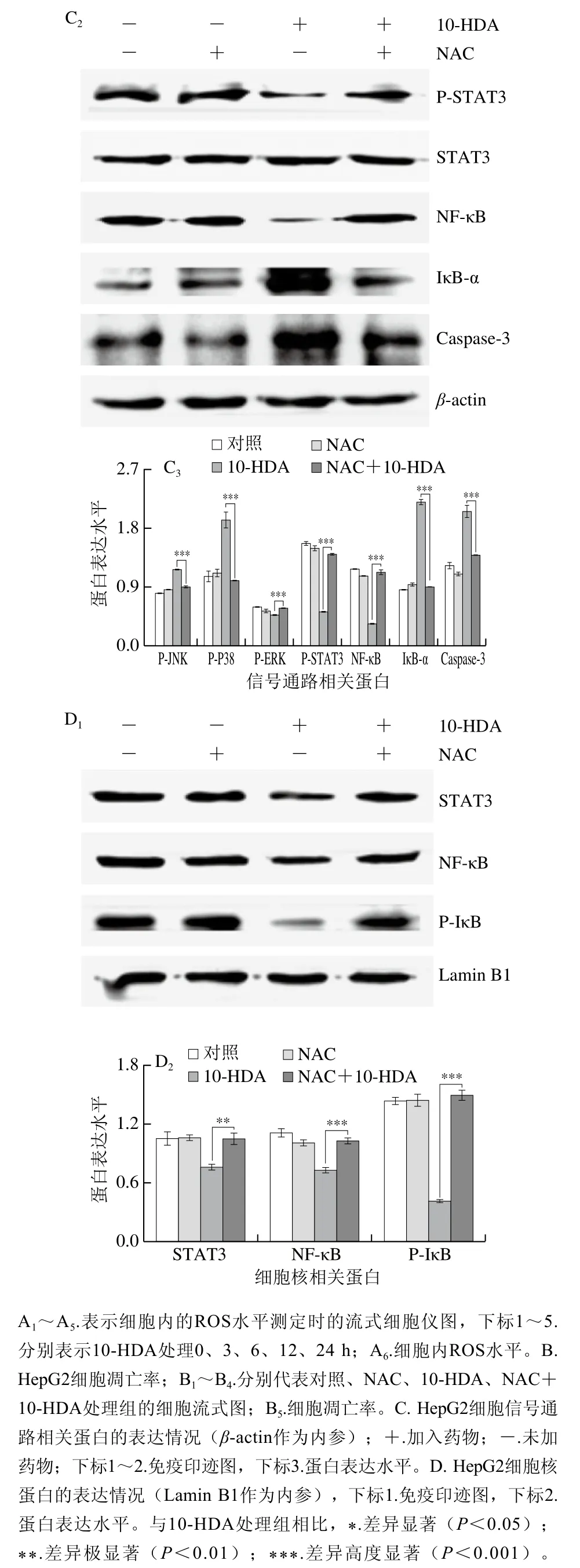
图6 10-HDA对ROS水平诱导HepG2细胞凋亡的影响Fig. 6 Effect of 10-HDA on ROS-induced apoptosis in HepG2 cells
2.6 10-HDA对HepG2细胞迁移和侵袭的影响
与对照组相比,10-HDA处理组细胞迁移能力明显受到抑制,且呈时间依赖性(图7A)。Western blot结果显示,细胞迁移相关蛋白转化生长因子β1、磷酸化糖原合酶激酶3β、锌指转录因子、Twist转录因子、钙黏蛋白N和抗波形丝蛋白的表达水平显著下降,钙黏蛋白E表达水平显著上升,且呈时间依赖性(图7B)。可知,10-HDA能够抑制HepG2细胞的迁移和侵袭。
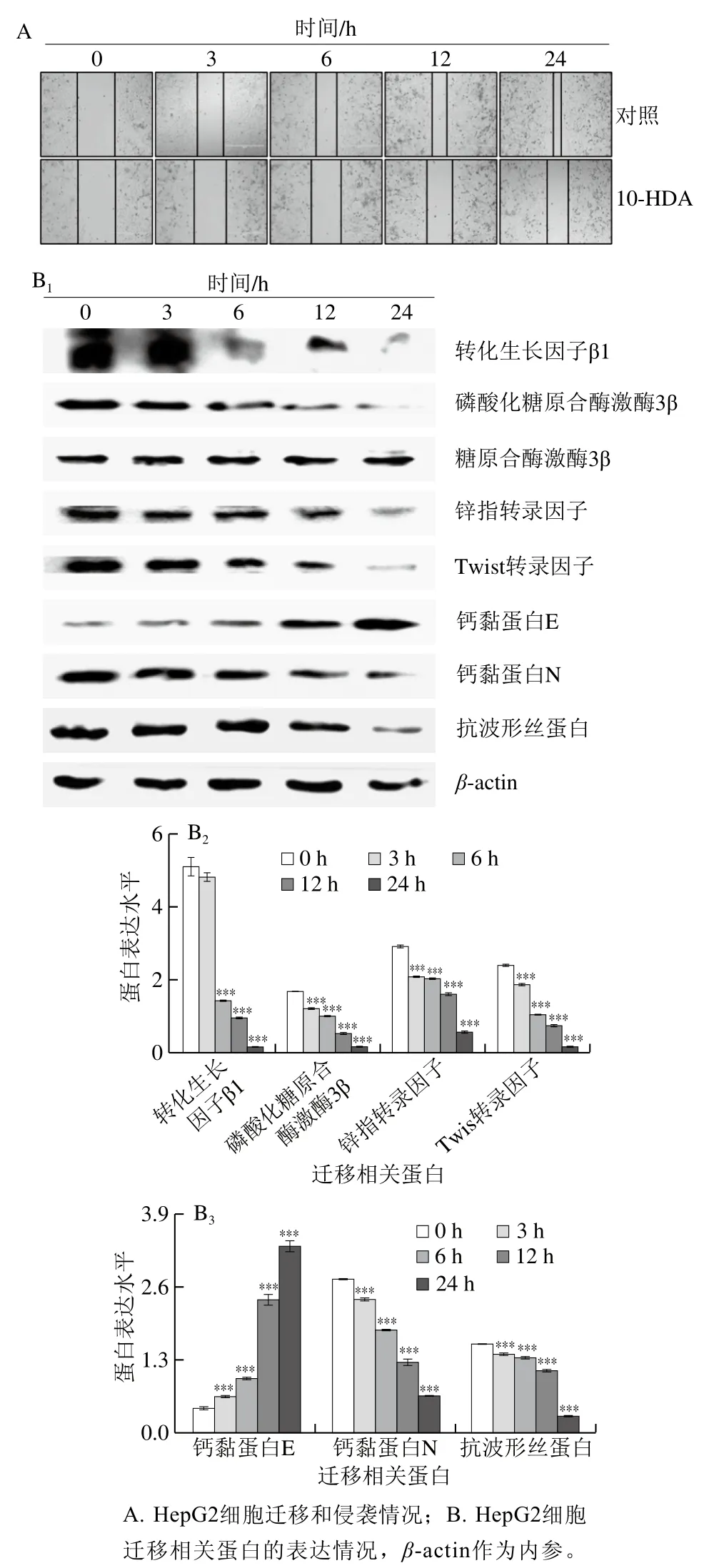
图7 10-HDA对HepG2细胞迁移和侵袭的影响Fig. 7 Effect of 10-HDA on the migration and invasion of HepG2 cells
2.7 10-HDA对肝癌细胞凋亡、周期阻滞及迁移的影响
根据以上研究结果,可绘制出10-HDA诱导肝癌细胞凋亡、周期阻滞及迁移抑制的信号通路图,见图8。通过信号通路图可看出,10-HDA通过介导细胞内ROS水平,从而调控MAPK/STAT3/NF-κB信号通路来诱导肝癌细胞凋亡,调控转化生长因子β1来抑制肝癌细胞的侵袭和转移。从分子水平上,表明10-HDA能够诱导肝癌HepG2细胞凋亡作用机制。
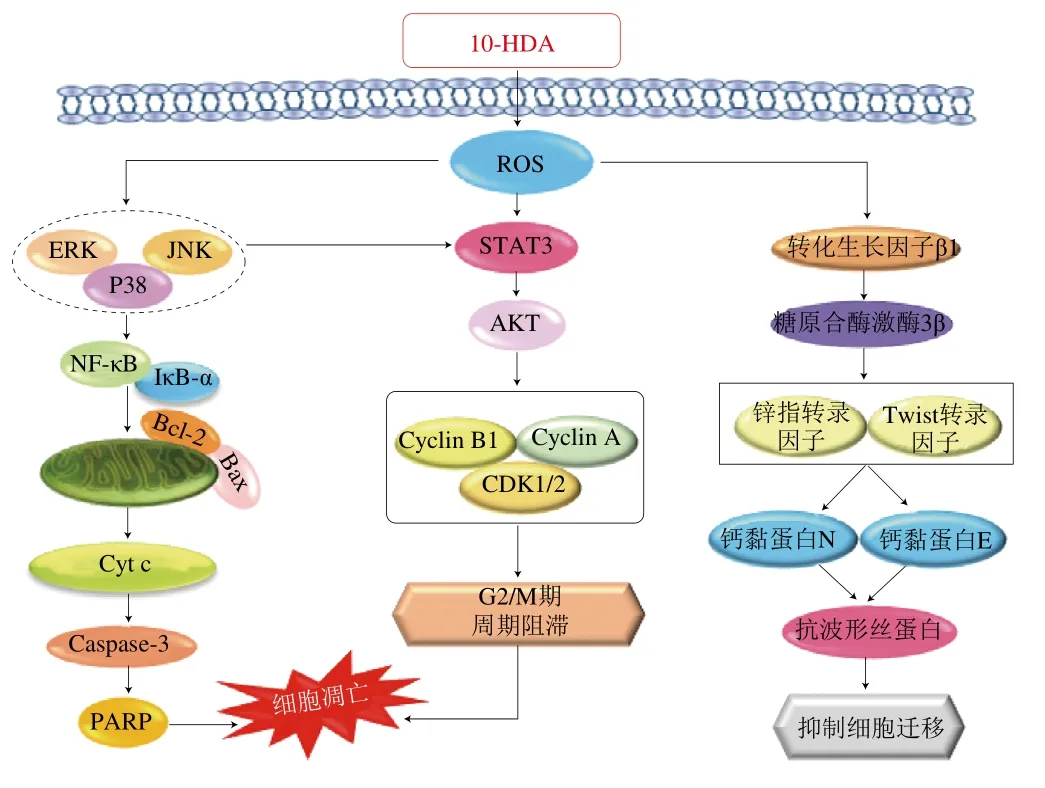
图8 10-HDA诱导肝癌细胞凋亡、周期阻滞及迁移抑制机制的示意图Fig. 8 Schematic diagram of 10-HDA-induced apoptosis, cycle arrest and migration inhibition in hepatocellular carcinoma cells
3 讨 论
10-HDA是蜂王浆中主要活性成分,具有抑制肿瘤细胞的分化、迁移和促进多种恶性肿瘤细胞凋亡或病例组织坏死的功效[28-29]。CCK-8检测结果表明10-HDA能明显抑制肝癌HepG2细胞的增殖,对肝癌HepG2细胞具有良好的杀伤作用。本实验从细胞增殖、凋亡、细胞周期分布、ROS水平调控的相关信号传导途径和细胞迁移5个方面分别证实10-HDA对肝癌细胞的影响。
上调ROS水平可抑制肿瘤细胞生长[30],有研究表明,正常细胞能够维持正常的ROS水平,而肿瘤细胞内的ROS水平明显高于正常细胞[31],这使肿瘤细胞对ROS的水平上升更为敏感,因此,可通过上调细胞内ROS的水平来诱导肿瘤细胞凋亡。本实验中,10-HDA上调了HepG2细胞ROS水平,导致MAPK、NF-κB、STAT3信号通路被激活,相关蛋白表达发生改变。MAPK信号通路是细胞增殖、分化、迁移和凋亡的关键,不同的细胞外刺激可以激活不同的MAPK信号通路,通过JNK、P38和ERK信号通路之间的相互调节来介导各种细胞生物反应。JNK和P38参与氧化应激反应、细胞分化和凋亡[30],ERK是传递有丝分裂原信号,调节细胞增殖、分化和存活的信号转导蛋白[32]。本实验结果表明,10-HDA通过上调ROS水平,激活了MAPK、NF-κB和STAT3信号通路,最终诱导肝癌HepG2细胞凋亡。
凋亡是一种细胞程序性死亡的过程,主要通过死亡受体途径和线粒体途径发生[8]。线粒体凋亡途径的关键组成部分Bcl-2蛋白家族(包括Bcl-2和Bax),位于线粒体上游[33],MAPK和NF-κB信号通路的激活导致下游的Bcl-2蛋白家族发生变化,其中促凋亡蛋白Bax使线粒体外膜通透化时,凋亡蛋白酶活化因子Cyt c得到释放,进而激活Caspase级联反应下游的Caspase-3[34]。Caspase-3是细胞凋亡启动的关键因子,参与包括PARP在内的许多关键蛋白的蛋白裂解[35]。结果表明,促凋亡蛋白Bax、Cyt c表达水平升高,抗凋亡蛋白Bcl-2表达水平降低,导致Caspase-3被激活,PARP表达水平升高。上述研究结果表明,10-HDA可通过调控Bax和Bcl-2的表达水平,破坏线粒体外膜的通透性,从而诱导肝癌HepG2细胞凋亡。
细胞周期阻滞是控制细胞增殖和诱导细胞凋亡的重要调控机制之一[36],下调STAT3活性可抑制AKT的磷酸化及激活[37],AKT在细胞存活、代谢、迁移和侵袭等信号通路中起重要的调控作用[38],抑制AKT信号通路的活性,可发生细胞周期阻滞[39]。结果表明,10-HDA通过上调ROS水平,激活STAT3信号通路,使STAT3磷酸化水平下降,从而抑制AKT的磷酸化水平,下游蛋白Cyclin B1、CDK1/2和Cyclin A表达水平下降,P21蛋白表达水平升高,最终诱导肝癌HepG2细胞在G2/M周期发生阻滞。
转化生长因子β1介导肿瘤细胞发生上皮-间质转化(epithelial-mesenchymal transition,EMT),是参与细胞侵袭、转移的关键因子,能够提高侵袭和迁移能力[40],通过抑制转化生长因子β1的表达来抑制肝癌HepG2细胞的侵袭和迁移[41]。有研究表明,通过增加ROS水平,抑制转化生长因子β1诱导的糖原合酶激酶3β磷酸化,而其下游锌指转录因子和Twist转录因子是钙黏蛋白E的关键转录因子[42],上调钙黏蛋白E蛋白的表达可以抑制癌细胞的迁移和侵袭,而钙黏蛋白N与之相反[43],此外,钙黏蛋白E的过表达导致抗波形丝蛋白表达降低,抑制了EMT的发生[44]。因此,抑制EMT的发生是抑制细胞迁移的重要过程。本实验中,10-HDA通过增加HepG2细胞ROS水平,下调了转化生长因子β1、磷酸化糖原合酶激酶3β、锌指转录因子、Twist转录因子、钙黏蛋白N和抗波形丝蛋白的表达水平,上调了钙黏蛋白E蛋白的表达水平,从而抑制了EMT的发生。以上研究结果表明,10-HDA能够抑制肝癌HepG2细胞迁移作用。
综上所述,10-HDA处理HepG2细胞后,细胞内ROS水平升高,激活MAPK、NF-κB和STAT3信号通路,触发线粒体依赖性凋亡,并在G2/M周期发生细胞阻滞,同时抑制了转化生长因子β1信号通路,抑制了细胞迁移和侵袭。该实验结果可为研究10-HDA的生理功能、肝癌发病机理及功能性食品开发提供一定的理论基础。
