3 种梨果实发育过程中酚类物质及其抗氧化能力分析
2022-01-06唐章虎吴翠云蒲云峰
姜 喜,唐章虎,吴翠云,*,王 鑫,蒲云峰,郭 丽
(1.塔里木大学园艺与林学学院,新疆 阿拉尔 843300;2.南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆 阿拉尔 843300;3.新疆农业科学院轮台果树资源圃,新疆 轮台 841600;4.塔里木大学生命科学学院,新疆 阿拉尔 843300)
梨是我国是仅次于苹果、柑橘的第三大水果[1]。‘库尔勒香梨’是蔷薇科(Rosaceae)梨亚科(Pomoideae)梨属(Pyrus)新疆梨(Pyrus sinkiangensisYu)植物,是西洋梨与白梨的杂交后代,栽培历史有1 400多年,是我国品质最优的地方梨品种之一,也是新疆最重要的梨品种,被誉为“梨中珍品”“果中王子”[2],是培育新品种的重要资源[3]。‘早酥梨’是我国目前栽培最广泛的早熟梨品种之一,具有优质、高产、早熟、抗逆性强的特点[4]。‘新梨7号’是以‘库尔勒香梨’为母本、‘早酥梨’为父本进行有性杂交培育的早熟梨新品种,具有早熟、优质、耐贮藏、货架期长等优点[5]。这些梨果实味甜多汁、清香爽口、酥脆少渣,且富含具有较强抗氧化活性的酚类物质,如绿原酸、芦丁、表儿茶素、儿茶素等[6-8],深受广大消费者的喜爱[3]。
酚类物质是植物重要的次生代谢产物之一[9],广泛存在于果蔬中,参与果蔬风味、色泽等感官品质的形成[10],还参与贮藏和加工过程中的褐变[11],具有清除机体内自由基、抗脂质氧化及延缓机体衰老等生物活性功能[12-13]。目前很多学者在刺梨[14-15]、龙眼[16]、枣[17]、葡萄[18]等果实中开展了酚类物质及抗氧化活性的研究。而‘库尔勒香梨’‘早酥梨’和‘新梨7号’果实发育过程中酚类物质及其抗氧化能力的变化规律还并不清楚。因此,本实验以生长发育期‘库尔勒香梨’‘早酥梨’及其杂交后代‘新梨7号’果实为试材,通过研究梨果实发育期间总黄酮、总酚、酚类物质和抗氧化能力(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力)的变化,并对其相关性进行分析,为进一步了解梨果实品质的形成提供理论依据,也为梨品质调控、贮藏及产品开发利用等提供科学依据。
1 材料与方法
1.1 材料与试剂
‘库尔勒香梨’‘早酥梨’和‘新梨7号’果实为塔里木大学校内种植,采用完全随机设计,各品种分别选取树势一致、生长良好的具代表性的3 株树,植株行距为2 m×4 m。于花后50 d开始采样,每隔15 d定期从梨树东、西、南、北和中心5个方位采集梨果实,每株树采集大小均一、无病虫害的10个果实,共30个果实,直至梨果实完全成熟,‘新梨7号’采摘至125 d,‘早酥梨’及‘库尔勒香梨’采摘至170 d。采摘后的果实迅速装入自封袋内,放入保温箱带回实验室备用。‘新梨7号’和‘早酥梨’的幼果期是果实坐果到花后50 d,而‘库尔勒香梨’果实的幼果期到花后65 d;‘新梨7号’和‘早酥梨’果实成熟期在花后110 d,‘库尔勒香梨’果实的成熟期在花后155 d。
熊果苷、儿茶素、绿原酸、表儿茶素、山柰酚-己糖-双脱氧己糖苷、芦丁、山柰酚-3-O-芸香糖苷、槲皮葡萄糖苷、槲皮素鼠李糖苷、山柰酚-3-O-葡萄糖苷、异鼠李素-3-O-葡萄糖苷(均为色谱纯) 阿拉丁试剂(上海)有限公司;草酸、酚酞、碳酸氢钠、碳酸钠 天津市致远化学试剂有限公司;Folin-Ciocalteu试剂 上海荔达生物科技有限公司;甲醇(分析纯和色谱纯)、亚硝酸钠、硝酸铝、氢氧化钠 上海源叶生物技术有限公司。其余试剂均为分析纯。
1.2 仪器与设备
2695-2489高效液相色谱仪、C18色谱柱(250 mm×4.6 mm,5 μm) 美国Waters公司;LC-20A液相色谱(配有RID20A检测器) 日本岛津公司;SHZ-82数显回旋式水浴恒温振荡器 金坛市金南仪器制造有限公司;SB25-12DTD超声波清洗机 宁波新芝生物科技股份有限公司;TGL-16M超低温冷冻离心机湖南长沙湘仪检测设备有限公司;TD-5A台式低速离心机 湖南凯达科学仪器有限公司;CP224S电子天平北京赛多利斯仪器系统有限公司;UV-6100紫外-可见分光光度计 上海元析仪器有限公司;PT-3502C全波长酶标仪 北京普天新桥技术有限公司;FD5-3真空冻干机美国GOLD-SIM公司。
1.3 方法
1.3.1 样品处理
供试梨果实洗净控干水分,每个果实横切成2~3 mm厚片,选取中间部位果实(包括果皮、果肉和果核),置于超低温冰箱(-80 ℃)预冻24 h,用真空冻干机干燥72 h,得到冻干梨片,用组织破碎机粉碎,置于-20 ℃冰箱中保存备用。
1.3.2 抗氧化物的提取
准确称取1.0 g梨果实冻干粉,置于50 mL离心管中,加体积分数80%甲醇溶液25 mL,常温超声(500 W)辅助提取30 min,3 500 r/min离心10 min,收集上清液,重复提取2 次,定容至25 mL。提取液用于总酚含量、总黄酮含量、DPPH自由基和ABTS阳离子自由基清除能力及多酚类物质含量的测定。
1.3.3 活性成分含量测定
总酚含量、总黄酮含量及多酚类物质含量的测定均参考Pu Yunfeng等[19]的方法并稍作修改。
1.3.3.1 总酚含量的测定
吸取0.2 mL提取液,加入10 mL体积分数80%甲醇溶液和0.3 mL 2 mol/L的Folin-Ciocalteu试剂,混匀后放置5 min,加入质量分数15% Na2CO3溶液1.0 mL,混匀。常温暗反应2 h,以体积分数80%甲醇溶液作空白对照,于746 nm波长处测定吸光度。以没食子酸为标准品绘制标准曲线,通过标准曲线计算梨果实中总酚含量,结果以每克梨果实(以干质量计)中所含没食子酸质量表示(单位为mg/g)。
1.3.3.2 总黄酮含量的测定
将5 mL提取液和0.5 mL质量分数5% NaNO3溶液加入离心管中,摇匀,常温反应6 min,加入0.5 mL质量分数10% Al(NO3)3溶液,混匀后常温反应6 min,加入质量分数4% NaOH溶液4 mL,混匀并常温反应20 min,在502 nm波长处测定样品的吸光度。以芦丁为标准品绘制标准曲线,通过标准曲线计算梨果实中总黄酮含量,结果以每克梨果实(以干质量计)中所含芦丁质量表示(单位为mg/g)。
1.3.4 抗氧化能力测定
DPPH自由基和ABTS阳离子自由基清除能力的测定均参考Pu Yunfeng等[19]的方法并稍作修改。
1.3.4.1 DPPH自由基清除能力测定
吸取20 μL的提取液和200 μL DPPH溶液,在恒温振荡器中匀速振荡反应30 min,于510 nm波长处测定样品的吸光度。以Trolox为标准品绘制标准曲线,通过标准曲线计算梨果实中DPPH自由基清除能力,结果以每克梨果实(以干质量计)中所含Trolox的物质的量表示(单位为μmol/g)。
1.3.4.2 ABTS阳离子自由基清除能力测定
吸取20 μL的提取液和200 μL ABTS溶液于96 孔板中,在恒温振荡器中匀速振荡反应10 min,在734 nm波长处测定样品的吸光度,以Trolox为标准品绘制标准曲线,通过标准曲线计算梨果实中ABTS阳离子自由基清除能力,结果以每克梨果实(以干质量计)中所含Trolox的物质的量表示(单位为μmol/g)。
1.3.5 酚类物质含量的测定
酚类物质含量的测定参考Pu Yunfeng等[19]的方法并稍作修改。将提取液用0.45 μm微滤膜过滤到1.0 mL进样瓶中,利用高效液相色谱仪测定酚类物质含量,每个样品重复测定3 次。流动相A:体积分数0.5%甲醇溶液,流动相B:乙腈;洗脱条件:0~5 min 95% A,5~30 min 95%~85% A,30~44 min 85%~76% A,44~50 min 76%~30% A,50~70 min 30%~10% A,70~75 min 10%~95% A。流速1.0 mL/min,检测波长280 nm,进样量10 μL,柱温30 ℃。标准曲线绘制:准确称取10 mg混合标准品,溶解于80%甲醇溶液中,定容至10 mL作为母液。将母液根据需要稀释成不同质量浓度,绘制标准曲线。样品中的酚类物质含量以梨果实干质量计。
1.4 数据处理与分析
采用Excel 2019软件统计分析数据,结果以平均值±标准差表示,采用SPSS 25统计软件进行显著性(单因素方差分析、Duncan新复极差法)和相关性分析(Pearson相关性分析法)。
2 结果与分析
2.1 生长发育期梨果实总酚及总黄酮含量变化
果实的抗氧化性能是酚类物质共同作用的结果,其中总酚和总黄酮发挥着非常重要的作用。由图1可以看出,3 种梨果实总酚含量在花后50~95 d急剧下降,随后呈缓慢波动下降的趋势,其变化趋势与苹果梨[20]相似。花后50 d不同品种梨幼果期果实总酚含量普遍较高,但不同品种总酚含量存在一定差异,‘早酥梨’中总酚含量明显高于其他两个品种,达23.10 mg/g,‘库尔勒香梨’和‘新梨7号’总酚含量分别为16.49 mg/g和15.61 mg/g。随着果实的生长,花后95 d‘新梨7号’总酚含量降至最低,为4.41 mg/g,花后155 d‘库尔勒香梨’和‘早酥梨’总酚含量降至最低,分别为2.56 mg/g和2.54 mg/g,此后均保持在较低水平直至果实成熟。
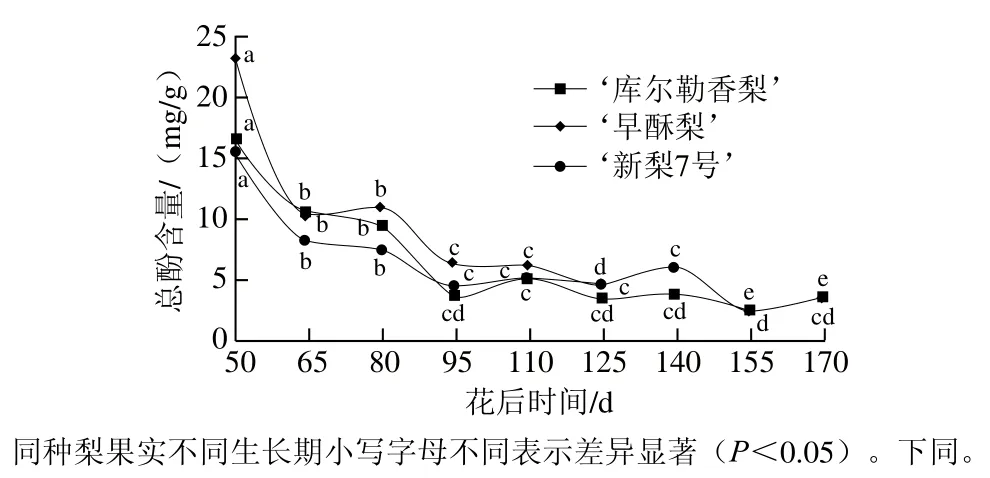
图1 梨果实生长发育期间总酚含量变化Fig. 1 Changes in total phenol content in pear fruit during development
由图2可知,3 种梨果实总黄酮含量与总酚含量变化趋势类似,即在花后50~95 d急剧下降,随后呈缓慢波动下降的趋势。幼果期果实内总黄酮含量普遍较高,‘早酥梨’中总黄酮含量明显高于其他两个品种,达32.25 mg/g,‘库尔勒香梨’和‘新梨7号’总酚含量分别为26.20 mg/g和24.82 mg/g。随着果实的生长,‘库尔勒香梨’花后95 d总黄酮含量降至最低,为2.87 mg/g,此后在2.95~4.74 mg/g范围内变化;‘新梨7号’花后125 d总黄酮含量降至最低,为3.69 mg/g;‘早酥梨’在花后95~170 d总黄酮含量在4.57~9.93 mg/g范围内变化,其花后155 d总黄酮含量降至最低,为2.87 mg/g。
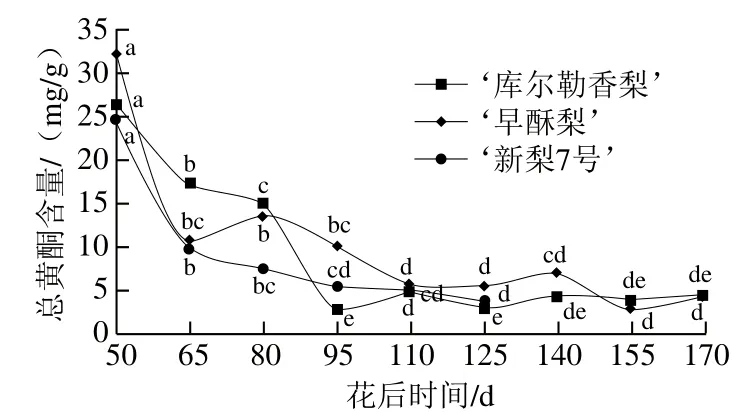
图2 梨果实生长发育期间总黄酮含量变化Fig. 2 Changes in total flavonoid content in pear fruit during development
从整体看,在果实整个生长发育过程中,总酚和总黄酮含量大小均为‘早酥梨’>‘新梨7号’和‘库尔勒香梨’。研究表明,总酚和总黄酮含量在同品种梨果的不同部位也存在差异,果皮中含量最高,其次为果心,果肉中的含量最低[21]。此外,总酚和总黄酮的高含量并不总能带来品质优势,其与果肉的褐变程度也有密切关系,总酚含量越高越容易引起褐变,影响其商品价值[22]。而多酚氧化酶是催化多酚褐变反应最主要的酶,因此为了保持果实的总酚与总黄酮含量,可以适当抑制多酚氧化酶的活性[23],提高果实的营养与商品价值。
2.2 生长发育期梨果实抗氧化能力变化
抗氧化能力是多酚类化合物最重要的功能性质[20]。DPPH自由基和ABTS阳离子自由基是两种非常稳定并且带有颜色的人工合成自由基,当有供氢能力的抗氧化剂(如酚类)存在时,自由基可与质子结合形成无色的中间产物,使自由基溶液逐渐褪色[24-25],吸光度变小。因此,可根据吸光度的变化评价抗氧化剂的活性。由图3可知,花后50 d幼果期果实DPPH自由基清除能力普遍较高,‘早酥梨’中DPPH自由基清除能力明显高于其他两个品种,达到29.12 μmol/g,而‘库尔勒香梨’和‘新梨7号’DPPH自由基清除能力分别为27.96 μmol/g和26.64 μmol/g。随着果实的生长,花后95~170 d‘库尔勒香梨’果实DPPH自由基清除能力均在3.87~7.33 μmol/g范围内变化,且差异不显著(P>0.05),花后125 d‘库尔勒香梨’果实DPPH自由基清除能力降至最低,比花后50 d果实DPPH自由基清除能力降低了86.16%;‘早酥梨’果实在花后95~170 d DPPH自由基清除能力在5.77~8.65 μmol/g范围内变化,且差异总体不显著(P>0.05),花后170 d‘早酥梨’果实DPPH自由基清除能力降至最低,为5.77 μmol/g;‘新梨7号’果实在花后80 d后DPPH自由基清除能力在5.66~6.74 μmol/g范围内变化,且差异不显著(P>0.05)。进一步观察数据可以发现在50~95 d之间,梨果的DPPH自由基清除能力急剧下降,且在此之后缓慢下降,这与果实总酚与总黄酮含量的变化趋势相吻合。这一结果与连翘叶的相关研究结果[26]一致,说明多酚类化合物和黄酮类成分具有良好的清除自由基效果,是重要的抗氧化成分。
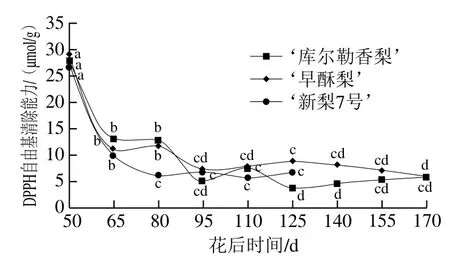
图3 梨果实生长发育期间DPPH自由基清除能力变化Fig. 3 Changes in DPPH radical-scavenging capacity in pear fruit during development
由图4可知,梨果实ABTS阳离子自由基清除能力因品种和生长发育时期不同而异,随着果实的生长呈现先降低后升高再降低的变化趋势。3 种梨果实ABTS阳离子自由基清除能力的峰值均出现在花后80 d,‘早酥梨’果实ABTS阳离子自由基清除能力最高,达80.74 μmol/g,而‘库尔勒香梨’和‘新梨7号’果实ABTS阳离子自由基清除能力分别为64.47 μmol/g和55.19 μmol/g。‘早酥梨’在花后110~140 d ABTS阳离子自由基清除能力在9.83~11.29 μmol/g范围内变化,且差异不显著(P>0.05),花后155 d果实ABTS阳离子自由基清除能力为6.45 μmol/g;‘新梨7号’在花后110 d后ABTS阳离子自由基清除能力在7.99~9.40 μmol/g范围内变化,且差异不显著(P>0.05);花后125 d后‘库尔勒香梨’果实ABTS阳离子自由基清除能力在6.10~7.59 μmol/g范围内变化。在本研究中,ABTS阳离子自由基清除能力的总体变化趋势与DPPH自由基一致,均是在果实幼果期较高,在成熟时达到最低水平。ABTS阳离子自由基清除能力在果实发育早期呈现较大的波动,在花后80 d时达到最高水平,但DPPH自由基清除能力在花后80 d后仅是波动上升,在观赏海棠果的研究[27]中也得到类似结果。这可能是因为梨果中部分抗氧化物质对ABTS阳离子自由基清除能力要强于DPPH自由基。
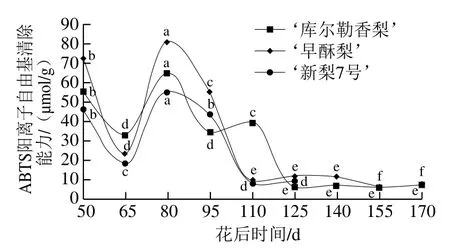
图4 梨果实生长发育期间ABTS阳离子自由基清除能力变化Fig. 4 Changes in ABTS cation radical-scavenging capacity in pear fruit during development
综上,果实整个生长发育过程中,DPPH自由基清除能力和ABTS阳离子自由基清除能力为‘早酥梨’高于‘新梨7号’和‘库尔勒香梨’,而‘新梨7号’和‘库尔勒香梨’差异不明显。
2.3 生长发育期梨果实酚类物质组成与含量变化
酚类物质是梨果实中具有抗氧化活性的主要成分。由表1可知,3 种梨果实中均检测出熊果苷、儿茶素、绿原酸、表儿茶素、山柰酚-双脱氧己糖苷、芦丁、山柰酚-3-O-芸香糖苷、槲皮葡萄糖苷、槲皮素鼠李糖苷、山柰酚-3-O-葡萄糖苷和异鼠李素-3-O-葡萄糖苷11 种酚类物质,且同种梨不同生长发育阶段的酚类物质含量均存在差异。随着果实的生长,‘库尔勒香梨’‘早酥梨’和‘新梨7号’果实的熊果苷、儿茶素、绿原酸、表儿茶素、槲皮葡萄糖苷、山柰酚-3-O-葡萄糖苷含量总体逐渐降低,均在花后50 d含量最高。整个生长发育过程中,梨果实的11 种酚类物质中,熊果苷含量最高,平均值为5 797.82 μg/g;其次是绿原酸含量,平均值为1 781.02 μg/g;最少的是异鼠李素-3-O-葡萄糖苷,平均值为11.46 μg/g。‘库尔勒香梨’‘早酥梨’和‘新梨7号’果实幼果期熊果苷含量和绿原酸含量分别是成熟期的10.41、6.94 倍,13.32、19.08 倍和5.09、6.59 倍。从结果可以看出,不同酚类物质的变化规律与幅度因品种不同而略有差异,这说明酚类物质在不同梨果品种的代谢积累过程存在差异,同时也伴随着果实膨大而造成的含量差异。因此,可进一步研究品种间的多酚物质积累规律,为梨果的育种提供理论依据。
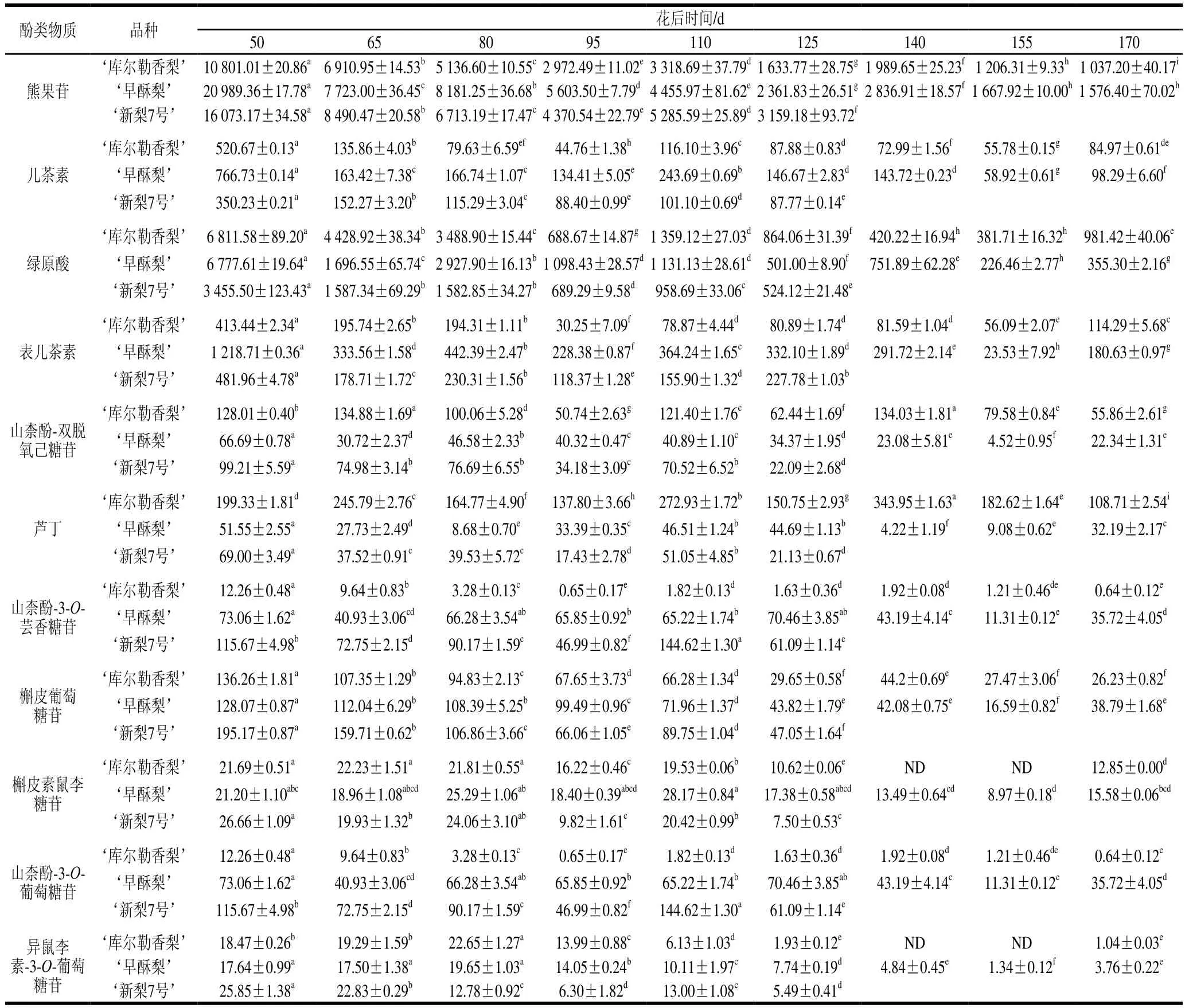
表1 生长季梨果实酚类物质组成与含量变化Table 1 Changes in phenolic composition and contents in pear fruit during development μg/g
‘早酥梨’果实熊果苷、儿茶素、表儿茶素和槲皮素鼠李糖苷含量均比‘库尔勒香梨’高,分别均高出36.81%、37.66%、63.53%和25.37%。3 种梨果实山柰酚-双脱氧己糖苷、芦丁、山柰酚-3-O-芸香糖苷和槲皮素鼠李糖苷含量在整个生长发育期波动较大,不同品种之间存在差异。其中,‘库尔勒香梨’果实中山柰酚-双脱氧己糖苷、芦丁和山柰酚3-O-葡萄糖苷含量明显高于‘早酥梨’和‘新梨7号’,分别高出64.30%和34.66%、85.72%和80.43%、89.61%和87.44%。整个生长发育期,‘库尔勒香梨’槲皮素鼠李糖苷和异鼠李素-3-O-葡萄糖苷在花后140 d和155 d均未测出。从表1可以看出,梨果中熊果苷与绿原酸的含量远超其他的多酚类物质。其中在幼果期,‘早酥梨’的熊果苷含量远高于‘库尔勒香梨’与‘新梨7号’。因此‘早酥梨’的幼果可作为熊果苷的优质天然来源,其提取物还可应用于化妆品[28]。
2.4 梨果实生长发育期总黄酮、总酚、酚类物质含量与抗氧化活性的相关分析
由表2可知,3 种梨果实中总黄酮、总酚、熊果苷、绿原酸、表儿茶素、槲皮葡萄糖苷和异鼠李素-3-O-葡萄糖苷含量与抗氧化活性(DPPH自由基清除能力和ABTS阳离子自由基清除能力)呈极显著正相关(P<0.01),其中总黄酮、总酚、绿原酸含量与DPPH自由基清除能力的相关系数均大于0.9,且相关系数由大到小为总黄酮含量>总酚含量>绿原酸含量,这与曾少敏等[6]的报道基本一致,说明总黄酮、总酚对果实抗氧化活性起到极其重要的作用,尤其是酚类物质中的绿原酸。梨果实DPPH自由基清除能力与儿茶素含量呈极显著正相关(P<0.01),与槲皮素鼠李糖苷含量呈显著正相关(P<0.05);梨果实ABTS阳离子自由基清除能力与槲皮素鼠李糖苷含量呈极显著正相关(P<0.01),与儿茶素含量呈显著正相关(P<0.05),说明即便DPPH与ABTS阳离子清除能力皆为抗氧化活性指标,但是不同的酚类物质起到的作用也不尽相同,因此对于抗氧化活力的评价需要综合分析。除此之外,山柰酚-双脱氧己糖苷、芦丁、山柰酚-3-O-芸香糖苷和山柰酚-3-O-葡萄糖苷含量与抗氧化能力(DPPH自由基清除能力和ABTS阳离子自由基清除能力)的相关性均不显著,说明这些酚类并不是果实抗氧化活性的主要贡献者。以上结果可以解释DPPH自由基和ABTS阳离子自由基清除能力在不同发育时期变化趋势的差异,今后可以进一步研究各类抗氧化物质对自由基的清除能力,以提高梨果的品质。
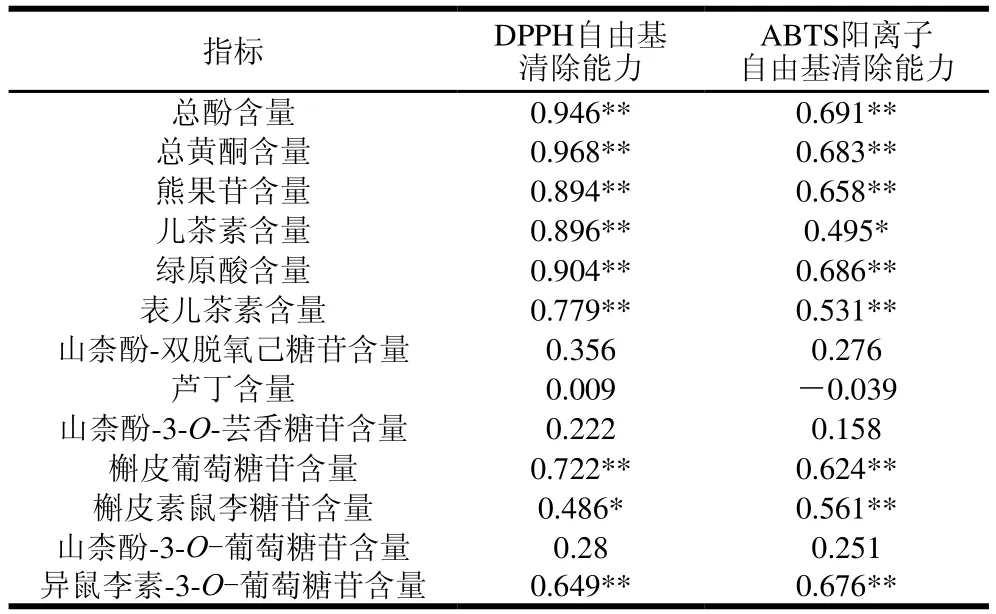
表2 梨果实生长发育期总酚、总黄酮、酚类物质含量与抗氧化能力的相关性分析Table 2 Correlation coefficients between contents of total phenolics,total flavonoids, individual phenolics and antioxidant capacity in pear fruit during development
3 讨 论
果实的抗氧化性能是酚类物质共同作用的结果,而其中总酚和总黄酮发挥着非常重要的作用。本研究通过对比分析‘库尔勒香梨’‘早酥梨’和‘新梨7号’果实生长发育期间总黄酮、总酚、熊果苷、儿茶素、表儿茶素、绿原酸等酚类物质含量及抗氧化能力的变化,发现梨果实总酚含量、总黄酮含量、DPPH自由基清除能力在整个生长发育过程中呈逐渐降低的变化趋势,在幼果期果实含量较高。幼果中酚类物质对DPPH自由基具有较好的清除作用,且幼果DPPH自由基清除能力显著高于成熟果,赵金伟等[20]也得出相似的研究结果,这可能与梨果实成熟时的酚类物质大量向种子运输有关。本研究表明梨果实总酚含量、总黄酮含量、DPPH自由基清除能力和ABTS阳离子自由基清除能力大小均为‘早酥梨’>‘新梨7号’和‘库尔勒香梨’,说明‘早酥梨’抗氧化能力最强,这与李丽梅等[29]的报道一致,有关具体的抗氧化作用机理还需进一步研究。
本研究中‘库尔勒香梨’‘早酥梨’和‘新梨7号’随着果实的生长,果实的熊果苷、儿茶素、绿原酸、表儿茶素、槲皮葡萄糖苷、山柰酚-3-O-葡萄糖苷和异鼠李素-3-O-葡萄糖苷含量逐渐降低,与总酚、总黄酮含量的变化趋于一致,且熊果苷和绿原酸含量是梨果实酚类物质的主要成分,在梨果实酚类物质含量中占有较高的比例,这与Cui Tong[28]和Lee[30]等的报道一致。史国安等[31]以‘黑沙梨’和‘红沙梨’为试材进行研究,结果表明2 种沙梨果实含有丰富的类黄酮和绿原酸,具有显著的羟自由基清除能力和较强的抗氧化活性。熊果苷具有止咳、抗菌、治疗泌尿生殖道感染、抑制人类黑色素的生物合成等作用,在药品及食品的开发应用中越来越受到关注。张小双等[32]发现在‘早酥梨’和‘南果梨’中,除果肉和果心外,其他部位含量最高的酚类物质均为熊果苷。本实验发现‘早酥梨’中熊果苷是含量最高的酚类物质,‘早酥梨’果实熊果苷的含量比绿原酸含量高,这与黄怡等[33]的报道基本类似,他们以‘苹果梨’‘早酥梨’和‘皇冠梨’果皮为试材研究其酚类物质,结果显示8 种主要酚类物质中熊果苷含量最高,其中‘早酥梨’的熊果苷含量最高。
果实中总黄酮、总酚、熊果苷、绿原酸、表儿茶素、槲皮葡萄糖苷和异鼠李素-3-O-葡萄糖苷含量与抗氧化能力(DPPH自由基清除能力和ABTS阳离子自由基清除能力)呈极显著正相关(P<0.01),表明这些酚类物质是梨果实抗氧化活力的主要贡献者。
综上,3 种梨幼果期酚类物质及抗氧化能力较高,且梨果实酚类物质最主要的成分为熊果苷及绿原酸,本研究明确了‘库尔勒香梨’‘早酥梨’和‘新梨7号’3 种梨酚类物质含量及抗氧化能力的变化规律,可为梨品质调控、贮藏及产品开发利用等提供一定理论依据。
