红豆皮多酚提取物对两种致病菌的抑菌活性及作用机理
2022-01-06葛思彤任世达刘景圣
贾 睿,蔡 丹,葛思彤,任世达,刘景圣
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
食源性致病菌污染是影响食品安全和引发公共卫生事件的潜在威胁因素,常见的致病菌包括大肠埃希菌、沙门氏菌、金黄色葡萄球菌和单核细胞增生李斯特菌等,这些致病菌具有较强的耐受干燥、酸、盐、热等环境因素的能力,导致其可以在食品生产、加工和贮藏过程中长期生存。化学来源的抑菌剂是有效的防控方式,但其在抑制腐败微生物和致病菌生长的同时,可能存在安全隐患并可能使致病微生物产生耐药性,从而引发了较多争议[1]。研究发现,苍山子中的槲皮素对金黄色葡萄球菌和溶血性链球菌具有较强的抑菌活性[2];柑橘类水果中的柚皮素具有抑制鼠伤寒沙门氏菌的作用[3];茶叶中的茶多酚可显著抑制革兰氏阳性菌生长[4]。这些天然产物提取物除了表现出抑制致病菌活性外,还具有绿色、安全、高效等特点,往往采用单独或与蛋白、多糖混合成膜喷洒、包埋或涂抹等方式应用于食品的抑菌中。
粮食副产物中富含具有生物活性的次级代谢产物,如酚类化合物。酚类化合物具有调节血糖、预防动脉粥样硬化、抗氧化和抗炎等多种生理活性,研究表明大麦提取物中的大麦多酚对金黄色葡萄球菌、单增李斯特菌、大肠杆菌等均有抑制生长作用[5-7]。红豆(Vigna angularis)是一种一年生半缠绕草本植物,《本草纲目》中记载其有助于抗水肿、腹泻和呕吐等[8]。红豆在现代粮食加工过程中常会产生大量的副产物——红豆皮,红豆皮中富含三萜皂苷、酚类化合物、植物甾醇和色素等生物活性物质,其中的酚类化合物被认为是生物活性最高的代谢产物之一,主要包含儿茶素苷、槲皮素苷、杨梅素3-鼠李糖苷、花色苷和原花青素二聚体等[9-10]。目前国内外研究多集中于红豆皮成分以及抗氧化活性方面,对于红豆皮多酚提取物的抑菌活性及抑菌机理鲜见报道。
综上,本实验以红豆皮为原料,采用超声波辅助醇提法制备红豆皮多酚提取物,分析其对李斯特菌、沙门氏菌两种食源性致病菌的抑菌活性,并探究其抑菌机理,以期为粮食源抑菌剂的开发与应用提供理论参考。
1 材料与方法
1.1 材料与试剂
红豆皮取自吉林农业大学小麦和玉米深加工国家工程实验室;李斯特菌ATCC19119(ListeriainnocuaATCC19119)(G+)、沙门氏菌ATCC14028(SalmonellaATCC14028)(G-)均取自吉林农业大学。
膜电位荧光探针DiBAC4(3) 北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒、ATP检测试剂盒、碱性磷酸酶检测试剂盒 上海碧云天生物技术有限公司。所有试剂均为国产分析纯;液相色谱试剂均为色谱级。
1.2 仪器与设备
HZQ-F160全温振荡培养箱、DL-CL-ND超净工作台哈尔滨市东联电子技术开发有限公司;Autoclave 4001136高压灭菌锅 上海博迅实业有限公司医疗设备厂;FLUO star Omega全自动多功能酶标仪 德国BMG Labtech公司;Z36HK超高速冷冻离心 德国Hermle公司;FD-1B-50冷冻干燥机 北京博医康仪器有限公司;HD-3紫外检测器、BSZ-100自动部分收集器、玻璃层析柱(1.8 cm×30 cm) 上海沪西分析仪器厂;GeminiSEM场发射扫描电子显微镜 德国卡尔蔡司公司;1200型高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 红豆皮多酚提取物的制备
根据Luo Jiaqiang等[11]的方法并略作修改制备红豆皮多酚提取物。称取红豆皮粉末2.000 g,置于200 mL烧杯中,以料液比1∶30加入体积分数70%的乙醇溶液,搅拌均匀。然后在室温条件下,360 W超声处理30 min,样液取出后立即离心20 min(4 000 r/min),取上清液,通过45 ℃旋转蒸发浓缩粗提物。利用AB-8大孔树脂进行纯化(上样液质量浓度2.5 mg/mL、上样液体积330 mL、流速1 mL/min、体积分数70%乙醇溶液洗脱),将纯化液用旋转蒸发器浓缩,冷冻干燥后得到粉末状红豆皮多酚提取物,-20 ℃保存备用。
采用Folin-Ciocalteu法测定红豆皮多酚提取物的多酚含量,根据文献[12]方法略作修改。绘制没食子酸标准曲线:配制质量浓度分别为0、4、8、12、16、20、24 μg/mL的没食子酸溶液,吸取各质量浓度溶液1 mL,加入Folin-Ciocalteu试剂2.5 mL以及质量分数15%的Na2CO3溶液2 mL于比色管中,加去离子水定容至10 mL,摇匀,在黑暗处静置2 h,然后在96 孔板酶标仪中于765 nm波长处测定吸光度,得到标准曲线线性回归方程:y=0.015 8x+0.046 6,R2=0.9988。精确吸取适量红豆皮多酚提取物干粉配制的溶液50 μL,按上述方法处理并测定吸光度。通过标准曲线方程计算出溶液中多酚的质量浓度,每组做3个平行。根据下式计算出红豆皮提取物的多酚含量为(145.28±2.21)mg/g。
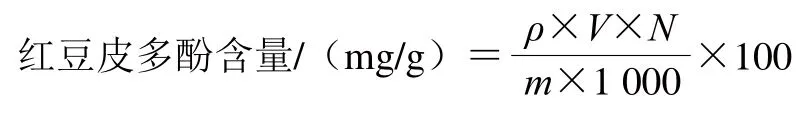
式中:ρ为红豆皮多酚的质量浓度/(mg/mL);V为提取液体积/mL;N为稀释倍数;m为红豆皮提取物干粉的质量/g。
1.3.2 高效液相色谱测定红豆皮多酚组成
为了进一步分析纯化后红豆皮多酚类物质的组成成分,将纯化后的红豆皮多酚提取物溶于色谱级甲醇中,稀释至1 mg/mL,通过0.45 μm有机滤膜过滤,并使用Zorbox SB-C18色谱柱(150 mm×4.6 mm,3.5 μm),通过高效液相色谱仪对红豆皮多酚提取物混合液的组成成分进行分析。色谱参数:柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL;流动相A:甲醇;流动相B:体积分数0.5%冰醋酸。洗脱条件:0~5 min,5% A;5~10 min,8% A;10~20 min,12% A;20~30 min,20% A;30~40 min,40% A;40~50 min,50% A;50~60 min,60% A;60~65 min,70% A;65~70 min,80% A。比较样品色谱峰保留时间与标准品保留时间,判定红豆皮多酚提取物中单体酚的组成。
1.3.3 红豆皮多酚提取物最小抑菌浓度的测定
参考Kanatt等[13]的二倍等度稀释96 孔板法测定红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028两种供试菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。将两种细菌分别接种于LB液体培养基,于37 ℃、180 r/min条件下培养至对数期(OD600nm=0.6)(培养条件后同),红豆皮多酚提取物用二倍稀释法通过LB液体培养基稀释至不同质量浓度(5 000、2 500、1 250、625、312、156 mg/mL),将50 μL对数期菌液与50 μL不同质量浓度多酚提取物溶液于96 孔板内混合均匀后,37 ℃条件下培养24 h,通过酶标仪测定菌液OD600nm,以没有菌体生长(未检测到OD600nm)所对应的多酚提取物终质量浓度为MIC。以无菌水和10 μg/mL氨苄西林分别为阴性和阳性对照。
1.3.4 红豆皮多酚提取物对食源性致病菌生长曲线影响的测定
使用Taukoorah等[14]的方法,取培养至对数期的两种供试菌50 mL和不同质量浓度的红豆皮多酚提取物溶液,加入到100 mL新鲜LB培养基中,使红豆皮多酚提取液的终质量浓度分别为0(对照)、1 MIC、2 MIC。以终质量浓度0.01 g/mL的氨苄西林作为阳性对照。置于37 ℃、180 r/min恒温摇床中培养,并从0 h开始,每小时取一次样,测定OD600nm。以培养时间与OD600nm的关系绘制生长曲线。
1.3.5 菌体细胞膜完整性的测定
将50 mL培养至对数期的两种供试菌在4 ℃、5 000 r/min下离心5 min,收集菌体并用无菌生理盐水洗涤3 次,离心后用生理盐水重悬至107CFU/mL。将5 mL菌悬液与5 mL不同质量浓度(2 MIC、4 MIC)多酚提取物溶液混合,并在37 ℃下孵育,以相同体积的生理盐水作为阴性对照。分别培养1、2、3、4、5 h和6 h,离心(4 ℃、5 000 r/min、5 min)去除菌体,得到上清液,经0.22 μm醋酸纤维素滤膜过滤。过膜后按照BCA试剂盒说明测定蛋白质量浓度。同时利用紫外分光光度计测定上清液OD260nm,通过OD260nm来确定细胞内核酸的泄漏情况[15-16]。
1.3.6 菌体细胞膜电位的测定
将两种供试菌在LB培养基中培养至对数期,取50 mL菌液离心(4 ℃、5 000×g、5 min)并将菌体沉淀用磷酸盐缓冲液洗涤3~4 次,用磷酸盐缓冲液调整菌液浓度至107CFU/mL。用二甲基亚砜将DiBAC4(3)溶解后加至黑色不透明96 孔板中,加入125 μL菌液和终浓度1 μmol/L的DiBAC4(3)荧光探针,在37 ℃培养箱中平衡30 min,之后加入125 μL红豆皮多酚提取物溶液,使其终质量浓度分别达到0(对照)、1 MIC、2 MIC。利用多功能酶标仪在激发波长和发射波长分别为492 nm和515 nm条件下测定相对荧光强度,以相对荧光强度表征细胞膜电位[17]。
1.3.7 菌体细胞内ATP含量的测定
将两种供试菌接种至LB液体培养基中培养至对数期,取50 mL菌液离心(4 ℃、5 000 r/min、5 min)收集菌体,并用无菌生理盐水洗涤3 次,再用无菌生理盐水重悬至107CFU/mL,取菌悬液1 mL加入1 mL红豆皮多酚提取物溶液,使红豆皮多酚提取物终质量浓度分别为0(对照)、1 MIC、2 MIC,置于37 ℃的恒温培养箱中培养30 min。按照ATP检测试剂盒说明书处理样品,利用多功能酶标仪测定荧光相对发光值,以相对发光值表征菌体细胞内ATP含量[18]。
1.3.8 菌体细胞外碱性磷酸酶活力的测定
将50 mL培养至对数期的两种供试菌在4 ℃、5 000 r/min条件下离心5 min,收集菌体并用无菌生理盐水洗涤3 次,再用无菌生理盐水重悬至107CFU/mL。将5 mL菌悬液与5 mL不同质量浓度的红豆皮多酚提取物溶液混合,使其终质量浓度分别为1 MIC、2 MIC,并在37 ℃下孵育0、3、6、9 h和12 h。将混合物以8 000 r/min离心10 min后,根据试剂盒说明测定碱性磷酸酶活力。
1.3.9 菌体形态的观察
根据Chen Mingshun等[19]的方法加以改进观察菌体形态。将50 mL培养至对数期的两种供试菌在4 ℃、5 000 r/min条件下离心5 min,收集菌体,用无菌生理盐水洗涤3 次后,再用无菌生理盐水重悬至107CFU/mL。向5 mL菌悬液中加入5 mL不同质量浓度的红豆皮多酚提取物溶液,使其终质量浓度分别为0(对照)、1 MIC、2 MIC,培养12 h后4 ℃、8 000 r/min条件下离心,沉淀用0.1 mol/L磷酸盐缓冲液洗涤,4 ℃、8 000 r/min离心并弃上清液,用体积分数2.5%戊二醛溶液4 ℃过夜固定。随后用0.1 mol/L磷酸盐缓冲液冲洗,依次用体积分数20%、60%、80%、90%和100%乙醇进行梯度脱水。脱水结束后,用乙醇-叔丁醇(1∶1,V/V)溶液置换20 min,最后用体积分数100%叔丁醇置换两次。置换后将样品进行干燥处理,干燥后的样品进行离子溅射仪喷镀后,通过加速电压为5 kV的场发射扫描电子显微镜进行微观形貌观察。
1.3.10 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
采用Wang Chenjie等[20]的方法进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)。将50 mL培养至对数期的两种供试菌在4 ℃、5 000 r/min条件下离心5 min,收集菌体,用无菌生理盐水洗涤3 次后,再用无菌生理盐水重悬至107CFU/mL。取5 mL菌悬液,加入5 mL相应质量浓度的红豆皮多酚提取液,使其终质量浓度1 MIC,以等体积无菌水和10 μg/mL氨苄西林为阴性和阳性对照,37 ℃恒温培养0、2、4、6、8、10、12 h,在8 000 r/min下离心10 min,弃上清液,用无菌生理盐水洗涤菌体两次后重悬于无菌生理盐水(107CFU/mL)中,取5 μL菌液加入等体积上样缓冲液,在100 ℃水浴中加热10 min。采用质量分数12%的分离胶和质量分数5%的浓缩胶进行电泳,利用质量分数0.1%的考马斯亮蓝R250染色,凝胶脱色好后用凝胶成像仪进行观察并拍照。
1.4 数据统计与分析
使用SPSS Statistics 24软件进行数据分析,利用Duncan’s多重比较进行差异显著性分析,以P<0.05表示差异显著,P<0.01表示差异极显著。使用Origin 2017软件作图。
2 结果与分析
2.1 红豆皮多酚组成分析结果
如表1所示,红豆皮多酚中含量相对较高的多酚化合物是槲皮素与金丝桃苷。据报道,槲皮素是一种具有抗菌和抗氧化活性的黄酮类化合物[21-22],同时在癌症治疗中具有促进癌细胞凋亡和抑制癌细胞增殖的作用[23-24]。金丝桃苷也具有多种药用特性,如抗炎、抗病毒、抗氧化和抗肿瘤等[25]。芦丁是一种黄酮类化合物,广泛存在于芸香叶、烟叶和橙皮等植物中[26];山柰酚是一种黄酮醇类化合物,能够有效抑制癌细胞增殖和转移[27];表儿茶素是儿茶素类化合物,属于黄烷醇化合物,与儿茶素互为同分异构体,具有预防癌症、止泻、止血、抗真菌及以预防胃溃疡等作用,同时表儿茶素可以通过抑制葡萄球菌生物膜的形成达到抗菌的效果[28-29]。此外,红豆皮多酚还含有多种酚酸,包括没食子酸、绿原酸、阿魏酸、对香豆酸和咖啡酸,这些酚酸具有如抗氧化、抗菌、抗炎等生物活性[30]。因此,从红豆皮多酚组成分析结果可知,红豆皮富含多酚类物质,可作为一种天然抗氧化剂和抗菌剂的良好来源。
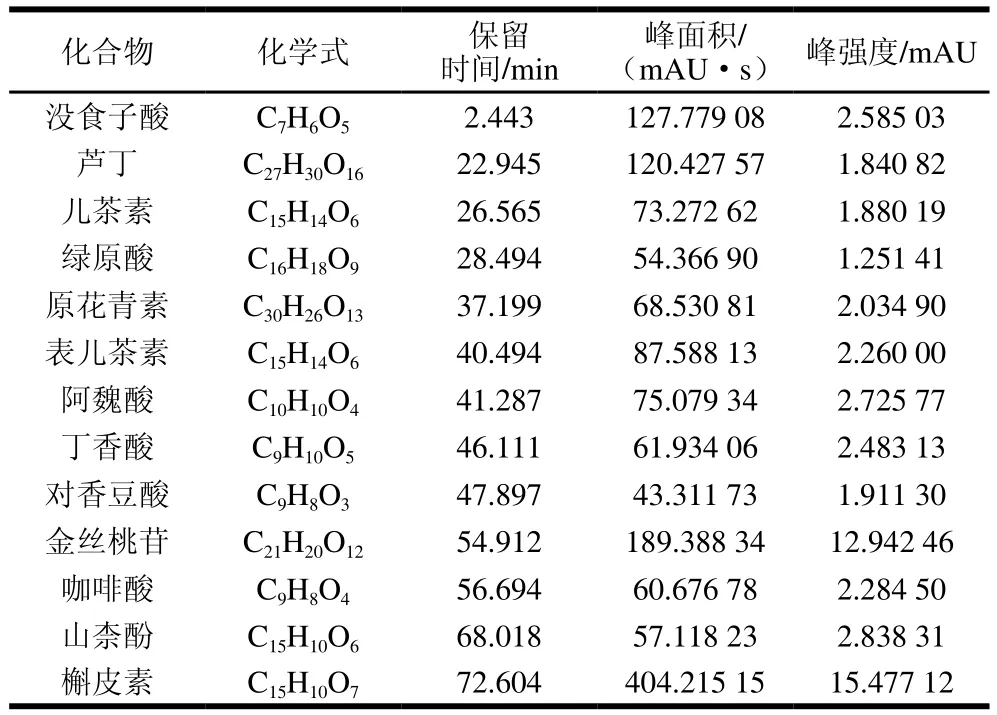
表1 红豆皮多酚组分Table 1 Polyphenol composition of adzuki bean seed coat
2.2 红豆皮多酚提取物对食源性致病菌的最小抑菌浓度
如表2所示,红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028的MIC分别为625 μg/mL和2 500 μg/mL。可以看出,红豆皮多酚提取物对革兰氏阳性和阴性细菌的生长均具有抑制作用。但是,其效果因微生物类型和红豆皮多酚提取物浓度而异,可能主要与菌体细胞壁结构的差异有关,革兰氏阳性菌只有单层细胞壁,而革兰氏阴性菌则具有外膜和独特的胞质间隙,因此,与革兰氏阴性菌相比,多酚更容易破坏单层细胞壁,抑制菌体的核酸合成以及能量代谢等生物学功能[31]。
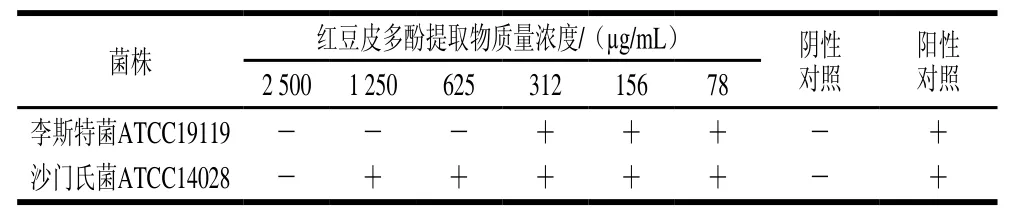
表2 红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028的MICTable 2 MICs of adzuki bean seed coat polyphenols against Listeria ATCC19119 and Salmonella ATCC14028
2.3 红豆皮多酚提取物对食源性致病菌生长曲线的影响
由图1可知,与对照处理相比,1 MIC条件下两种食源性致病菌的生长对数期均相对滞后,而2 MIC组OD600nm的增长速率与1 MIC组OD600nm相比趋势明显降低,说明在2 MIC下,红豆皮多酚提取物对供试菌的生长能力有更强的抑制作用。阳性对照组完全抑制了菌体生长,2 MIC组与其抑制效果接近。
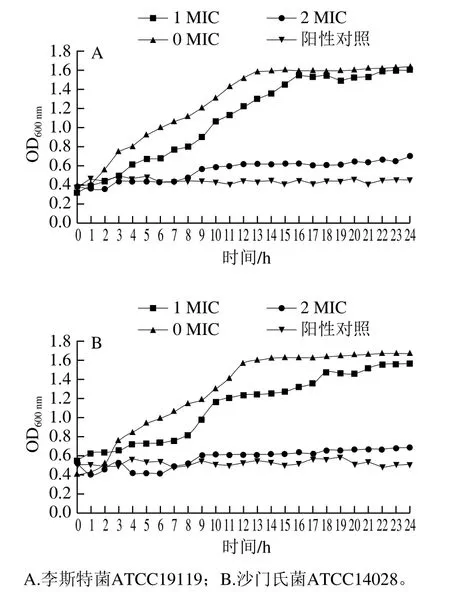
图1 红豆皮多酚提取物对李斯特菌ATCC19119 和沙门氏菌ATCC14028生长曲线的影响Fig. 1 Effects of adzuki bean seed coat polyphenols on the growth curves of Listeria ATCC19119 and Salmonella ATCC14028
2.4 红豆皮多酚提取物对食源性致病菌细胞膜完整性的影响
抑菌物质在破坏菌体细胞膜完整性的过程中,还增加了菌体细胞膜的渗透性,导致细胞内容物流失[16]。Chen Lin等[32]发现,细胞膜受损的李斯特菌能引起细胞内组分大量流失。从图2可以看出,在不同质量浓度红豆皮多酚提取物的作用下,李斯特菌ATCC19119和沙门氏菌ATCC14028细菌上清液中的蛋白质和核酸水平随时间延长逐渐提升。结果表明,在不同质量浓度的红豆皮多酚提取物作用下,李斯特菌ATCC19119和沙门氏菌ATCC14028的细胞壁膜通透性增加,细胞内蛋白质和核酸存在不同程度的泄漏,且添加高质量浓度红豆皮多酚提取物组的细菌核酸和蛋白质泄漏程度更剧烈。
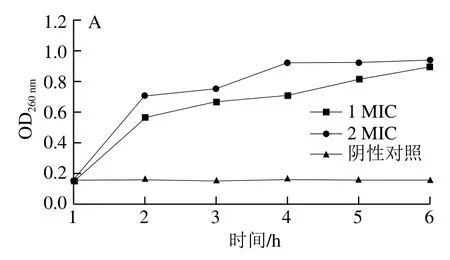
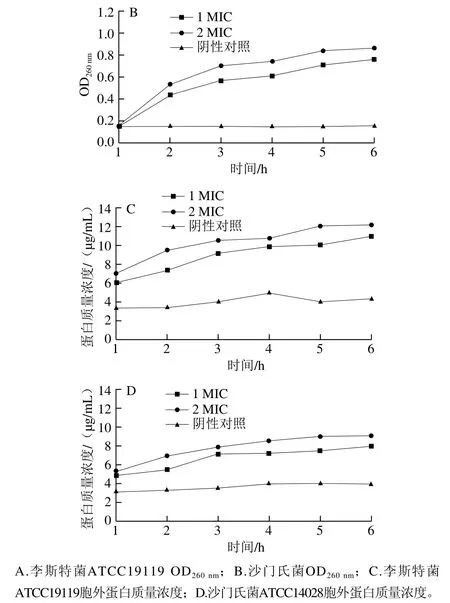
图2 红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028胞外蛋白质和核酸水平的影响Fig. 2 Effects of adzuki bean seed coat polyphenols on extracellular protein and nucleic acid contents of Listeria ATCC19119 and Salmonella ATCC14028
2.5 红豆皮多酚提取物对食源性致病菌细胞膜电位的影响
静息膜电位是反映细胞存活情况最重要的参数之一。DiBAC4(3)是一种测定膜极化变化的荧光膜电位染料,其本身无荧光,当进入细胞与细胞质中的蛋白结合后才发出荧光,荧光强度增加,即膜电位增加,表明细胞发生去极化[33-34]。图3为不同质量浓度的红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028的细胞膜电位的影响。经1 MIC和2 MIC红豆皮多酚提取物处理后,李斯特菌ATCC19119的相对荧光强度与对照组相比分别增加了3.76 倍和6.91 倍,沙门氏菌ATCC1402的相对荧光强度与对照组相比分别增加了3.58 倍和5.59 倍,即细胞发生去极化。
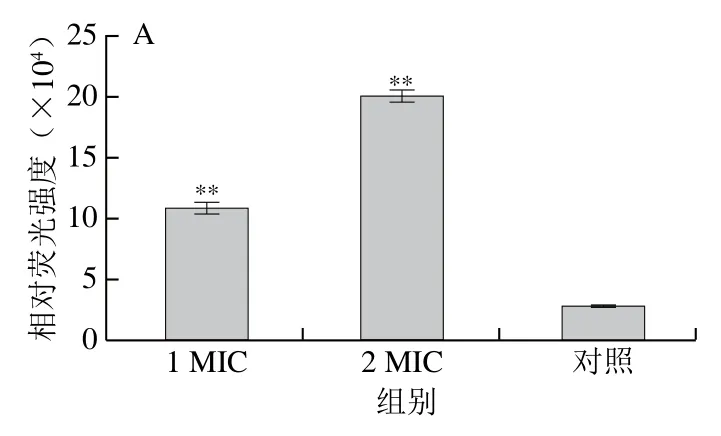
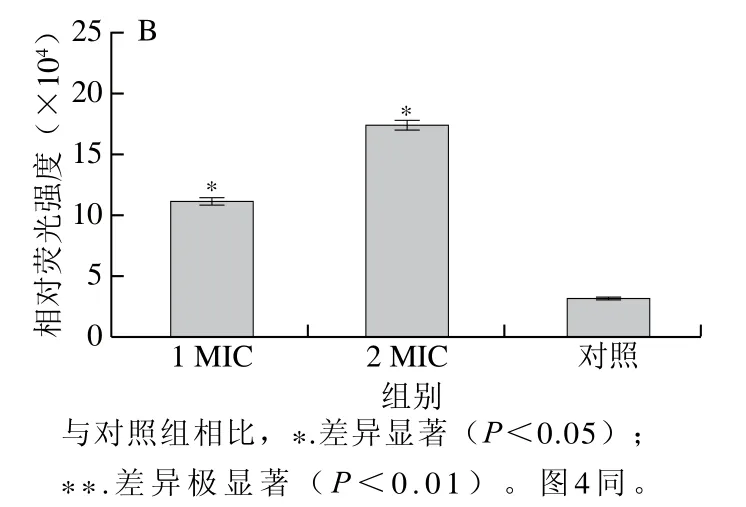
图3 红豆皮多酚提取物对李斯特菌 ATCC19119(A) 和沙门氏菌ATCC14028(B)细胞膜电位的影响Fig. 3 Effects of adzuki bean seed coat polyphenols on membrane potential in Listeria ATCC19119 and Salmonella ATCC14028
2.6 红豆皮多酚提取物对食源性致病菌细胞内ATP含量的影响
当细胞受损或死亡时,菌体细胞中的ATP含量会迅速下降,故ATP含量可以反映细胞的存活状态[20]。ATP含量的降低可能是细胞质ATP释放量增加和质子泵ATP酶的水解速率上升所致[35]。在正常条件下,菌体细胞中ATP的含量相对稳定。经抑菌剂处理后,菌体细胞膜受损,导致细胞膜变得不稳定,细胞内ATP合成速率降低,细胞内ATP水平降低。图4为红豆皮多酚提取物分别对李斯特菌ATCC19119和沙门氏菌ATCC14028细胞内ATP含量的影响。与对照组相比,经1 MIC和2 MIC红豆皮多酚提取物处理的李斯特菌ATCC19119细胞内ATP的相对发光值分别降低了74.68%、89.88%;经1 MIC和2 MIC红豆皮多酚提取物处理的沙门氏菌ATCC14028细胞内ATP的相对发光值分别降低了69.56%、87.12%。与对照组相比,红豆皮多酚提取物处理后菌体细胞中的ATP含量显著降低(P<0.05,P<0.01),并且随着提取物质量浓度的增加,菌体细胞中的ATP含量降低更明显,说明红豆皮多酚能够影响菌体的生命活动,促进或导致菌体死亡。
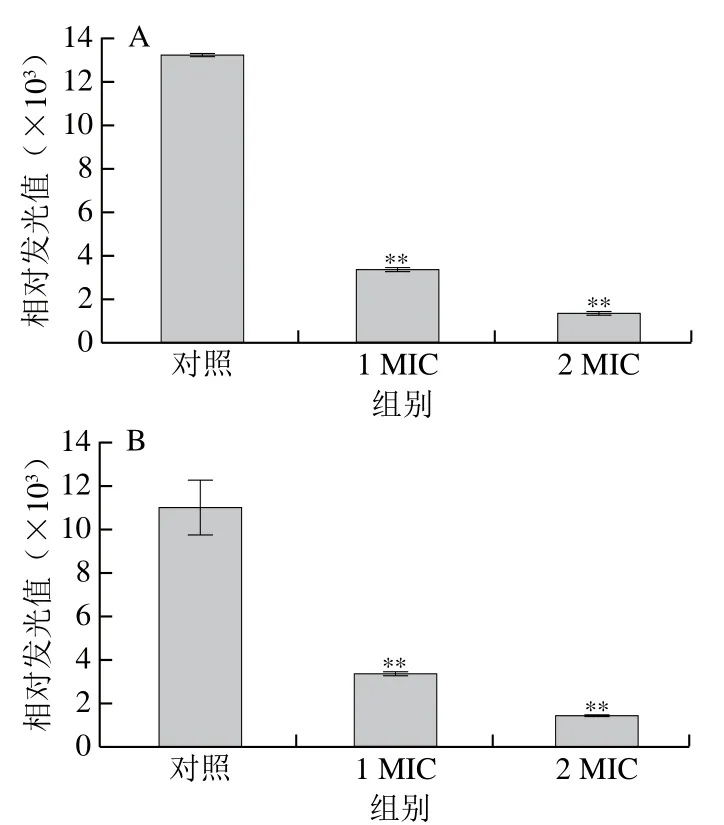
图4 红豆皮多酚提取物对李斯特菌ATCC19119(A)和沙门氏菌ATCC14028(B)胞内ATP含量的影响Fig. 4 Effects of adzuki bean seed coat polyphenols on intracellular ATP contents of Listeria ATCC19119 (A) and Salmonella ATCC14028 (B)
2.7 红豆皮多酚提取物对食源性致病菌菌体碱性磷酸酶活力的影响
碱性磷酸酶存在于细菌的细胞膜和细胞壁之间,因此未经处理的菌悬液中应无碱性磷酸酶活性。因此,可通过检测细菌悬液中碱性磷酸酶的泄漏情况来反映细胞壁的通透性[36-37]。如图5所示,与对照相比,经红豆皮多酚提取物处理后李斯特菌ATCC19119和沙门氏菌ATCC14028细胞碱性磷酸酶活力明显增加,且碱性磷酸酶活力随处理时间的延长或者红豆皮多酚提取物质量浓度的增加而升高,表明红豆皮多酚提取物会导致细胞壁通透性增加,破坏菌体细胞壁完整性。
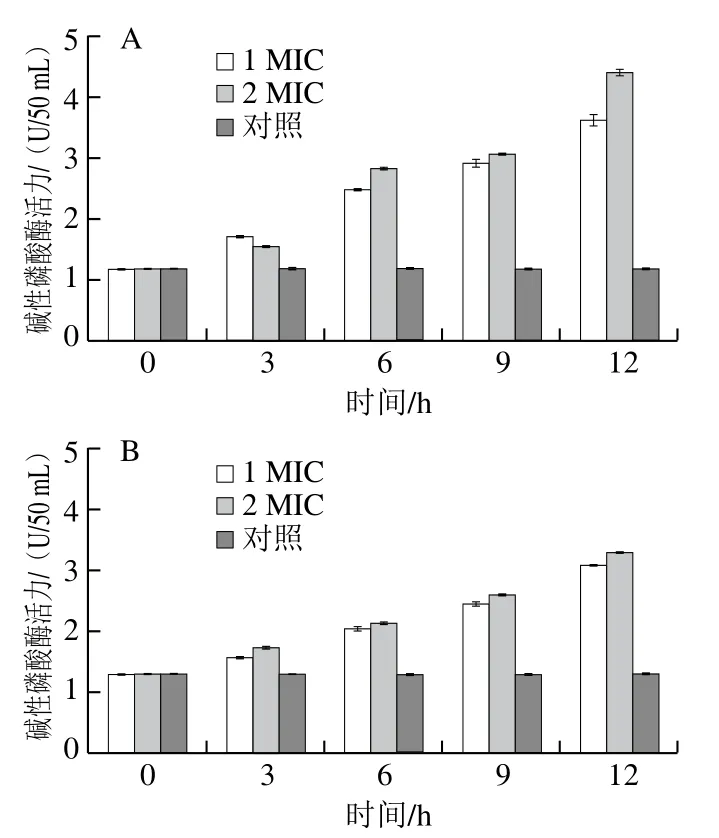
图5 红豆皮多酚提取物对李斯特菌ATCC19119(A)和沙门氏菌ATCC14028(B)碱性磷酸酶活力的影响Fig. 5 Effects of adzuki bean seed coat polyphenols on alkaline phosphatase activity of Listeria ATCC19119 (A) and Salmonella ATCC14028 (B)
2.8 红豆皮多酚提取物对食源性致病菌菌体形态的影响
用扫描电子显微镜观察红豆皮多酚处理后李斯特菌ATCC19119和沙门氏菌ATCC14028细胞的细胞膜完整性和形态变化。如图6、7所示,未经处理的李斯特菌和沙门氏菌菌体细胞分别呈椭球状和短杆状,表面相对完整,没有明显的皱纹和裂纹。而经红豆皮多酚提取物处理的菌体细胞受到严重破坏,在菌体细胞表面上能够观察到明显的褶皱和凹陷,且细胞发生黏附和聚集。这些结果表明红豆皮多酚能够破坏两种菌体细胞的细胞膜,导致菌体的死亡和瓦解。
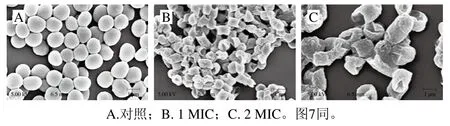
图6 红豆皮多酚提取物对李斯特菌ATCC19119形态的影响Fig. 6 Effects of adzuki bean seed coat polyphenols on cell morphology of Listeria ATCC19119

图7 红豆皮多酚提取物对沙门氏菌ATCC14028形态的影响Fig. 7 Effects of adzuki bean seed coat polyphenols on cell morphology of Salmonella ATCC14028
2.9 SDS-PAGE分析结果
菌体细胞膜蛋白在维持细胞膜通透性方面起着重要作用。细胞膜蛋白的损伤可能导致菌体细胞膜中酶系统完整性的破坏。Nakayama等[38]发现表没食子酸阻断了大肠杆菌细胞外膜蛋白的孔通道,抑制外膜的被动转运,从而抑制大肠杆菌的生长。如图8所示,经1 MIC红豆皮多酚提取物处理的李斯特菌ATCC19119和沙门氏菌ATCC14028菌株的蛋白条带灰度与阴性对照组相比降低,李斯特菌ATCC19119中48~135 kDa蛋白条带灰度明显降低,沙门氏菌ATCC14028中25~35 kDa和48~100 kDa蛋白条带灰度明显降低,且李斯特菌ATCC19119和沙门氏菌ATCC14028菌株的蛋白含量与红豆皮多酚提取物处理时间呈负相关。
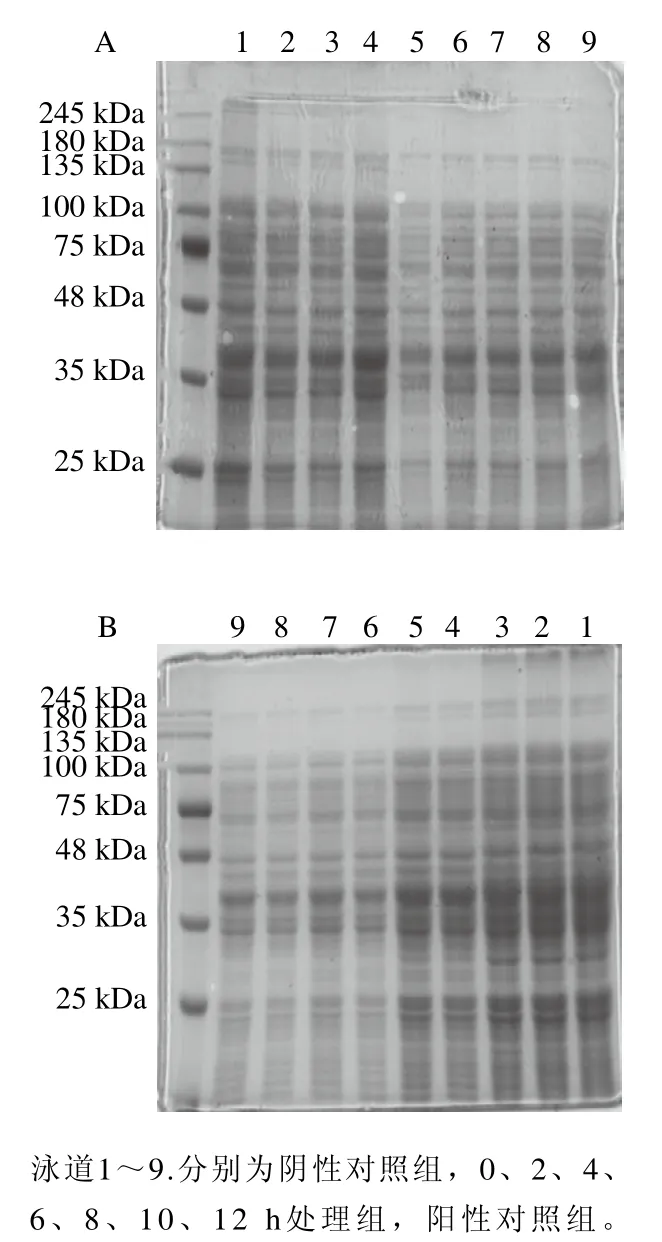
图8 红豆皮多酚提取物对李斯特菌ATCC19119(A)和沙门氏菌ATCC14028(B)蛋白组成的影响Fig. 8 Effects of adzuki bean seed coat polyphenols on the protein composition of cell membranes of Listeria ATCC19119 (A) and Salmonella ATCC14028 (B)
3 结 论
本实验通过高效液相色谱法检测出红豆皮多酚的13 种单体酚成分。红豆皮多酚提取物对李斯特菌ATCC19119和沙门氏菌ATCC14028菌体细胞具有有效的抑菌活性,其对李斯特菌ATCC19119的MIC为625 μg/mL,对沙门氏菌ATCC14028的MIC为2 500 μg/mL。此外,通过分析经红豆皮多酚提取物处理后的细菌细胞内容物蛋白质和核酸的含量变化发现,二者均明显减少,因此可以推断红豆皮多酚的作用机制是破坏细胞膜通透性,从而导致核酸和蛋白质的损失。SDS-PAGE结果也可以证明在红豆多酚的作用下细菌胞内蛋白含量减少。同时,红豆皮多酚会使细胞内ATP含量显著性降低,细菌细胞膜产生去极化现象。综上,推测红豆皮多酚的作用会导致细胞裂解和死亡,这与细胞膜通透性的增加有关。通过扫描电子显微镜观察到的菌体表面褶皱和凹陷的现象也能够支持上述假设。然而,考虑到食品的安全性,在将红豆皮多酚应用于食品生产前还需进行安全性实验,优化使用剂量并分析其对食品感官特性产生的影响。
