影响工夫红茶茶汤亮度的关键成分分析
2022-01-06吴仕敏王家勤江用文袁海波
吴仕敏,王家勤,江用文,袁海波,,李 佳,
(1.中国农业科学院茶叶研究所,浙江省茶叶加工工程重点实验室,浙江 杭州 310008;2.中国农业科学院研究生院,北京 100081)
工夫红茶是我国的传统红茶。红茶汤色是茶叶内在品质的外在表征,是红茶“红汤”的精髓所在。对汤色(包括亮度、色度)的评定是茶叶感官审评的重要环节之一,其权重系数达10%[1]。“红亮”汤色是高品质红茶的关键特征之一。相比暗沉茶汤,高亮工夫红茶茶汤更受消费者青睐。因此,研究影响工夫红茶茶汤亮度的关键成分具有重要意义。
红茶在发酵的过程中,经过多酚氧化物酶和过氧化物酶介导的内质成分的氧化、降解[2],形成其独特的滋味和汤色。现有研究表明,与茶汤汤色特征密切相关的化合物主要为茶色素类。茶黄素类(theaflavins,TFs)与红茶茶汤“亮”显著相关,茶红素类(thearubigins,TRs)是茶汤“红”的主要成因。Obanda[3]和Panigrahi[4]等以红碎茶为研究对象,发现TRs II(中相对分子质量的TR)与茶褐素(theabrownine,TBs)与茶汤亮度有负相关性。TBs与茶汤汤色品质呈负相关性[2,5-7],茶汤中TBs含量上升则汤色变暗,不利于获得明亮的红茶汤色[8]。吴昊玥等[9]研究发现TR/TF比值与茶汤汤色有关,TR/TF在一定范围内,才能获得红艳明亮的红茶茶汤。此外,还有研究发现,没食子酸(gallic acid,GA)、咖啡碱(caffeine,CAF)、黄酮类以及儿茶素对汤色也存在直接或间接的影响,如GA、茶多酚与CAF结合形成茶乳酪[10-11],进而影响绿茶茶汤汤色;而儿茶素影响TFs与TBs的形成,也会与黄酮类化合物产生相互作用[12-13],进而对后续红茶汤色形成产生影响。然而,以往大部分研究主要围绕茶汤的色度,而专门针对茶汤亮度的研究较少。目前,对于工夫红茶茶汤中亮度相关化合物的相关研究鲜有报道,影响红茶茶汤亮度的关键物质有待进一步明确。
基于此,本实验以茶汤亮度的专家感官审评为依据,对3 类不同亮度(高亮、中亮、暗)的工夫红茶茶汤组分进行定量分析,对不同截留分子质量(molecular mass cut-off,MMCO)茶汤馏分进行分离,并结合统计分析手段和添加验证实验,探索影响工夫红茶茶汤亮度的关键成分,以期为后续高亮工夫红茶的品质调控和定向加工提供理论依据。
1 材料与方法
1.1 材料与试剂
26 个工夫红茶茶样均是商品茶,均采购于福建地区。
草酸、碳酸氢钠、乙酸乙酯(均为分析纯)上海麦克林生化科技有限公司;甲酸(色谱纯)、冰乙酸(色谱纯)、乙醇(95%,分析纯)、正丁醇(分析纯)、乙酸乙酯(优级纯) 上海阿拉丁生化科技有限公司;乙腈(色谱纯) 德国默克公司。
化学标准品:GA、没食子儿茶素(gallocatechin,GC)、表没食子儿茶素(epigallocatechin,EGC)、儿茶素(catechin,C)、咖啡碱(caffeine,CAF)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素(epicatechin,EC)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、儿茶素没食子酸(catechin gallate,CG)、茶黄素(theaflavin,TF)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)、茶黄素-3’-没食子酸酯(theaflavin-3’-gallate,TF-3’-G)、茶黄素-3,3’-没食子酸酯(theaflavin-3,3’-digallate,TF-D-G)等标准品 上海金穗科技有限公司;牡荆素葡萄糖苷(vitexin-glucoside,Vit-glu)、杨梅素-3-O-半乳糖苷(myricetin-3-O-galactoside,Myr-gal)、牡荆素鼠李糖苷(vitexin-rhamnoside,Vit-rha)、芦丁(quercetin-3-O-[rhamnopyranosyl-glucopyranoside],Rutin)、槲皮素-3-O-葡萄糖苷(quercetin 3-O-glucoside,Que-glu)、山柰酚-3-O-芸香糖苷(kaempferol-3-O-rutinoside,Kaerut)、山柰酚-3-O-葡萄糖苷(kaempferol-3-O-glucoside,Kea-glu)标准品 上海源叶生物科技有限公司;超滤管(Amicon®Ultra-15购于美国Millipore公司),包括4种不同的MMCO,如表1所示。

表1 超滤管不同型号以及不同MMCOTable 1 Ultrafiltration membranes with different MMCOs used in this study
1.2 仪器与设备
LC-20A高效液相色谱仪 日本岛津公司;UV-3200型紫外-可见近红外分光光度计 上海美谱达仪器有限公司;CM-5色差计 中国柯尼卡美能达公司;Milli-Q纯水仪 美国Millipore公司。
1.3 方法
1.3.1 样品前处理
采用GB/T 23776—2018《茶叶感官审评方法》[1]方法冲泡:取500~1 000 g茶样置于评茶盘中,把盘使茶样混合均匀,取代表性茶样(3.00±0.01)g倒在审评杯中,沸水注满(150 mL),加盖,5 min后将审评杯中茶汤倒入审评碗中。然后过0.45 mm水系膜进行液相色谱测定。每个茶样重复3 次。
1.3.2 茶汤亮度感官审评
茶汤按照1.3.1节方法进行。感官审评专家小组由5 位审评人员组成,均具备高级评茶员及以上资质。由审评人员选择3 个亮度差异较为明显的茶样进行打分,定义为3、6、9 分,随后由感官审评小组人员以此为依据对其他茶汤亮度进行打分(赋分范围为0~10,分值越大,表示茶汤越亮)。
1.3.3 色差分析数据采集
按照1.3.1节准备茶汤,每个茶样平行冲泡3 次。按照王家勤等[14]的色差分析方法采集13 个色差分析指标:L*、a*、b*、C*、H*、L99、a99、b99、C99、H99、L、a、b。L为明度,a表示红(+)绿(-)度、b表示黄(+)蓝(-)度,C代表彩度[15],H为色调角[16],其表达式分别为
1.3.4 茶汤组分含量测定
1.3.4.1 儿茶素、CAF、GA
使用LC-20A高效液相色谱仪测定。色谱柱Waters-C18柱(4.6 mm×250 mm,5 μm)。流动相:A为2%乙酸,B为纯乙腈;进样量10 μL;流速1 mL/min;检测波长280 nm,柱温35 ℃;洗脱过程:0 min,93.5% A、6.5% B;16 min,85% A、15% B;25 min,75% A、25% B;25.5~30 min,93.5% A、6.5% B。采用外标法进行化合物的定量测定。
1.3.4.2 TFs
使用LC-20A高效液相色谱仪测定。色谱柱Waters-C18柱(4.6 mm×250 mm,5 μm)。流动相:A为2%乙酸,B为纯乙腈;进样量10 μL;检测波长380 nm;柱温35 ℃;洗脱过程:0 min,80% A、20% B;35~38 min,75% A、25% B;40 min,80% A、20% B。采用外标法进行定量。
1.3.4.3 黄酮苷
使用LC-20A高效液相色谱仪测定。色谱柱Waters-C18柱(4.6 mm×250 mm,5 μm)。流动相:A为0.15%甲酸溶液,B为纯乙腈;进样量20 μL;流速1 mL/min;检测波长360 nm;柱温35 ℃;洗脱过程:0 min,94% A、6% B;2 min,83% A、17% B;22 min,81% A、19% B;23 min,70% A、30% B;26~30 min,94% A、6% B。采用外标法进行化合物的定量测定。
1.3.4.4 TFs、TRs、TBs
采用系统分析法[17],进行茶色素的分析。取3.0 g茶样浸提后获得试液。取30 mL试液于漏斗中,加入30 mL乙酸乙酯,振荡后,放出水层(D液),倒出乙酸乙酯层(A液);取A液15 mL于漏斗中,加入15 mL饱和草酸溶液,振荡后,弃去下层液,倒出上层溶液(C液);取15 mL试液于漏斗中,加入15 mL正丁醇,振荡后,倒出上层溶液(B液)。采用紫外-可见近红外分光光度计,分别测定A、B、C、D液的吸光度AA、AB、AC、AD,计算TFs、TRs、TBs。

1.3.5 不同分子质量范围茶汤馏分的超滤分离
馏分分离实验参考赵书青[18]的膜技术分离实验。超滤膜可以根据不同分子质量的物质,而有不同的截留率,MMCO一般是被截留90%物质的分子质量[18]。在本实验中,其分离过程如图1所示。用1.3.1节冲泡方法获得茶汤,取15 mL茶汤加入到100K超滤管中,4 000×g离心10 min,获得MMCO>100 kDa的浓缩液和MMCO<100 kDa的滤过液;将MMCO<100 kDa的滤过液移至50 kDa超滤管中,离心获得50 kDa<MMCO<100 kDa的浓缩液和MMCO<50 kDa的滤过液;依次操作,获得不同MMCO下的过滤液,并进行色差分析。
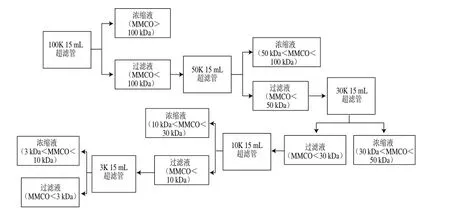
图1 茶汤不同MMCO馏分分离流程图Fig.1 Flow chart of the ultrafiltration of tea infusions
1.3.6 MMCO>100 kDa馏分对红茶茶汤亮度影响的验证
验证实验分为复原实验与添加实验。复原实验:选定13#暗茶汤作为获得大分子馏分的标准茶汤,经过100K超滤管分馏后的过滤液作为复原实验的参比溶液。随后将100 kDa超滤浓缩液按照20%、40%、50%、60%、80%、100%添加到参比溶液中,测定其色差参数。添加实验:首先将13#暗茶汤的100K超滤浓缩进行冷冻干燥获得干物质,计算干物质在原茶汤中的绝对质量浓度:

式中:m为冷冻干燥后获得的干物质质量;V为超滤前茶汤的总体积。
选定3#高亮茶汤作为背景茶汤,添加不同质量的干物质,分别对应添加质量浓度C0的10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,溶解到体积为15 mL的背景茶汤中,测定其色差参数。参考本课题组已经建立的红茶茶汤亮度回归预测方程[14]:Lpre=-46.028+0.519L99+0.117C*(Lpre为根据线性拟合方程预测所得的茶汤亮度分值),基于色差参数计算复原与添加实验的预测亮度分值。
1.4 数据分析
采用SIMCA-P 13.0软件(Umetrics,瑞典)进行主成分分析(principal components analysis,PCA)、偏最小二乘法判别分析(partial least squares-discrimination analysis,PLS-DA);采用SPSS 22(IBM,美国)进行单因素方差分析(one-way analysis of variance,ANOVA)、最小显著差异(least significant difference,LSD)多重检验、Pearson相关性分析;采用MeV 4.9.0软件(Oracle,美国)进行层聚类分析。
2 结果与分析
2.1 不同红茶的亮度感官品质
根据亮度感官审评结果,以审评打分为依据,将1#~26#共26 个茶样分为“高亮”(感官审评亮度分值>7.5)、“中亮”(6.5≤感官审评亮度分值≤7.5)、“暗”(感官审评亮度分值<6.5)3 组,见表2。

表2 3 组(暗、中亮、高亮)工夫红茶感官审评结果及分类Table 2 Sensory evaluation and classification of Congou black tea infusions with different brightness levels
2.2 影响红茶茶汤亮度的潜在成分
为快速分析不同亮度茶汤(高亮、中亮、暗)中化合物含量的差异,首先以不同化合物的含量为X变量,3 类不同亮度分组为Y变量,经正交信号校正后,进行PLS-DA(图2A)。PLS-DA得分图上3 组茶汤间存在明显的分离趋势(R2X= 0.350 4,R2Y=0.724,Q2=0.391)。对模型Y变量进行交叉验证(20 次的置换检验)(图2B),截距分别为R2=(0.0, 0.37),Q2=(0.0,-0.318),表明模型未过拟合。为进一步探索不同化合物含量与3 组不同亮度茶汤之间的关系,对PLS-DA进行载荷分析(图2C)。从图2可以看出,对高亮茶汤影响较大的化合物为TF-3-G、TF-3’-G、TF-D-G、CAF等,而对暗茶汤影响较大的化合物为GC、TBs。TFs对茶汤亮度的影响与现有研究结果一致[19-22]。

图2 PLS-DA得分图(A)、20 次置换检验图(B)和因子载荷图(C)Fig.2 Score scatter plot of PLS-DA model (A), cross-validation of PLS-DA model by 20 permutations (B) and loading plot of PLS-DA model (C)
将茶汤中24 个组分(8 个儿茶素组分、CAF组分、GA、7 个黄酮苷组分、4 个TFs组分、总TFs、TRs、总TBs)在3 组不同亮度茶汤中含量进行单因素方差分析(ANOVA、LSD多重检验),筛选显著差异性化合物。结果见表3,共筛选出4 个差异成分,分别为GC、GCG、TF-3-G、CAF。上述4 个差异性化合物在3 组不同亮度茶汤中的含量分布见图3,GC、GCG、TF-3-G、CAF在暗与高亮茶汤间存在显著差异。而暗与中亮仅GCG存在显著差异。TF-3-G、GCG、CAF在高亮茶汤中含量显著增高,分别是暗茶汤的1.6、2.2、1.2 倍。而GC在暗茶汤中含量显著增高,是高亮茶汤的1.8 倍。此外,本研究还发现,TF-3-G/GA在暗与高亮茶汤间存在显著差异,高亮茶汤中TF-3-G/GA显著增高,是暗茶汤的2 倍。TF-D-G/GA在暗与高亮茶汤间存在极显著差异。高亮茶汤中TF-D-G/GA显著增高,是暗茶汤的1.9 倍。CAF/GA在暗与高亮茶汤间存在显著差异,高亮茶汤中CAF/GA显著增高,是暗茶汤的1.6 倍。TF-3-G影响茶汤亮度[11,23],TF-3-G含量越高,茶汤亮度越好。以往研究发现简单儿茶素与GC的比值越高,则TFs/TRs比值越高[5,24],即GC含量越低,TFs含量越高,茶汤越明亮,本研究结果与该趋势一致。CAF一般被认为与茶汤沉淀产生有关,但是在其质量浓度较小时,其沉淀形成的浊度较小[25-26]。在本研究中所用的茶汤均没有冷后浑现象,因此可能是由于过量CAF对茶汤亮度有不利影响,而适量的CAF对亮度有积极作用。

图3 工夫红茶高亮、中亮、暗组间差异化合物的含量散点图Fig.3 Scatter plots of differential compounds between Congou black tea infusions with different brightness levels

表3 3 组(暗、中亮、高亮)工夫红茶茶汤成分定量分析和单因素方差分析结果Table 3 Comparison of chemical components in Congou black tea infusions with different brightness levels by quantitative analysis and one-way ANOVA

续表3
其他有一些化合物含量虽然没有显著差异,但是在暗、中亮、高亮茶汤中有明显的变化趋势。EC、TF、TF-3’-G、TF-D-G在暗、中亮、高亮茶汤中的含量逐步增高,GA、CG、Vit-glu、Que-glu、Kae-rut、TRs、TBs在暗、中亮、高亮茶汤中的含量逐步降低。
为进一步研究茶汤中化合物与汤色的潜在关联,系统测定本研究中所用茶汤的13 个色差参数(L*、a*、b*、C*、h*、L99、a99、b99、C99、h99、L、a、b)。将24 个组分与色差参数、茶汤亮度分值进行相关性分析,利用热图表示相关性大小(图4)。红色、绿色分别代表正相关、负相关。从图4可以看出,根据相关性分为4 个聚类,分别为化合物C、CAF、TF、TF-3-G、Vit-glu、EGC、Myr-gal、EGCG、ECG、GCG、Rutin与a相关参数负相关的聚类I(左上绿色区域),与h、L相关参数正相关的聚类II(右上红色区域),化合物TRs、Que-glu、Kae-rut、GA、CG、Kae-glu、EC、TF-3’-G、TF-D-G、TFs、GC、Vit-rha、TBs与a、b、C相关参数正相关的聚类III(左下红色区域),与h、L相关参数负相关的聚类IV(右下绿色区域)。可见,大部分化合物与色度参数a、b密切相关。CAF与亮度分值显著正相关,此外正相关的化合物还包括EC、TF、TF-3-G、TF-3’-G、TFD-G、GCG等,但P>0.05。Vit-rha与亮度分值显著负相关。值得注意的是,虽然黄酮苷类在3 组不同亮度茶汤中含量差异不显著,但与色差参数密切相关,即与汤色色度相关。有关研究表明,杨梅素苷的分解可能会对茶汤的色泽产生较大影响[27]。也有研究发现杨梅素与EGCG同时存在时,杨梅素可以促使茶汤红变[13]。
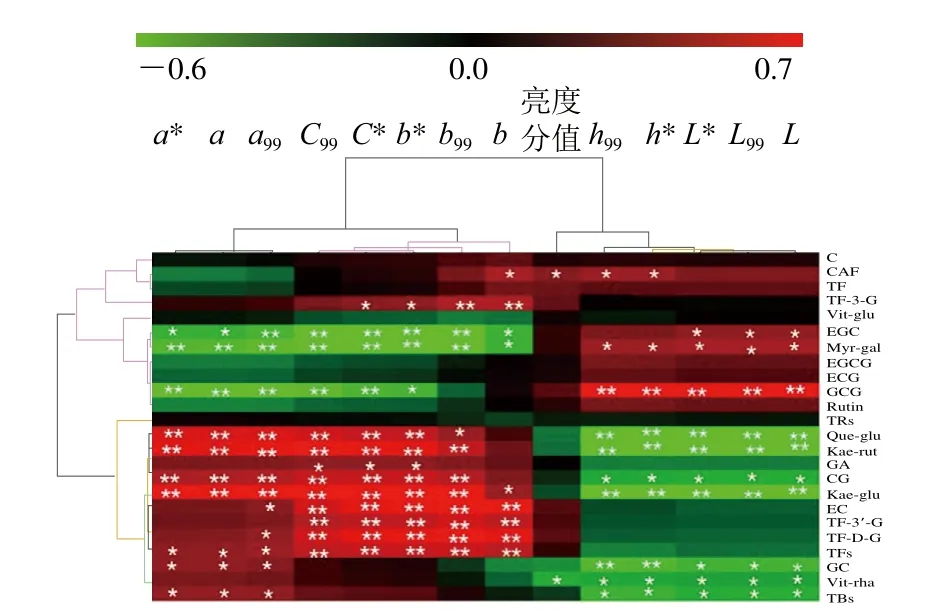
图4 色差参数、亮度分值与化合物间相关性的热图聚类分析(Pearson相关)Fig.4 Heatmap of Pearson correlations between color difference parameters, brightness scores and chemical compounds
2.3 不同MMCO馏分对茶汤亮度的影响
2.2节的分析检测主要集中于茶汤中小分子组分,未涉及复杂大分子组分。为深入了解不同分子质量大小的馏分物质(特别是大分子馏分)对茶汤亮度的影响,任取两个暗的茶汤13#和10#,采用超滤法进行不同馏分的分离,用图1的方法获得MMCO>100 kDa、50 kDa<MMCO<100 kDa、30 kDa<MMCO<50 kDa、10 kDa<MMCO<30 kDa的浓缩液和相应MMCO<100 kDa、MMCO<50 kDa、MMCO<30 kDa、MMCO<10 kDa的过滤液。从图5A可以看出,13#(亮度分值为3.7 分,暗茶汤)、10#(亮度分值为5.5 分,暗茶汤)在经过100K超滤管超滤后,原茶汤(5A图左侧)与除去MMCO>100 kDa馏分后的下层过滤液(5A图右侧超滤管)之间差异较大。如图5B所示(上部样品为经过超滤管浓缩后的浓缩液,下部为过滤液),100 kDa过滤液分别经过后续50K、30K、10K超滤管超滤后,得到的过滤液在感官上差异不大。
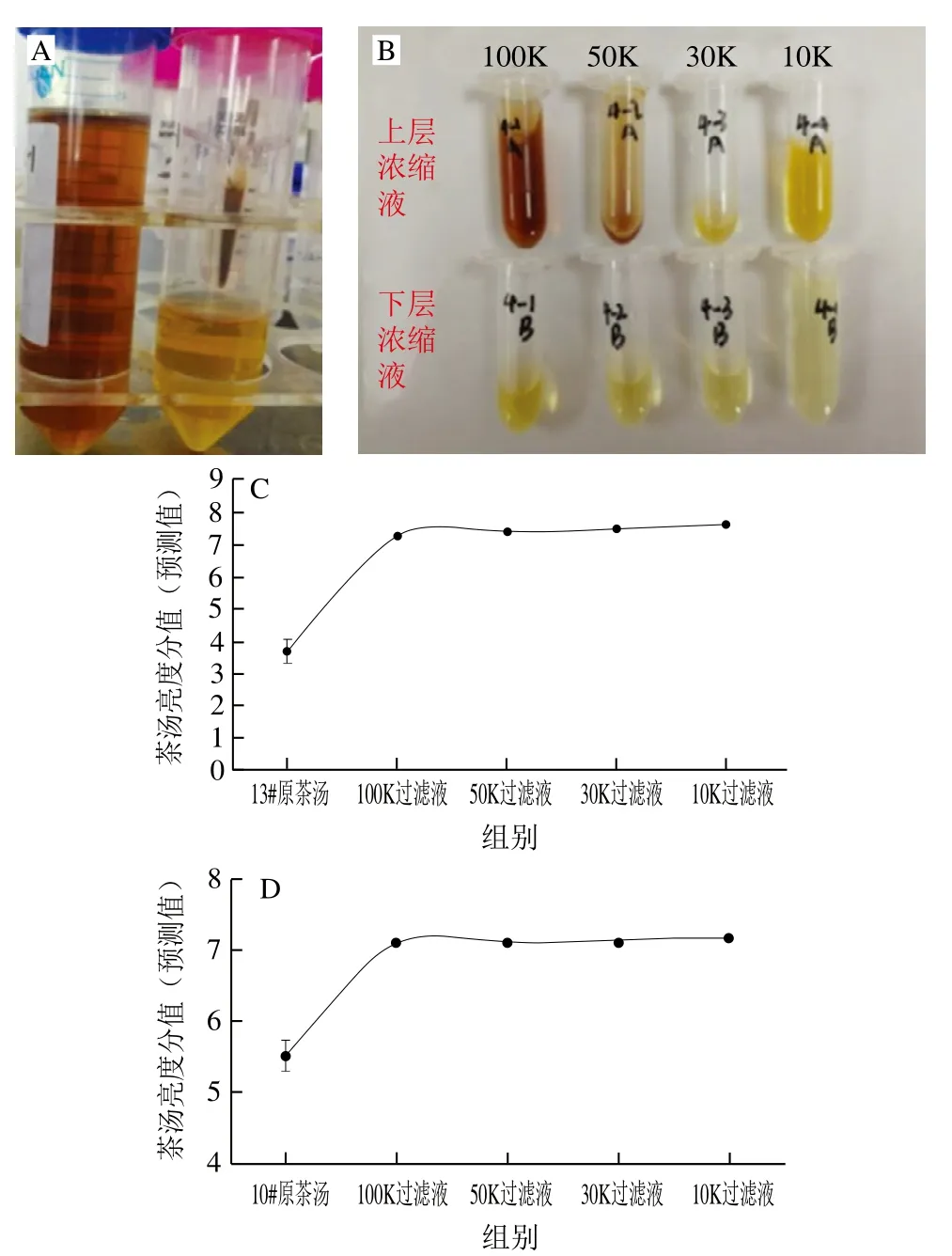
图5 不同馏分亮度分值变化情况Fig.5 Changes in brightness values of different fractions
随后按照1.3.3节的色差分析方法测定原茶汤与100K、50K、30K、10K超滤管后的下层过滤液的色差参数,根据已经建立的亮度预测模型[14]计算其亮度预测得分值。从图5C、D可以直观地看出,13#、10#暗茶汤在经过100K超滤管超滤后,下层过滤液亮度发生明显的提高,13#茶汤亮度分值由3.7 分变为7.3 分,10#茶汤亮度由5.5 分上升为7.1 分,50K、30K、10K超滤管的下层过滤液亮度分值与100K超滤管过滤液差异不显著。
为进一步验证MMCO>100 kDa馏分对茶汤亮度的影响,将100 kDa超滤膜分离浓缩后得到的浓缩液进行反向添加实验。
1)暗茶汤复原验证:按照1.3.6节将MMCO>100 kDa馏分添加至经过100 kDa超滤后的过滤液中(MMCO<100 kDa),进行茶汤的复原。结果:茶汤在20%V0、40%V0、50%V0、60%V0、80%V0、100%V0的添加复原过程中,茶汤的亮度预测分值不断降低。100%复原时的茶汤亮度分值为4.3,略高于原来茶汤亮度,可能是因为在超滤时的损失所致,如图6A所示。
2)亮茶汤添加验证:按照1.3.6节把13#暗茶汤经超滤获得的MMCO>100 kDa馏分冷冻干燥的物质,按照不同质量浓度等级添加至3#亮茶汤中。随着添加量增加,背景茶汤亮度分值由8.4逐渐下降。在添加MMCO>100 kDa馏分达到100%C0时,所得亮度分值为3.1,低于原暗茶汤的亮度,可能是因为亮茶汤中原来就含有一部分的MMCO>100 kDa馏分,如图6B所示。

图6 暗茶汤复原实验验证不同浓度馏分复原茶汤(A)和亮茶汤添加验证不同浓度馏分添加茶汤(B)亮度分值变化Fig.6 Changes in brightness value in reconstitution (A) and addition (B) experiments
上述结果表明,MMCO>100 kDa馏分显著影响茶汤亮度。相关研究表明,TBs是一类水溶性非透析性高聚合的褐色物质,相对分子质量变化范围较大。不同原料获得的TBs的分子质量大小有较大差异[28],在小于3 kDa和大于100 kDa范围内都检测到TBs的组分特征[28-30]。其结构复杂,主要组分有多糖、蛋白质、核酸和多酚类物质[2,26-27]。张钦等[31]研究发现大于100 kDa组分的物质组成主要是多酚类、羧基、酚羟基、多糖以及酸性基团。本研究定量分析结果显示,茶褐色组分在3 类不同亮度茶汤中无显著差异(表3),因此,推测MMCO>100 kDa馏分可能是由TBs与其他MMCO>100 kDa组分(如水溶性茶多糖等)共同构成。汪东风等[32]研究发现,分子质量大于107 kDa的茶多糖在100 ℃时呈现出深褐色。尹军峰等[33]利用膜法富集茶多糖的初步研究发现,MMCO大于100 kDa的多糖质量分数为5.12%。
3 结 论
本研究围绕工夫红茶的“高亮”汤色特征开展研究,以感官审评为依据,对3 组不同亮度(高亮、中亮、暗)工夫红茶的茶汤组分进行定量分析。结合多变量分析和单因素方差分析,筛选出4 个小分子差异组分,其中TF-3-G、GCG、CAF在高亮茶汤中显著增高,GC在高亮茶汤中显著降低。经过超滤分离和复原添加验证实验,发现MMCO>100 kDa大分子馏分不利于高亮茶汤的形成。综上所述,本实验筛选出了影响工夫红茶茶汤亮度的潜在影响成分有TF-3-G、GCG、CAF、GC,以及MMCO>100 kDa的馏分。对后续高亮工夫红茶的品质调控和定向加工具有重要的理论指导意义。然而,由于茶汤中化合物众多且存在复杂的互作效应,除了本研究中涉及的儿茶素及其聚合物、黄酮苷类、大分子馏分等物质,其他茶汤组分(如可溶性糖、氨基酸等)对茶汤汤色亮度的影响,以及高亮茶汤重组的实现,仍需进一步研究。
