果胶对真空冷冻干燥重组苹果块质构和吸湿特性的影响
2022-01-06杜茜茜易建勇毕金峰马有川赵圆圆
杜茜茜,易建勇,毕金峰,马有川,赵圆圆
(中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193)
我国是世界苹果种植、生产和消费大国,2018年产量达3 923.34万 t,占世界苹果总产量的45.55%[1]。干制加工可显著降低原料的水分含量和微生物活性,减少贮藏过程中的物理化学变化,延长商品的货架期,是苹果的重要加工方式[2-3]。果蔬脆片因其口感酥脆、方便即食、营养健康、便于携带等特点深受消费者青睐,其占苹果加工制品的市场份额逐年稳步提高。
目前,用于苹果脆片生产的干制技术主要包括真空冷冻干燥[3]、微波真空干燥[4]、压差闪蒸干燥[5]和真空低温油浴等[6]。其中,真空冷冻干燥技术在真空低温的条件下使湿物料中冻结的水分直接升华,干燥后形成疏松的多孔结构,较好地保持了物料原有的物理性状,营养成分保留率高,贮藏时间较长[7-9]。因此,真空冷冻干燥制品更符合现代消费者对营养健康的消费需求,在休闲食品市场上占据相当高的比例,显示出良好的市场前景和发展潜力[10]。
近年来出现了真空冷冻干燥重组果蔬食品,其工艺是将单一或多种果蔬打浆混合后冻干,形成果蔬干制品新的微观结构[11-12]。相比于天然果蔬脆片,真空冷冻干燥重组果蔬食品有如下优势:一是可将不同果蔬和食品原料按所需比例自由组合,可作为实现基于不同人群营养需求和个性化食品精准制造的有效手段[13-14];二是将不同果蔬原料破壁和匀浆后形成均匀的果浆体系,可避免天然果蔬在冻干过程中因表皮蜡质、天然组织细胞屏障等造成的升华通道阻碍,干燥速率和干燥品质显著提升[15];三是通过对果蔬原料的配比和果浆中物质成分的设计,可实现对产品微观结构和质构的精准调控[16-17]。然而,果浆状态下冷冻干燥获得的重组脆块,完整的细胞结构被破坏,重构建立的组织连接薄弱,结构疏松,导致硬度偏低,酥脆口感不佳,产品更容易吸潮,同时产品在运输过程中容易破损[10,16-17]。
果胶是自然界中结构最为复杂的多糖,主要存在于初生细胞壁中,对植物细胞组织的相互连接具有重要作用。研究表明,果胶是支撑干燥果蔬切片孔隙结构的重要物质,赋予干燥食品一定的刚度和水分吸附特性[18],但果胶物质在重组果蔬食品质构形成和水分吸附行为中的作用机制尚不明确。因此,本研究以苹果为对象,通过调高或调低苹果物料中果胶含量,探讨果胶对真空冷冻干燥重组苹果块质构和吸湿特性的影响,旨在为实现重组果蔬食品质构的精准调控提供理论依据。
1 材料与方法
1.1 材料与试剂
富士苹果(Malus domestica),购于幸福荣耀(北京)超市有限公司,选择成熟度一致、大小均一、无机械损伤和病虫害的苹果为实验原料。
果胶(苹果源) 美国Sigma公司;果胶酶(食品级,100 000 U/g)、纤维素酶(食品级,50 000 U/g)北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CL50蔬菜水果处理机 法国Robot Couple公司;MCKZ-JD6电器两用蒸饭柜 滨州市美厨厨业有限公司;HR1848飞利浦四合一榨汁机 飞利浦家庭电器有限公司;IKA RW20搅拌器 上海玖析科学仪器有限公司;ULT1386-3-V41超低温冰箱(-80 ℃) 赛默飞科技有限公司;LG-1.0真空冷冻干燥机 沈阳航天新阳速冻设备制造有限公司;TA.HD plus物性测试仪 英国Stable Micro System公司;P14F0114动态水分吸附仪 英国SMS公司;DSC 8000差示扫描量热(differential scanning calorimeter,DSC)仪 美国PE公司;SU8010电子扫描显微镜 日本日立公司;YC-80旋转混匀仪 杭州米欧仪器有限公司。
1.3 方法
1.3.1 样品制备
苹果去皮后可食用部分用蔬菜水果处理机切成2 mm厚的薄片,蒸汽热烫120 s防止褐变,用榨汁机打浆,打浆时间为30 s,间隔10 s,打浆3 次。果浆在进一步制备时分为7 个不同的处理组,5 组处理中分别加入质量分数0.1%、0.5%、1%、2%、4%的果胶,其余2 组果浆中分别加入纤维素酶和果胶酶,作为阴性对照处理组,在40 ℃恒温水浴中酶解2 h。以纯苹果浆为对照,上述果浆用搅拌器混匀后,倒入长宽高为2.5 cm×2.5 cm×1.4 cm的硅胶模具中,-80 ℃冰箱预冻24 h。
1.3.2 真空冷冻干燥
冷肼温度为-40 ℃,真空度为60 Pa,一次干燥隔板温度为25 ℃,二次干燥隔板温度为50 ℃。一次干燥样品量为560 g,物料干燥至水分质量分数低于4%,并置于干燥器中均湿48 h后进行各项指标测定。
1.3.3 半乳糖醛酸含量测定
重组样品中半乳糖醛酸含量参考Peng Jian等[18]的方法,采用分光光度法,以半乳糖醛酸作为标准物质,每个样品重复测定3 次。
1.3.4 色泽
用LensEye-NET色彩分析系统测定重组苹果块的外观颜色,获得以下色泽参数:亮度值(L*)、红度/绿度值(a*)、黄度/蓝度值(b*)、色相角(hab*)和色度(Cab*)。每个样品重复测定3 次。
1.3.5 硬度和脆度测定
参考Peng Jian等[18]的方法,采用物性测试仪测定样品硬度和脆度。选择切割探头(HDP/BSK),设置测试条件:前期测试速率2.0 mm/s,测试中速率1.0 mm/s,后期测试速率2.0 mm/s,触发力和穿透距离分别为10 g和45.0 mm。其中,果块硬度采用测试过程中的最大力表示,单位为g。脆度采用测试过程中的拉断距离表示,单位为mm。每个处理进行了12 次重复,去除最大值和最小值后取平均值。
1.3.6 相变温度测定
采用DSC仪测定高水分含量样品的结晶和熔融温度,以及真空冷冻干燥后苹果块的玻璃化转变温度[19]。称取8.0~9.0 mg冻干后的苹果块粉放入铝坩锅中,密封,一个空坩锅被用作参照。仪器扫描程序:以10 ℃/min从30 ℃冷却到-70 ℃,平衡5 min,同样的速度加热到100 ℃。采用仪器自带软件分析热流密度曲线,得到初始点、中点及终点的转变温度,取中点处的温度定义为玻璃化转变温度(Tg)。在高水分含量状态下,以同样的扫描程序测定果浆的共晶点和共熔点。每个样品测定进行3 次重复。
1.3.7 微观结构
参考Peng Jian等[20]的方法,并稍作修改。切取苹果块断面进行微观结构分析,取断面粘在样品台的导电胶上,喷金处理,样品的微观结构图像在低真空(100 Pa)和10 kV加速电压下采集,采取3 次扫描,并在60 倍下拍照,分析。
使用Image-Pro Plus 6.0分析获取的电镜图像,将相似的图像用于定量样品总孔隙率、平均孔径、最小孔径和最大孔径,以确定材料中多孔结构的分布。
1.3.8 动态水分吸附
采用Kunz等[21]的方法,并稍作修改。称量样品(20~30 mg)置于动态水分吸附仪中,放置在温度25 ℃、氮气流速0.012 cm3/h、相对湿度0%的环境干燥至恒质量。然后环境相对湿度以10%增量从0%升至90%,设置每一阶段的dm/dt值(m为样品质量,t为时间)为0.000 05/min,此时质量几乎不随时间而变化,样品达到吸湿平衡,设定自动记录样品质量时间间隔为1 min。
1.3.9 振荡破损率
使用旋转混匀仪分析样品的振荡破损率。选取5 块结构完整的重组苹果块,将其置于高143 mm、口径67 mm的直筒瓶内,直筒瓶固定在旋转面板上,仪器旋转时带动样品做反复颠倒运动。旋转混匀仪的角度设定范围为0°,转速为15 r/min,旋转时间为60 min。实验重复进行3 次,振荡结束后按下式计算样品的振荡破损率[22]:

式中:P为碎屑百分比/%;m为初始苹果块的质量/g;mt为t时刻碎屑的质量/g。
1.4 统计分析
2 结果与分析
2.1 重组苹果块的果胶含量测定
半乳糖醛酸作为果胶的主要组成单元,用其含量衡量重组样品中果胶占据的比例。如表1所示,对照组中半乳糖醛酸含量为52.40 mg/g,显著高于曹风等[23]的测定结果,这可能是由于冷冻干燥过程没有造成果胶较多的热降解。此外,随着商用果胶添加量的增加,样品中半乳糖醛酸含量随之线性增加(线性拟合方程为y=3.406 83x+3.563 55,R2=0.800 89)。纤维素酶和果胶酶处理均增加了样品中半乳糖醛酸的含量,这可能是由于酶促水解导致细胞壁多糖组分的降解,并释放出了部分被“固定”的果胶组分[24]。

表1 重组苹果块中半乳糖醛酸含量Table 1 Galacturonic acid contents in the reconstituted apple cubes
2.2 添加果胶对重组苹果块硬度和脆度的影响
由图1可知,所有样品均呈现出果蔬脆片多孔结构特有的锯齿状力学曲线特征,并且在不同样品之间呈现不规则的振动幅度,这取决于探头下压过程中对不同孔隙结构的破坏,由此可反映样品内部的空隙结构特征和硬度和脆度[25]。由表2可知,与未添加果胶样品的硬度(3 526.52 g)和脆度(32.21 mm)相比,随着果胶添加量从0.5%增加至4%,样品的硬度升高到2.01~5.41 倍,脆度增加到1.17~1.27 倍。果胶添加量为4%时样品具有最高的硬度和脆度,表现为硬度提高到5.41 倍和脆度增加到1.27 倍。一方面,果胶良好的胶黏性有利于基质交联网络结构的形成,其支链的阿拉伯糖和半乳糖与半纤维素、纤维素等刚性组分相互作用,形成的缠结在受到剪切力时不易被破坏,对维系细胞壁交联和抵抗机械压力至关重要[26]。另一方面,果胶与其他组分(蛋白质、淀粉、酚类等)的相互作用也贡献了基质抵抗外界机械压力的能力[27]。经果胶酶处理的样品硬度降低34.03%,脆度增加到1.13 倍,这是由于冻干果蔬产品的酥脆性很大程度上取决于体系的物质组成(细胞壁物质、初始含水量)和微观结构(孔隙率、孔径大小和壁厚)等[28],而添加的果胶酶和纤维素酶改变了体系中果胶和纤维素的组成结构及作用方式,降低组分对质构的贡献程度。

图1 重组苹果块的压缩力与距离曲线Fig.1 Compression force and distance curves of reconstituted apple cubes

表2 重组苹果块的质构特性和相变温度Table 2 Texture and thermodynamic properties of reconstituted apple cubes
2.3 添加果胶对物料共晶点、共融点和Tg的影响
共晶点反映物料冻结过程中从液态到固态转化的相变温度[29]。由表2和图2可知,添加0.1%~4%果胶造成样品热流曲线左移,但数值上不构成果胶对果浆样品共晶点的显著影响,表明添加少量果胶几乎不会改变物料的结晶特性,而纤维素酶和果胶酶酶解的样品,其共晶点相对于对照分别下降了2.99 ℃和2.92 ℃,这可能是由于酶解后产生单糖和低聚糖提高了样品中小分子糖的含量,进而降低了体系的结晶温度[30]。共熔点反映物料升温过程中的融化温度,添加不同量果胶或酶解处理的样品共融点与对照无显著差异。
Tg涉及到食品在“玻璃态”与“橡胶态”之间的转变,当Tg低于环境温度则不利于食品的贮藏,容易导致食品质量下降,例如氧化变质、营养物质降解、结构塌陷等[31]。由表2可知,添加果胶可显著提高样品的Tg,添加0.1%~4%的果胶可将苹果块的Tg提高4.7~20.25 ℃,在DSC热分析图(图2c)中观察到玻璃化转变台阶明显右移趋势,这与果胶作为生物大分子有关,其加入降低了基质中分子的迁移率而增加混合物的总Tg。此外,果胶还可能与食品中细胞壁多糖和酚类组分之间产生键合作用,限制其在体系中的自由移动,也会导致Tg的增加。添加果胶酶或纤维素酶后整体的Tg降低,这与Yi Jianyong等[32]在膨化干燥的火龙果片中观察到的现象一致,可能是由于细胞壁结构多糖发生解聚导致的体系流动性增加。

图2 果浆冻结温度(a)、融化温度(b)及干燥后重组苹果块Tg(c)的典型DSC热分析图Fig.2 Typical DSC thermograms showing the freezing temperature (a) and melting temperature (b) of apple puree and the glass transition temperature (c) of dry reconstituted apple cubes
2.4 微观结构及孔径分布
如图3所示,对照组样品显示出高密度、无序、不规则的组织结构(图3a方框所示),这是由于重组材料在破壁和匀浆等加工过程中完整的细胞壁被破坏,类似于消化过程对食糜颗粒的破坏和尺寸的减小[33]。在添加0.5%~4%果胶样品的扫描电子显微照片中可以观察到,重组体系形成多孔结构,孔道的方向与树状冰晶的形成方向一致。添加0.5%果胶时形成的孔隙结构大小不均一,呈随机分布。随着添加量的增加,蜂窝状多孔结构进一步完善,添加量增加至4%,体系中半乳糖醛酸含量达到173.97 mg/g时,重组食品形成均匀的蜂窝状多孔结构(图3f箭头所示)。经过纤维素酶和果胶酶处理后样品表面光滑,无明显的孔边界,这可能是由于完整的细胞壁结构被酶解聚,并产生较多的小分子糖[34-35]。

图3 重组苹果块的扫描电子显微镜图Fig.3 Scanning electron micrographs of reconstituted apple cubes
为进一步表征重组苹果块的孔隙结构,利用图像分析软件得到样品的孔隙率及孔径分布如表3所示。对照组样品在未添加外源果胶时具有最大的孔隙率,添加果胶后孔隙率呈降低的趋势。与对照样品的平均孔径(3.00 μm)和最小孔径(1.52 μm)相比,添加果胶和酶处理均增加了样品的平均孔径和最小孔径,并且添加果胶酶的样品形成了急剧增加的最大孔径。

表3 重组苹果块的孔隙率和孔径分布Table 3 Porosity and pore size distribution of reconstituted apple cubes
2.5 动态水分吸附
由图4a可知,特定相对湿度下,果胶添加量为0.1%时,吸附时间内样品的质量变化高于对照样品,这可能与果胶链中存在的亲水基团(未甲酯化羧基和氢键)对水的高亲和力有关[21]。增加果胶的添加量在0.5%以上,样品中半乳糖醛酸含量达到70.65 mg/g,同样吸附时间内样品质量变化减小,这可能是由于样品孔隙率(表3)降低,限制了毛细作用和蒸汽在孔隙中的扩散速率,尤其是在高的相对湿度下[36]。
由图4b可知,样品存在解吸滞后现象。将体系中孔结构视为互连网络的模型,这些模型将迟滞归因于孔阻塞,导致水分子逃逸速度较慢[37]。此外,在吸附-解吸的一个循环结束时,质量的变化不会回到起始点,样品在解吸过程中存在一些“被截留”的水分,这说明水分吸附是不完全可逆的[38],尤其是具有多孔性的固体介质,毛细管凝结可能是食品截留住水分的重要原因[36]。酶解样品具有相反的吸附和解吸效果,这可能是由于其特殊结构的大孔性和弱连接作用(图3g、h),降低了水分的移动阻力。

图4 重组苹果块的动态水分吸附(a)和吸附-解吸等温线(b)Fig.4 Dynamic moisture adsorption (a) and adsorption-desorption isotherms (b) of reconstituted apple cubes
2.6 振荡破损率
通过制造持续均匀的振荡模拟产品运输过程造成的物理崩解,发现样品的破损率随着果胶添加量的升高而降低。由图5可知,振荡持续作用60 min的情况下,对照样品与4%果胶添加量样品的破损率分别为60.94%和26.95%,破损率降低55.78%,产品完整性显著提高。经果胶酶处理的样品破损率增加到1.24 倍,这与重组苹果块在硬度上的降低一致(表2)。由图6可知,添加果胶有效提高了重组苹果块的完整性,产品形状与原始苹果块最为相似,振荡产生的碎屑量更少,经果胶酶处理的样品破损最严重。
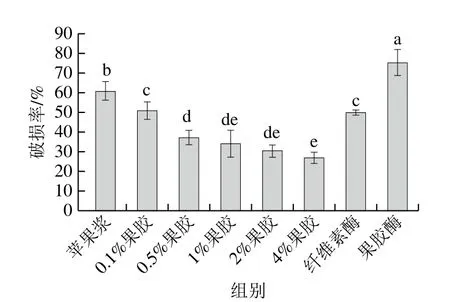
图5 重组苹果块的振荡破损率Fig.5 Breaking rates during oscillation of reconstituted apple cubes

图6 样品破损图Fig.6 Pictures of broken reconstituted apple cubes
2.7 色泽
如图7所示,由于果胶的引入,导致样品L*值(亮度)的降低以及a*值和b*值的增加,样品的色相角(hab*)和色度值(Cab*)增加,这与Holzwarth等[39]观察到添加果胶后果酱色泽的变化一致。这种颜色变化与果胶本身的颜色以及果浆颜色的稀释有关,商用果胶的黄褐色增加样品的b*值,使样品色泽变黄。果胶酶和纤维素酶处理降低了样品的L*值、a*值和b*值,可能是由于细胞壁酶解后降低了产品内部的细胞密度,从而减少了入射光子遇到的细胞-空气和空气-细胞界面的数量(通过有效地增加孔表面密度),影响了重组样品中光的散射[40]。
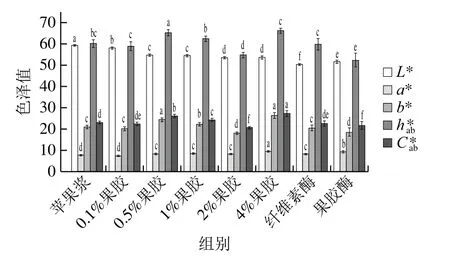
图7 重组苹果块的亮度值、红度/绿度值、黄度/蓝度值、色度和色相角Fig.7 CIE L*, a* and b* color co-ordinates, chroma and hue angles of reconstituted apple cubes
3 结 论
重组果蔬块的微观多孔结构及孔隙壁的化学组成是决定多孔介质质构特征的物质基础,并影响其在环境相对湿度下的水分吸附行为。果胶含量显著影响重组苹果块质构特征,当果胶添加量为4%时,重组苹果块的硬度提高到5.41 倍,脆度增加到1.27 倍,振荡破损率降低了55.78%。结合微观结构分析,对于重组苹果块内部无序的组织结构来说,果胶添加量为0.5%及以上时出现了典型的蜂窝状多孔结构,表明果胶含量显著影响重组果蔬孔隙形态。此外,果胶添加量超过0.5%时,重组脆片易碎性改善,同时还表现出相对较低的吸湿性,有利于产品的贮存和运输。综合来看,通过改变果蔬浆中果胶含量是实现对重组果蔬质构和吸湿性精准调控的有效手段。然而,重组果蔬是复杂的食品体系,果蔬组织中果胶与其他内源组分是否存在协同作用,以及该协同作用对质构和吸湿性的影响机理还有待进一步探讨。
