金黄色葡萄球菌cydA 基因对能量代谢的影响研究
2022-01-06陈嫱罗东彭林凤陈开森
陈嫱,罗东,彭林凤,陈开森
(南昌大学第一附属医院1.检验科;2.呼吸科,江西 南昌 330006)
金黄色葡萄球菌(Staphylococcus aureus, S.aureus, 简称金葡菌) 是一种广泛存在于环境中的重要病原菌[1,2],其能量的利用主要是有氧呼吸。 有氧呼吸的本质是通过一系列的氧化还原反应,最后将电子传递给氧生成水,同时偶联氧化磷酸化作用生成能量物质ATP、ADP 等[3]。NADH、NAD+等在呼吸链传递能量中具有重要作用。
金葡菌编码两个末端氧化酶,分别为cydAB 和qoxABCD 编码的细胞色素bd 氧化酶和细胞色素aa3 氧化酶[4]。 在金葡菌中,cydAB 与qoxABCD 一起失活会阻止呼吸作用并诱导小菌落变体(Smallcolony variants, SCVs)形成[5],表现为生长代谢缓慢、菌落细小(正常菌株的1/10 左右)、色素合成能力低下、溶血性下降、凝固酶反应迟缓、毒力基因表达下调,与生物膜形成和黏附相关的主要基因常常表达增加[6]。 我们前期的研究证实了金葡菌cydA基因缺失后,该变异菌不能形成血浆凝固酶,同时毒力因子表达,甚至粘附能力都受到影响[7]。 有研究结果证实在结核分枝杆菌中,cydAB 是与抑制细菌终末端呼吸氧化酶相关药物的潜在靶标[8]。
为了更进一步了解cydA 如何影响到金葡菌血浆凝固酶形成,我们通过构建cydA 突变株,观察不同外界环境下cydA 对能量代谢的影响,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1 菌种和质粒 金黄色葡萄球菌Newman 菌株及温度敏感型穿梭质粒pKOR1,为本实验室所保存。
1.1.2 试剂和仪器 试剂:营养肉汤,比色法NAD+检测试剂盒、ATP 检测试剂盒、氯霉素、TSB、脱水四环素(中国索莱宝生物科技有限公司);细菌基因组DNA 提取试剂盒(DP302,中国天根生化科技北京有限公司),2×PFU PCR Master MIX (中国天根生化科技北京有限公司);BP ClonaseTM2 Enzyme Mix(美国Invitrogen 公司);质粒提取试剂盒(中国Axygen 公司)。
仪器:聚合酶链反应(PCR) 仪(BioRead 公司);电转化仪(BioRead 公司);紫外凝集成像仪(北京六一公司);酶标仪(山东恒美电子科技有限公司)。
1.2 CydA 敲除株的构建 通过融合PCR 将cydA基因上、下游同源片段连接起来;通过基于位点特异性重组的gateway 克隆技术将融合PCR 产物连接入温度敏感型穿梭质粒pKOR1,转化修饰缺陷型大肠杆菌DC10B,获得同源重组质粒pKOR1-cydA;电转化金黄色葡萄球菌Newman 株;在40℃高温和10 μg/ml 氯霉素双重选择压力下,质粒通过第1 次同源重组整合到金黄色葡萄球菌染色体上;转移到无抗生素的培养基中继续培养,发生第2 次同源重组; 将菌液涂布于含1μg/ml 脱水四环素的培养基上进行反向筛选,最后,挑取菌落通过PCR 鉴定。 本研究所使用的PCR 引物及内切酶见表1。

表1 本研究所使用的引物
1.3 不同条件下的细菌培养 将划线纯化的Newman 野生菌、△cydA 接种至3ml 新鲜肉汤培养基中,37℃,200r/min 过夜培养,第2d,1: 100 比例稀释后转接到3ml 新鲜LB 培养基中,分别置于常规气体及25℃、35℃、40℃条件下恒温摇床,200r/min过夜培养;此外,将Newman 野生菌、△cydA 放在6%CO2气体及35℃培养,具体条件参照常规气体培养。
1.4 细菌ATP 的提取及测定 本实验参照索莱宝ATP 检测试剂盒的说明书,并做适量修改,具体操作步骤如下:取600nm 下OD 值为1.0 麦氏单位的过夜培养菌液1ml,10000g,4℃离心2min 收集到离心管内,弃上清;用无菌PBS 缓冲液重悬洗涤3次,去上清液,加入1.0ml 提取液,超声波破碎6 min(超声条件:冰浴,强度20%,超声2s,停1s,10,000g,4℃离心10min;取上清液至另一EP 管中,加入500μl 的氯仿充分震荡混匀,10,000g 4℃离心3min,取上清液于1.5m LEP 管中,置冰上待测;酶标仪预热30 min 以上,调节波长到340nm,蒸馏水调零; 临用前按ATP 试剂盒内说明书,配制工作液,冰上避光操作;按顺序在96 孔板中依次加入样本液20μl,检测工作液100μl,迅速吹打混匀后,立即速置于酶标仪中测定340nm 下10s 的吸光值A1;然后将96 孔板放入37℃培养箱中孵育3min,速置于酶标仪中测定吸光度值A2。 分别计算ΔA测定=A2 测定管-A1 测定管,并记录结果。 根据标准曲线计算出样品中ATP 的浓度。
1.5 NAD+ 的提取及测定 本实验参照索莱宝NAD+检测试剂盒的说明书,并做适量修改,具体操作步骤如下:取600nm 下OD 值为1.0 麦氏单位的过夜培养菌液1ml,10,000g,4℃离心2min 收集到1.5ml EP 离心管内,弃上清;用无菌PBS 缓冲液重悬洗涤3 次,去上清液,加入1ml 酸性提取液,超声波破碎6min(超声条件:冰浴,强度20%,超声2s,停1s),10000g,4℃离心10min;煮沸5min,冰浴中冷却后,10000g 4℃离心10min; 取上清液200 μL 转移至另一新的1.5ml EP 管中,加入等量碱性提取液使之中和,10000g 4℃离心10min,取上清液,冰上保存待测;酶标仪调节波长至570nm,蒸馏水调零;取1.5ml 棕色EP 管分别设定对照管,测定管,空白管,加入上清液,及蒸馏水;向对照管加入加入NAD 试剂盒内标注的NAD+反应液,充分混匀,室温避光静置20min;向测定管,空白管中加入NAD+反应液100μl,充分混匀,静置5min 后,15,000rpm,25℃离心15min,弃上清,沉淀中加入NADH 检测液200μl。 立即吹打混匀,取200μl 至96 孔板中,迅速将96 孔板置入酶标仪,设置37℃孵育2h,570nm 下比色; 读取吸光值△A=A 测定管-A 对照管,空白管做一到两次,记录吸收值。 根据标准曲线计算出样品中NAD+的浓度。
1.6 生长曲线实验 将Newman 野生菌、cydA 敲除株接种至3 mL 新鲜肉汤培养基中,37℃过夜培养,随后将细菌以1:50 稀释至新鲜TSB 培养基中,于37℃100 rpm 摇床震荡培养,大约每隔1h 取100 μl 细菌测OD600,测定完毕后用Graphpad prism5绘制细菌生长曲线,独立重复至少三次。
2 结果
2.1 CydA 敲除株构建成功的验证 采用cydA 基因上下游引物筛选cydA 敲除菌落,结果如图1,图中的第1、2、4、9 泳道为野生Newman 菌株,含有cydA 基因片 段,扩增 出3039bp 的条带,其中3,5,6,7,8 泳道为初筛基因敲除成功株,无cydA基因片段,扩增出1250bp 条带,并对图中的阳性克隆PCR 产物进行测序,与Newman 标准序列进行比对,证实cydA 基因均被成功敲除。

图1 CydA 基因上下游引物PCR 扩增筛选结果
2.2 CydA 基因缺陷对ATP 检测结果的影响 为了研究cydA 基因缺陷是否会影响金黄色葡萄球菌的能量代谢,根据标准曲线计算出样品中ATP 浓度。 结果发现在不同培养条件时,cydA 基因缺陷型株中的ATP 的水平相比Newman 菌株均无显著降低(P>0.05),表明cydA 基因失活后不会使金葡菌胞内能量物质ATP 减少进而影响细菌生长繁殖,见图2。
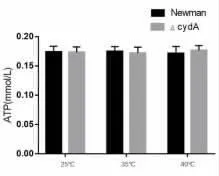
图2 常规气体条件下Newman 菌内ATP 水平
2.3 CydA 基因缺陷对NAD+ 检测结果的影响NAD+是细胞中含量最丰富的辅酶,NADH 为它的还原形式。 在呼吸作用中,在糖酵解、三羧酸循环过程中由NAD+产生NADH,而在氧化磷酸化过程中,NADH 释放出质子和电子,提供能量合成ATP,因此,如果细菌细胞内NAD+减少,会直接抑制呼吸作用,进而抑制氧化磷酸化产生ATP。 为了验证CydA 基因缺陷会导致金黄色葡萄球菌胞内NAD+水平降低,从而影响ATP 的合成,根据NAD+标准曲线计算出样品中NAD+的浓度。 检测了不同菌株中NAD+的水平。 结果发现,在不同温度条件和不同CO2浓度水平下,cydA 基因缺陷型菌株中的NAD+的水平相比Newman 野生株均有显著降低,见图3、图4 和图5。
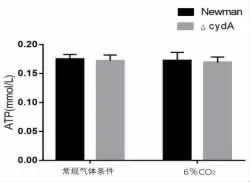
图3 6%CO2 气体条件下Newman 菌内NAD+ 水平
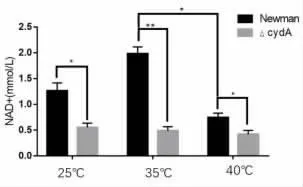
图4 . 常规气体条件下Newman 菌内NAD+ 水平(*, P<0.05; **, P<0.01)

图5 6% CO2 气体条件下Newman 菌内NAD+ 水平(*, P<0.05; **,P<0.01)
3.4 CydA 基因对细菌生长的影响 在12h 的生长时间内,cydA 基因敲除株的生长并未出现显著影响(P>0.05);表明cydA 基因的缺失并不会影响细菌的生长,见图6。

图6 细菌生长曲线
3 讨论
CydA 是bd 型细菌泛醌细胞色素氧化酶的一个亚基,目前对于bd 型细菌泛醌细胞色素氧化酶的认识主要来自大肠埃希菌,bd 型的泛醌细胞色素氧化酶是膜上的呼吸链末端氧化酶,参与NADH分解代谢并为ATP 的合成提供质子跨膜运动的动力[9]。 本研究以cydA 基因缺陷型菌株为切入点,通过检测金葡菌胞内NAD+和细菌胞内ATP 水平,发现金葡菌cydA 缺陷株内ATP 水平无明显变化,但NAD+水平明显下降,由于△cydA 中只有aa3型末端氧化酶存在,这一结果产生可能是由于细胞内aa3 型末端氧化酶电子传递链分支产能效率稍低[8],产生了较少的NADH,从而使NAD+含量下降,此外,cydA 失活后,可能存在其他产能途径补偿了金黄色葡萄球菌内ATP 合成,这从cydA 基因缺失后,生长能力未改变一致。
本研究发现金葡菌cydA 基因突变可以影响NAD+的生成,从而导致血浆凝固酶等毒力因子的形成能力降低,这一发现具有一定应用价值,表现为抗金葡菌毒素虽然不能直接杀死金葡菌,但可以降低其防御能力,有利于免疫细胞杀伤及抗生素的有效杀灭[10]。 同时我们通过基因序列比对发现该基因序列较为保守,是否存在其它菌该基因缺失也导致毒力降低值得探讨。 由于抗生素的副作用越来越明显地影响到细菌的防治,故通过影响病原体毒力因子的表达也许是一种新的思路,故该基因作为新的抗菌靶点值得期待。
