花椒毒酚对大鼠心脏移植物血管病的作用及机制研究
2022-01-06张松林孙来龙
张 鹏 张松林 孙来龙
(三峡大学 第一临床医学院[宜昌市中心人民医院] 胸心外科, 湖北 宜昌 443003)
心脏移植已成为某些终末期心力衰竭患者的标准治疗方案,而心脏移植物血管病(cardiac allograft vasculopathy,CAV)仍然是制约移植后心脏长期存活的主要因素[1]。据统计,CAV的发生率从5年的42%到10年的50%不等,且其发生率并未随着免疫抑制剂的应用而得到有效控制[2]。CAV主要累及心外膜和心肌内动脉,表现为动脉血管的弥漫性圆周样增厚、内膜下平滑肌细胞增殖及单核细胞浸润,中膜较完整,而外膜可出现炎症细胞浸润,有时伴含有B细胞滤泡第三淋巴器官的形成[3]。在免疫抑制剂的基础上,CAV治疗以免疫调节为主,如保护内皮细胞的完整性和功能性,抑制白细胞的活化和迁移,抵制促炎细胞因子的表达及平滑肌细胞的积聚和增殖等[4]。花椒毒酚(xanthotoxol,XT)是一种线型呋喃香豆素,主要来源于伞形科植物蛇床、白芷等,具有抗肿瘤、抗炎、平喘和抗心律失常等多种生物活性与药理作用[5],可缓解大鼠脑缺血/再灌注损伤[6],并具有抑制核因子-κB(nuclear factor-kappa B, NF-κB) /iNOS通路等作用[7]。
本实验将利用改进的套管法大鼠胸主动脉腹腔移植模型,诱导大鼠胸主动脉CAV样病理变化,观察XT对CAV的血管形态变化细胞间粘附分子-1(intercellular adhesion molecule-1,ICAM-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子的表达作用,探讨XT对大鼠心脏移植物血管病的作用及其相关机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级别雄性SD(Sprague Dawley)大鼠,体质量300~330 g,购自三峡大学实验动物中心[SCXK(鄂) 2017-0012];SPF级别雄性Wistar大鼠,体质量120~150 g,购自湖北省实验动物研究中心[SCXK(鄂)2015-0018]。大鼠饲养温度为(23±2)℃,相对湿度为(55±5)%,自由饮食。实验操作在三峡大学实验动物中心屏障实验室[SYXK(鄂)2017-0061]完成,并遵循实验动物的“3R”原则给予人道关怀。
1.1.2 实验器材与试剂
JJ-12J脱水机(武汉俊杰电子有限公司),JB-P5包埋机(武汉俊杰电子有限公司),RM2016病理切片机(上海徕卡仪器有限公司),JB-L5冻台(武汉俊杰电子有限公司),KD-P组织摊片机(浙江省金华市科迪仪器设备有限公司),显微外科器械包(卓越医疗器械),XTL-165双目外科显微镜(江西凤凰光学股份有限公司),16G静脉留置针(贝朗医疗(上海)国际贸易有限公司),20G静脉留置针(江西丰临医用器械有限公司),8-0、9-0显微带线缝合针(宁波医用缝针有限公司),3-0真丝非吸收缝线(扬州市金环医疗器械厂),肝素钠(北京亚米生物科技有限公司),戊巴比妥钠(上海化学试剂公司),XT(HPLC≥98%,四川省维克奇生物科技有限公司),二甲基亚砜DMSO(津北恒兴试剂),4%多聚甲醛固定液,苏木素-伊红染液(武汉谷歌生物科技),一抗:ICAM-1(稀释比为1∶200),TNF-α(稀释比为1∶800),转化生长因子-β1(transforming growth factor-β1,TGF-β1)(稀释比为1∶500),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(稀释比为1∶500),增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)(稀释比为1∶100),NF-κB/P65(稀释比为1∶500)(武汉三鹰),二抗:HRP标记的山羊抗兔鼠通用,免疫组化试剂盒DAB显色剂(DAKO)。
1.2 实验方法
1.2.1 动物模型建立及分组
采用随机数表法将大鼠随机分为模型组和药物组,其中模型组和药物组再分为空白对照组(不做任何处理)、7天组、28天组和56天组(n=5)。以Wistar大鼠胸主动脉为供体,SD大鼠为受体(Wistar→SD),造模前禁食12 h,自由饮水,腹腔注射1.5%戊巴比妥钠(40 mg/kg)麻醉,取出修剪好的供体动脉后,肝素钠生理盐水反复冲洗管腔,将动脉穿过切取的长约4 mm的静脉留置针管,翻转血管后,8-0显微线对称吻合固定,一端打结固定,完成套管的制作,置于4℃生理盐水备用;同样方法将受体大鼠麻醉后,打开腹腔,分离肾动脉平面下方腹主动脉约1.5 cm,动脉夹阻断血流后,用显微剪剪开动脉前壁约1/3周径血管,将制备的套管置于0.5 mm半针管笔尖上,平行插向远心端,9-0显微线缝合剪口,观察远端血管是否充盈通畅,术后48 h大鼠四肢能自由活动,大小便正常视为手术成功。
1.2.2 给药
药物组大鼠在关腹前给予XT 10 mg/kg(DMSO溶解终浓度为25%)腹腔注射,关腹后置于保温垫上,待苏醒后转动物房,此后每天同样剂量改灌胃给药,模型组大鼠术后每天以同等剂量的生理盐水灌胃,直到各观察时间点。
1.2.3 HE染色和动脉内膜厚度测量
在术后7天、28天和56天,麻醉处死大鼠后,分离切取移植的套管动脉,肝素钠生理盐水反复冲洗,置于4%的多聚甲醛中固定24 h,常规石蜡包埋、4 μm切片和HE染色,显微镜下取血管横截面3、6、9、12点钟的不同视野,计算机摄像系统进行拍照,Image-pro plus 6.0图像分析软件进行分析。模型组因无药物干预,个别样本在观察点出现管腔堵塞,应给予排除,以免影响数据分析,因此统一从样本中随机选取6张图片进行分析。模型组56天,由于管壁结构消失,我们以内膜边缘到再通血管红细胞渗出处代表内膜增生厚度(n=6)。
1.2.4 免疫组织化学染色(SP法)
同样在各观察时间点,取得移植动脉后,步骤同HE染色,切片常规脱蜡,柠檬酸缓冲液(pH 6.0)对组织切片进行抗原修复,3%过氧化氢溶液(双氧水∶纯水=1∶9)灭活内源性过氧化物酶,滴加3%BSA封闭液,室温封闭30 min,逐一滴加一抗、二抗,再用PBS洗2 min,共3次,滴加新鲜配制的DAB显色液,显微镜镜检,阳性表达区显示棕黄色,细胞核显示蓝色。Image-pro plus 6.0软件分析图像,测量各组积分光密度值(integrated optical density,IOD)(n=6),计算其平均积分光密度值(average integral optical density,AIOD)=IOD/面积(Area)。
1.3 统计学分析
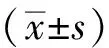
2 结果
2.1 HE染色和内膜厚度变化
正常大鼠胸主动脉如图1A和1E所示,可见内膜的单层内皮细胞,中膜为大量排列整齐的平滑肌细胞,外膜为疏松结缔组织,动脉结构完整。模型组在7天和28天,内膜和中膜出现大量单核巨噬细胞堆积,管腔侧有血栓机化形成(图1B和1C);在56天炎症细胞侵蚀动脉管壁,中膜弹性纤维断裂,管壁机化(图1D),管腔狭窄或闭塞。药物组在7天,中膜出现大量单核巨噬细胞的聚集,内皮细胞受损(图1F);28天中膜弹性纤维部分断裂,内膜有大量单核细胞和少量平滑肌细胞的堆积,管腔侧可见连接紧密的单层内皮细胞(图1G);56天动脉中膜弹性纤维比较完整,内膜可见大量梭形核状平滑肌细胞及完整的内皮细胞(图1H)。我们同时测量了各组动脉内膜厚度,如表1所示,与空白对照相比,模型组56天内膜厚度达到最大值;与同期模型组相比,药物组在7天与56天动脉内膜增厚程度明显减轻(P<0.05)。
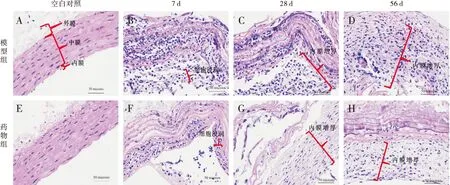
注:A、E:空白对照; B~ D:分别为模型组7天、28天和56天血管形态; F~H:分别为药物组7天、28天和56天血管形态图1 各时间点供体动脉HE染色
2.2 移植动脉免疫组织化学染色ICAM-1、TNF-α、PCNA、α-SMA、TGF-β1和NF-κB/P65的表达情况
各时间点ICAM-1的平均光密度值如图2A所示,与同期模型组相比,药物组ICAM-1在28天和56天时表达均明显降低(均P<0.05)。TNF-α在模型组7天、28天和56天都持续高表达,而药物组TNF-α的表达量均低于同期模型组(均P<0.05),见图2B。模型组α-SMA的含量逐渐减少,与同期模型组相比,药物组在28天和56天时α-SMA的表达均明显增加(均P<0.05),见图2C。TGF-β1的表达量如图2D所示,与模型组相比,药物组7天和28天时TGF-β1表达量明显减少(均P<0.05),而56天时两组差别不明显(P>0.05)。NF-κB/P65的各期表达量如图2E所示,与模型组相比,药物组28天和56天时NF-κB/P65的表达量均明显降低(均P<0.05)。模型组PCNA的平均光密度值持续增加,与同期模型组相比,药物组PCNA表达量无减少(图2F),其中模型组56天时PCNA阳性表达区主要分布于机化管壁的炎症细胞和平滑肌细胞中,药物组56天时主要分布于新生内膜平滑肌细胞中(图3)。
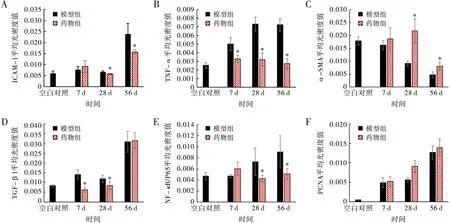
注:A:各组ICAM-1的平均光密度值; B: TNF-α的平均光密度值; C: α-SMA的平均光密度值; D:TGF-β1的平均光密度值; E:NF-κB/P65的平均光密度值; F:PCNA的平均光密度值。与同期模型组相比,*P<0.05图2 各组免疫组织化学染色平均光密值
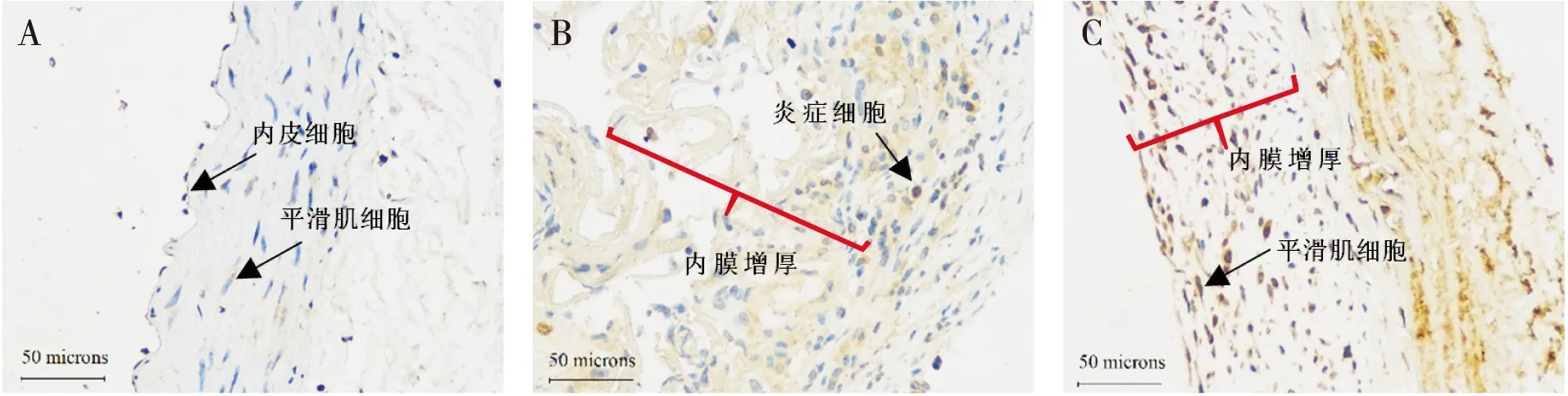
注:A:空白对照; B:模型组56天; C:药物组56天图3 各组56天时PCNA免疫组织化学染色
3 讨论
CAV是心脏移植术后的晚期并发症,表现为心脏脉管系统的进行性闭塞,最终导致移植物功能丧失[8]。Huibers等[9]通过尸检发现了三种不同形态的CAV:①内膜单核炎症细胞的浸润;②单核细胞浸润伴平滑肌细胞增殖;③致密结缔组织没有明显炎症细胞的浸润。而其变化程度与心脏移植后时间、受者年龄、动脉粥样硬化疾病和感染发生密切相关[9],在CAV严重病变中微脉管系统床密度减少、血管重塑、心肌间质纤维化可导致微循环结构的丧失和功能减退,最终引起心脏舒张功能障碍[10]。
人体分配血管动脉中膜富含血管平滑肌细胞(vascular smooth muscle cell,VSMCs)和弹性纤维,其内膜是由单层内皮细胞及内皮下的结缔组织和内弹性膜构成,主要功能是将血液运输至各器官组织[11]。正常Wistar大鼠降主动脉中膜含有大量VSMCs和弹性纤维,与完整的内皮细胞和外膜疏松结缔组织共同构成了动脉的完整结构,可以很好地模拟人冠状动脉。我们通过大鼠胸主动脉的同种异体移植,建立了大鼠同种异体移植物血管的慢性排斥反应模型。与空白对照组相比,模型组各时间点动脉管壁逐渐被炎症细胞浸润,弹性纤维部分断裂,内膜VSMCs分化活跃,结构疏松,内膜增厚。与模型组相比,XT药物组28天时动脉中膜弹性纤维较完整,炎症细胞减少,内皮细胞较完整,56天时中膜弹性纤维较完整,炎症细胞明显减少,内皮下可见大量梭形核状的平滑肌样细胞及少量胶原沉积,管腔尚且通畅。以上表明XT可抑制移植物中炎症细胞的浸润,改善移植动脉管壁结构,部分缓解VSMCs在内膜下的积聚,减轻移植动脉管腔阻塞程度,从而延缓CAV的发展。
ICAM-1在CAV发展的初始阶段起着重要的促进作用。在心肌缺血/再灌注损伤研究中,ICAM-1基因敲除小鼠的心肌坏死风险区域明显降低,单克隆抗体ICAM-1可明显减少缺血/再灌注心肌组织中多形核粒细胞的浸润[12-13]。本实验中,模型组ICAM-1表达范围和强度在56天时达到最大;与同期模型组相比,药物组28天与56天时ICAM-1平均光密度值明显减少。以上表明,XT可抑制ICAM-1的表达,减少单核细胞粘附和跨内皮细胞迁移,减轻CAV进展中的炎症反应。
TGF-β1在CAV新生内膜平滑肌细胞增殖中有促纤维化作用。人心脏移植标本中,TGF-β1在冠状动脉管壁的表达量与α-SMA的表达和内膜VSMCs的面积呈正相关,而与心脏移植物存活时间呈一定的负相关,TGF-β1在CAV冠脉管壁中表达量明显增加,并能促进VSMCs增殖与分化[14]。心脏移植物脉管系统中,纤维化过程主要表现为冠状动脉内膜和外膜胶原的过量沉积。内皮细胞功能损伤将诱导炎症细胞向管壁中膜迁移,释放的TGF-β进一步促进VSMCs增殖、迁移和胶原产生,从而导致新生内膜组织纤维化[15]。PCNA存在于细胞核内, 是DNA聚合酶δ的辅助作用蛋白,其量的变化与DNA合成一致,可作为评价平滑肌细胞增殖状态的指标[16]。在我们的大鼠模型实验中,PCNA免疫组化显示:随移植时间的增加,模型组中PCNA的表达范围和强度不断增加;与模型组相比,XT药物组PCNA的表达强度和范围也呈增加趋势,主要分布于内皮及内皮下分化的平滑肌细胞中。同期模型组和药物组相比,PCNA平均光密度值差异无统计学意义。我们推测模型组血管重塑是以细胞凋亡、增生为主,而药物组血管是以平滑肌样细胞分化、增殖和迁移为主。
α-SMA是构成血管平滑肌细胞收缩装置的细胞结构蛋白,在分化成熟的VSMCs中高表达,当VSMCs出现凋亡、纤维化或由“收缩型”转换为“合成型”时α-SMA表达量将减少[17-19]。与空白对照相比,模型组各时间点α-SMA的表达强度和范围逐渐减少,药物组在移植后的28天和56天,其α-SMA平均光密度值比同期模型组要高;模型组和药物组中TGF-β1表达范围和强度不断增加,以56天最为显著,而药物组7天和28天 TGF-β1平均光密度值较同期模型组明显降低。以上结果表明,药物组保留了部分平滑肌细胞α-SMA的表达,并降低了早期移植物血管中TGF-β1的表达;模型组内膜增厚可能由于供体源循环细胞的沉积,以细胞凋亡和去分化为“合成型”平滑肌样细胞为主,而药物组移植物血管新生内膜的形成可能由于受体源血管中膜平滑肌细胞增殖、迁移所致,PCNA表达增高和α-SMA表达降低提示两组增殖的“平滑肌样细胞”存在表型差异。
NF-κB信号通路可调控促炎细胞因子的产生、白细胞的招募与存活,在急/慢性炎症反应中具有重要作用。内皮细胞受损、缺血/再灌注损伤、固有免疫反应、平滑肌细胞增殖和迁移以及冠状动脉粥样硬化形成过程都能激活NF-κB信号通路,且与CAV的形成与发展密切相关[20-22]。在我们的试验中,药物组与同期模型组相比,TNF-α表达范围和强度明显减小,NF-κB/p65在28天和56天时表达量明显降低。以上表明,XT对TNF-α表达有明显抑制作用,并能部分抑制NF-κB p65信号通路的活化。
综上所述,XT能明显降低大鼠同种异体移植物血管病中ICAM-1、TNF-α和TGF-β1的表达量,保留新生内膜平滑肌细胞的收缩表型,改善血管形态从而有效缓解CAV的进展,这可能与部分抑制NF-κB的活化相关,其具体机制仍需进一步探索。
