滇龙胆提取物对脂多糖诱导的THP-1巨噬细胞的抗炎作用
2022-01-05李鑫波刘秀嶶吴昕怡谢晓丽
李鑫波,刘秀嶶,吴昕怡,田 浩,刘 静,谢晓丽
(1.昆明理工大学 医学院,云南 昆明 650500; 2.云南省农业科学院农产品加工研究所,云南 昆明 650221)
0 引 言
炎症是宿主对致炎因子刺激产生的一种防御性为主的免疫反应,体内多种细胞被招募到免疫微环境中,产生细胞因子消除外界因素的入侵,恢复机体健康,但持续存在的炎症会对机体器官以及全身反应产生损害,在很多复杂疾病的发生发展进程中扮演着重要角色[1].巨噬细胞在调控宿主炎症反应变化的过程中扮演着重要角色.存在于源自病原体、受伤组织或适应性免疫的激活效应子的不同微环境中的信号,会在分化巨噬细胞中引发不同的遗传程序,从而诱导不同的功能极化状态.M1和M2是用于定义在体外激活为促炎(当与经典的IFN-γ和脂多糖(lipopolysaccharide,LPS))或抗炎(当分别使用IL-4或IL-10激活)两种[2].M1极化的巨噬细胞对于在损伤后引发炎症反应至关重要,而切换到M2表型似乎对于消退炎症和损伤组织的再生至关重要.正常机体内的巨噬细胞经常维持一种稳态的平衡,然而当巨噬细胞极化失调则可能导致多种慢性炎症相关性疾病的发生发展,例如脓毒症、动脉粥状硬化、哮喘及炎症性肠病等[3].因此,抑制持续的M1型巨噬细胞存在和促进M2表型的表达可能在炎症相关疾病中获益,这也使得对巨噬细胞极化的调控有望成为控制和治疗这些炎症性疾病新的靶点.
Rel /NF-κB转录因子家族的成员是炎症应答过程的关键调节剂.在哺乳动物中,Rel家族由5个成员组成,即c-Rel、NF-κB p65(RelA)、RelB、NF-κB1(p50 / p105)和NF-κB2(p52 / p100).Rel二聚体通常通过与IκB蛋白的胞质结合而维持在非活性状态[4].细胞活化导致信号转导级联反应,导致IκB的磷酸化和降解,从而使Rel二聚体迅速转移核并结合DNA.STING 作为一种 I 型干扰素刺激基因,在天然免疫中发挥着重要作用.STING与活化信号结合活化后,进而募集并活化 TBK1和 IRF3,最终引起IRF3磷酸化并促进一型干扰素的产生[5].研究表明STING激活的下游也观察到 NF-κB信号通路的激活[6], 同时实验也表明活化的TBK1与IKKβ相互作用并磷酸化IKKβ,从而激活STING-TBK1介导的NF-κB通路[7].
滇龙胆(Gentiana rigescens Franch. ex Hemsl.),也称坚龙胆,为龙胆科多年生草本植物,作为云南地区特有的药用植物,其保肝、健脾的药效广为当地所知.沈磊等[8]研究显示在ConA诱导的肝损伤小鼠模型中滇龙胆提取物能够有效地抑制小鼠血清谷丙转氨酶和谷草转氨酶的活性,且组织病理指数评分也显示其可减轻肝脏损伤.龙胆苦苷 (gentiopicroside,GPS)是滇龙胆主要有效成分.龙胆苦苷是一种裂环烯醚萜苷类化合物,具有包括抗炎在内的多种药理作用.有研究表明可以预防IL-1β诱导的软骨细胞炎症反应[9],在葡聚糖硫酸钠诱导的急性结肠炎模型中发挥抗炎作用[10],在肝损伤小鼠模型中龙胆苦苷处理可抑制血清TNF-α细胞因子分泌、增加肝转氨酶水平从而缓解肝损伤[11].山田等[12]的研究中发现龙胆根中龙胆苦苷对LPS诱导的TNF-α产生没有任何影响,而是龙胆内酯提取成分抑制小鼠巨噬细胞中的TNF-α,iNOS和Cox-2 mRNA表达并阻断NF-κB启动子活性.但王等人[13]发现龙胆苷在体外通过NF-κB信号通路阻止LPS /IFN-γ诱导小鼠原代巨噬细胞产生炎性细胞因子IL-1β、TNF-α、IL-6、CXCL10、iNOS和CCL5,并在LPS诱导的内毒素休克小鼠模型中抵抗败血症的发生发展.但是,滇龙胆和龙胆苦苷的潜在抗炎分子机制尚未得到充分研究.本实验借助THP-1诱导的巨噬细胞研究滇龙胆粗提物及其主要成分龙胆苦苷单体的抗炎作用.研究发现滇龙胆和龙胆苦苷对LPS诱导的巨噬细胞的促炎因子有抑制作用,同时龙胆苦苷抑制IκBα蛋白降解和NF-κB p65、p-TBK1蛋白磷酸化,这些结果表明滇龙胆和龙胆苦苷在THP-1诱导的巨噬细胞中有抗炎活性.本研究为天然产物抗炎药的开发提供理论依据,为进一步了解滇龙胆对巨噬细胞极化的调控研究做出贡献.
1 材料与方法
1.1 天然药物来源
滇龙胆提取物和龙胆苦苷单体由云南省农业科学技术研究院提供.滇龙胆提取物的制法:滇龙胆样品粉碎后过50目筛,称取1 kg样品粉末,以料液比1∶10的比例加入95%乙醇,超声提取30 min,过滤,取滤液;滤渣加入95%乙醇,超声提取,重复提取两次;将滤液合并,在45 ℃条件下减压浓缩至干,得提取物.经HPLC检测,提取物中龙胆苦苷的含量为12.59%.龙胆苦苷单体纯度为99%.
1.2 细胞株
人髓系白血病单核细胞THP-1细胞系购买于国家实验细胞资源共享服务平台.
1.3 主要试剂
滇龙胆提取物用DMSO配置成500 mg/mL母液,并用细胞培养基稀释成5 mg/mL药物并分装;龙胆苦苷单体用无菌去离子水配置成10 mg/mL母液,并用细胞培养基稀释成1mg/mL药物并分装.佛波酯(PMA)购自Sigma公司,用DMSO配置成1 mg/mL母液分装;LPS购自Sigma公司,用无菌去离子水配置成2.5 mg/mL母液,并用细胞培养基稀释成10 μg/mL并分装.以上试剂均-20 ℃保存.
MTT购自德国默克公司,胎牛血清购自美国英杰生命技术公司,RPMI-1640培养基购自Gibco公司,荧光定量PCR引物购自擎科公司,STING、NF-κB p65、TBK1、p-TBK1一抗购自Cell Signaling Technology公司,p-NF-κB p65(Ser536)一抗购自Affinity公司,IkBa一抗购自万类生物公司,β-actin一抗、辣根过氧化物酶偶联的IgG二抗购自 Santa Cruz 公司,ECL超敏化学发光试剂盒购自GE Healthcare公司.
1.4 细胞培养
THP-1细胞使用RPMI-1640培养基(含有10 %胎牛血清、50 μM β巯基乙醇和1%青-链霉素双抗溶液)悬浮培养于5% CO2、37 ℃细胞培养箱.使用生长旺盛的悬浮THP-1细胞进行巨噬细胞诱导实验,THP-1细胞接种6孔板(细胞密度1×106个/mL,每孔2 mL),加入PMA(终浓度100 ng/mL)诱导细胞贴壁培养48 h,弃上清,并用细胞PBS缓冲液冲洗3遍,加入新的1640培养基,同时加入 LPS(终浓度100 ng/mL)刺激巨噬细胞向M1型分化,构建巨噬细胞炎症模型,并加入不同药物干预.滇龙胆提取物空白对照组:PBS+DMSO;阳性对照组:LPS+DMSO.龙胆苦苷单体空白对照:PBS;阳性对照组:LPS.
1.5 MTT、CCK8法进行细胞毒性评价
将THP-1细胞接种于96孔板(细胞密度7×105个/mL,每孔100 μL),加入PMA(终浓度100 ng/mL)诱导细胞贴壁培养48 h,弃上清,并用细胞PBS缓冲液冲洗3遍,加入新的1640培养基,加入 LPS(终浓度100 ng/mL)处理,同时加入不同浓度的滇龙胆提取物处理44 h ,每孔加入20 μL (5 mg/mL)的MTT,并在培养箱中继续孵育4 h,将96孔板取出,弃去液体并加入150 μL DMSO放置到摇床震荡15 min,使甲瓒充分溶解,酶标仪检测490 nm波长的吸光度.CCK8法细胞铺板同上,加入不同浓度的化合物处理44 h后,每孔加入20 μL CCK8试剂,并在培养箱中孵育1~4 h,酶标仪检测450 nm波长的吸光度.滇龙胆提取物对照组:LPS+DMSO;龙胆苦苷单体对照组:LPS.
1.6 荧光定量PCR法检测细胞炎症因子的表达
细胞铺板同上细胞培养描述,加入LPS和不同浓度药物刺激48 h,收取细胞RNA进行逆转录,配置好扩增体系后使用荧光定量PCR检测.引物信息如下(5’-3’):TNF-α F-CCTCTCTCTAATCAGCCCTCTG,R-GAGGACCTGGGAGTAGATGAG;MCP-1 F-GAAACATCCAATTCTCAAACTG,R-AATGAAGGTGGCTGCTAT;IL-1β F-TCTCTTCAGCCAATCTTCA ,R-CCACTGTAATAAGCCATCATT;IL-6 F-ACTCACCTCTTCAGAACGAATTG,R-CCATCTTTGGAAGGTTCAGGTTG;TGF-β F-CAAGTTCAAGCAGAGTACA,R-TATCGCCAGGAATTGTTG;IL-10 F-TCCCAGGCAACCTGCCTAAC,R-AAATCGATGACAGCGCCGTAG;CCL22 F-GGATCGCCTACAGACTGCACTC,R-GAATCATCTTCACCCAGGGCACTC;STING F-AGCATTACAACAACCTGCTACG,R-GTTGGGGTCAGCCATACTCAG;IFN-α4 F-AAACCTAGAGGCCGAAGTTCAAGG,R-TCACAGCCCAGAGAACAGATG;IFN-β1 F-GCTTGGATTCCTACAAAGAAGCA,R-ATAGATGGTCAATGCGGCGTC;GAPDH F-GTCTTCACCACCATGGAGAAGGC,R-TTGTTGTCATGGATGACCTTGGCC.
1.7 Western blot检测炎症通路相关蛋白的表达
细胞铺板同上细胞培养描述,加入LPS和不同浓度龙胆苦苷单体药物作用1 h,收取细胞蛋白,使用BCA蛋白检测试剂盒确定蛋白浓度,并配制等浓度体系,金属浴上90 ℃ 10 min进行蛋白变性,通过10% SDS-PAGE电泳分离细胞裂解蛋白(15 μg)并转移至PVDF膜,5% 脱脂牛奶室温封闭2 h,将PVDF膜用抗STING、p-NF-κB p65、NF-κB p65、IkBa、TBK1、p-TBK1、β-actin IgG抗体(均为1∶1 000稀释)标记4 ℃孵育过夜,在Tris缓冲液清洗后将PVDF膜用辣根过氧化物酶偶联的抗小鼠或抗兔IgG抗体(均为1∶10 000稀释)室温孵育2 h,洗膜后使用ECL超敏化学发光试剂盒和化学发光检测系统(Tanon)识别条带.龙胆苦苷单体空白对照:PBS;阳性对照组:LPS.
1.8 统计学分析
所有统计均采用Graph pad 7.0统计软件处理,数据均以均数±标准差(x±SD) 表示,统计分析采用单因素方差分析(Oneway ANOVA)检验.P<0.05 认为有统计学意义.标注中:*表示与LPS组相比*P<0.05;**P<0.01,***P<0.001,****P<0.0001.
2 结 果
2.1 滇龙胆粗提物细胞毒性评价
经LPS刺激的THP-1样巨噬细胞加入不同浓度(10、50、100、200 μg/mL)的滇龙胆粗提物,体外培养48 h,MTT实验检测细胞活性.结果如图1所示,各浓度药物处理组与未加药组相比,其光密度值(OD值)无明显变化,表明0~200 μg/mL浓度滇龙胆粗提物对巨噬细胞无药物毒性.
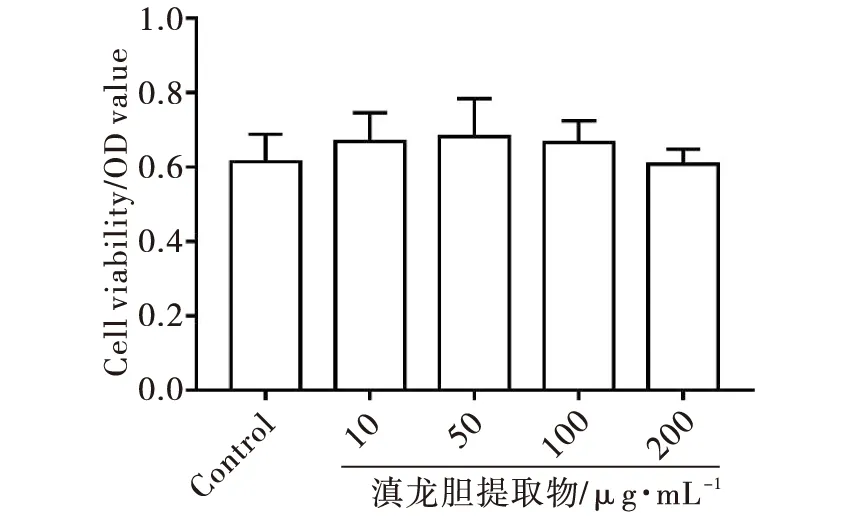
图1 滇龙胆粗提物对M1型巨噬细胞的药物毒性作用Fig.1 Toxicity of crude extract of Gentiana rigescens Franch. ex Hemsl. on M1 macrophages
2.2 滇龙胆粗提物对LPS诱导的巨噬细胞促炎、抑炎因子mRNA表达的影响
前期MTT结果证实,在200 μg/mL范围内的滇龙胆提取物没有明显的细胞毒性,选择了三个浓度(25、50、100 μg/mL)进行接下来的试验.向LPS诱导的巨噬细胞中加入不同浓度滇龙胆处理48 h,结果如图2所示.与空白组相比,LPS刺激组TNF-α、IL-6、IL-1β 水平显著升高(P<0.001或0.000 1)(图2a).然而,加入不同剂量的滇龙胆(25,50,100 μg/mL)后,TNF-α mRNA表达水平相比 LPS刺激组均显著下降(P<0.001);IL-6 mRNA表达水平也显著下降(P<0.05),IL-1β mRNA表达则在中、高剂量组(50,100 μg/mL)明显下降(P<0.05);MCP-1的mRNA表达水平未有明显变化(图2a).同时,我们也检测了M2相关因子CCL22、IL-10和TGF-β的mRNA表达,结果如图2b所示,加入滇龙胆组的CCL22、IL-10 mRNA表达没有明显变化,加入50 μg/mL的滇龙胆组的TGF-β mRNA表达水平相比 LPS刺激组下降(P<0.05).

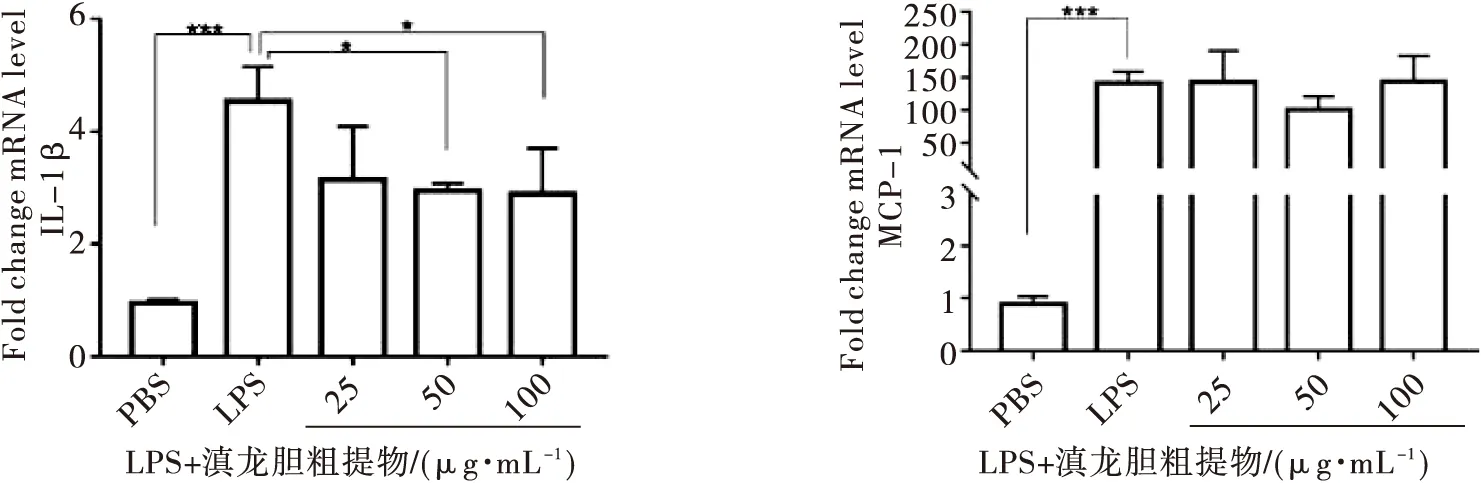
(a) M1巨噬细胞促炎因子mRNA表达
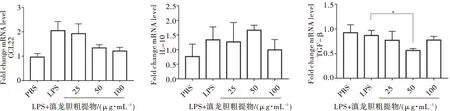
(b) 巨噬细胞抑炎因子mRNA表达(*P<0.05,**P<0.01,***P<0.001,****P<0.000 1)图2 滇龙胆粗提物对M1巨噬细胞促炎、抑炎因子mRNA表达的调控作用Fig.2 The regulation of the crude extract of Gentiana rigescens Franch. ex Hemsl. on the mRNA expression of pro-inflammatory
2.3 滇龙胆对LPS诱导的巨噬细胞一型干扰素mRNA的影响
LPS刺激巨噬细胞同时也会激活其干扰素通路,因此,检测了一型干扰素的表达变化.结果如图3所示,IFN-β1、IFN-α4的mRNA表达水平在LPS刺激下未有明显变化,但滇龙胆提取物作用后IFN-β1表达下降(P<0.05或0.01)(图3c),而IFN-α4表达无明显变化.STING 的mRNA表达水平在LPS刺激下未有明显变化,但在中、高剂量(50,100 μg/mL)滇龙胆提取物作用下其表达下降(P<0.05或0.01).
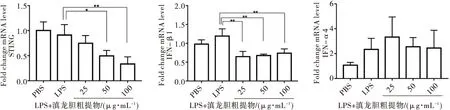
(*P<0.05 ,**P<0.01)图3 滇龙胆对LPS刺激巨噬细胞的一型干扰素mRNA的影响Fig.3 Effect of Gentiana rigescens Franch. ex Hemsl. on type I interferon mRNA of macrophages stimulated by LPS
2.4 龙胆苦苷的细胞毒性评价

(*P<0.05 ; **P<0.01)图4 龙胆苦苷对M1型巨噬细胞的药物毒性作用Fig.4 Toxic effects of gentiopicroside on M1 macrophages
前期数据表明滇龙胆粗提物具有抑制促炎因子产生的效果,而龙胆苦苷(GPS)是滇龙胆的主要活性成分,因此接下来我们在M1型巨噬细胞中研究了GPS的抗炎作用.
通过CCK8实验检测龙胆苦苷药物细胞毒性,经LPS刺激的THP-1样巨噬细胞加入不同浓度的龙胆苦苷,体外培养48 h后检测细胞活性.结果如图4所示,各浓度(0.05、0.1、0.25、0.5、0.1、2.5、5、15、50 μg/mL)龙胆苦苷与未加药组相比其OD值无明显差异,表明0~50 μg/mL龙胆苦苷药物对巨噬细胞模型无药物毒性.
2.5 龙胆苦苷对LPS诱导的巨噬细胞细胞因子mRNA表达的影响
接下来检测不同浓度龙胆苦苷对促炎细胞因子的作用,结果如图5a所示,与单独LPS刺激组相比,加入不同剂量龙胆苦苷(2.5,25 μg/mL)24h后,促炎因子TNF-α的mRNA表达水平有所下降(P<0.05);IL-6的mRNA表达水平明显降低,高剂量组(25 μg/mL)下降非常显著(P<0.001);CCL2的mRNA表达无明显变化.同时我们也检测了龙胆苦苷对一型干扰素的表达变化,但加入龙胆苦苷作用后IFN-β1、IFN-α4的mRNA表达水平未见明显变化(图5b).

(a) 巨噬细胞促炎因子mRNA表达
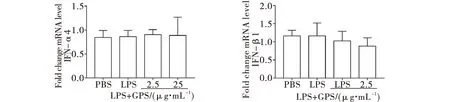
(b) 巨噬细胞一型干扰素mRNA表达(*P<0.05 ,**P<0.01,***P<0.001,****P<0.000 1)图5 龙胆苦苷对M1巨噬细胞促炎因子、一型干扰素mRNA表达的调控作用Fig.5 Regulatory effect of gentiopicroside on the expression of cytokine mRNA in M1 macrophages
2.6 龙胆苦苷对LPS诱导的巨噬细胞炎症信号通路的调控作用
采用Western blot检测龙胆苦苷对LPS刺激的巨噬细胞炎症信号通路蛋白的影响.LPS与龙胆苦苷(2.5 μg/mL)药物同时作用巨噬细胞,处理1 h,采用Western blot检测巨噬细胞炎症信号通路蛋白的表达变化,结果如图6所示.与PBS空白对照组相比,单独LPS刺激组的IκBα、NF-κB p65的表达量明显下降,而龙胆苦苷处理组的IκBα、NF-κB p65的表达相比LPS刺激组有所回升;龙胆苦苷处理组的磷酸化NF-κB p65的表达相比LPS刺激组明显降低(图6a).
同时,我们发现LPS刺激后巨噬细胞STING的蛋白表达无明显变化,但是TBK1的表达明显下降,而p-TBK1的表达明显增加.而与LPS刺激组相比,加入龙胆苦苷(2.5 μg/mL)增加了TBK1的蛋白量,降低了p-TBK1的表达量,p-TBK1/TBK1比例降低.

(a) NF-κB炎症通路蛋白表达 (b) STING通路蛋白表达图6 龙胆苦苷对LPS刺激巨噬细胞的炎症通路蛋白表达的调控Fig.6 Regulation of gentiopicroside on the expression of inflammatory pathway proteins stimulated by LPS in macrophages
3 讨 论
巨噬细胞被招募到炎症部位后,免疫微环境中源自病原体、受伤组织或适应性免疫的激活信号会在巨噬细胞分化中引发不同的遗传程序,从而诱导不同的极化状态,M1和M2代表在体外激活为促炎或抗炎的巨噬细胞.M1极化的巨噬细胞是损伤后引发炎症反应的关键因素,而切换到M2表型对于消退炎症和损伤组织的再生至关重要.M1-M2平衡失调通常与炎症性疾病有关,因此调控巨噬细胞亚群极化是抗炎药物的潜在靶标.在体外实验中,M1的刺激效应物能够诱导巨噬细胞大量分泌促进炎症产生的细胞因子,因此在药物抗炎活性研究工作中首先观察药物是否能改变巨噬细胞中以上几种细胞因子的分泌,这样可以反映出药物对M1型巨噬细胞极化的影响.同时,在炎症消退阶段,巨噬细胞启动M1到M2表型转换,逐渐获得抗炎表型,包括下调炎症介质、增加抗炎细胞因子(例如TGF-β和IL10)的产生等.因此,在实验中我们也关注了M2型巨噬细胞表达标志物TGF-β、IL-10和CCL22的变化.
我们初步确定了滇龙胆提取物及龙胆苦苷单体的抗炎效果.在M1型巨噬细胞模型中,滇龙胆粗提物、龙胆苦苷可抑制LPS诱导的促炎因子TNF-α、IL-6、IL-1β的表达,表明减弱炎症性M1巨噬细胞的极化.这与Mubashir等人在小鼠腹腔巨噬细胞的研究结果一致[14],龙胆提取物以剂量依赖性方式抑制巨噬细胞释放TNF-α、IL-6两种细胞因子.巨噬细胞对炎症反应的调控不仅取决于关闭炎症信号的产生,而且还取决于增加抗炎介质的产生[15].因此我们还检测了M2型巨噬细胞相关标志,结果显示,滇龙胆粗提物并未增加M2巨噬细胞标志物CCL22、IL-10的表达,提示滇龙胆的抗炎作用主要通过抑制M1巨噬细胞的炎症,而不是通过增强M2型相关抗炎介质来引发抑炎作用.Yang等人[16]在小鼠接触性皮炎的治疗中发现龙胆根提取物对包括MCP-1的细胞因子有抑制作用,但我们的研究中滇龙胆提取物对巨噬细胞MCP-1的mRNA表达无明显调控作用,可能与龙胆不同提取方式和研究模型差异有关.
NF-κB信号转导是LPS活化巨噬细胞促炎细胞因子产生中的重要信号通路.用龙胆苦苷处理可显著抑制LPS诱导的IκBα蛋白降解和NF-κB p65的磷酸化,这表明龙胆苦苷抑制NF-κB信号通路活化.Zhang等人[17]的研究也显示龙胆苦苷能调控p65蛋白表达,与我们结果一致.同时我们发现,龙胆苦苷处理可部分抑制LPS诱导的TBK1的磷酸化.在LPS诱导的干扰素产生中,滇龙胆抑制了STING和一型干扰素IFN-β1的表达,但是龙胆苦苷未有相同作用,提示滇龙胆对干扰素的调控作用不是其中的龙胆苦苷起作用,而是其他成分,有待进一步研究.
4 结 论
本研究通过对滇龙胆和龙胆苦苷进行抗炎活性研究,发现它们对LPS诱导的巨噬细胞产生的促炎因子TNF-α、IL-6、IL-1β的表达有明显抑制作用,提示其具有较好抗炎活性.进一步结果显示,龙胆苦苷可抑制LPS诱导的IκBα蛋白降解和NF-κB p65、TBK1的磷酸化,其可通过抑制NF-κB信号通路发挥作用.
