基于核酸适配体杂交链式反应比色法检测鼠伤寒沙门氏菌
2022-01-05孙博陈萍
孙博,陈萍
(吉林农业大学食品科学与工程学院,吉林长春 130118)
鼠伤寒沙门氏菌(Salmonella typhimurium,S.typhimurium)是一种全球性食源性致病菌,可引起腹泻、伤寒、腹部绞痛、恶心、呕吐等多种临床症状,严重者可危及生命[1]。鼠伤寒沙门氏菌主要通过污染食品感染人类,其中牛奶是鼠伤寒沙门氏菌的主要感染源之一[2]。由鼠伤寒沙门氏菌引起的健康和安全事件频繁被报道,对食品安全和公众健康造成严重威胁[3]。因此,开发一种操作简便、高效灵敏的鼠伤寒沙门氏菌的检测方法是食品安全监测的一项紧迫任务。
常见的鼠伤寒沙门氏菌检测方法主要有平板检测法、仪器分析法、免疫学检测方法、分子生物学检测方法等[4-5]。上述方法为现阶段针对鼠伤寒沙门氏菌检测的有效方法,但仍存在不足,为此针对鼠伤寒沙门氏菌更完善、更高效的检测方法仍在持续研究中。
适配体是指通过指数富集的配体系统进化技术筛选获得的寡核苷酸,可以形成凸环、发夹、假节和G-四聚体等结构[6-7]。对特定的金属离子、有机物、蛋白质或细胞等目标分子具有高特异性和亲和力[8]。与抗体相比,适配体具有可体外人工合成和修饰,纯度高、亲和力强、稳定性好、特异性高的特点[9-10],近年来核酸适配体被广泛应用于鼠伤寒沙门氏菌的检测中[11-12]。杂交链式反应是一种核酸信号放大技术,通过单链DNA 引发两个发夹探针生成杂交双链,实现信号放大[13-15]。金纳米粒子(gold nanoparticles,AuNPs)是最常用的纳米材料之一,由于独特的光学性能和良好的生物相容性已广泛应用于比色检测中[16]。近年来国内外研究者对于核酸适配体技术、杂交链式反应、金纳米粒子三者构成的检测方法作出大量研究,例如:田润等[17]以核酸适配体为引发剂,构建基于杂交链式反应的比色检测方法用于检测卡那霉素,检测限低至0.9 nmol/mL;Wang 等[18]建立基于核酸适配体的杂交链式反应,以AuNPs 为比色信号,用于检测Hg+,检测限为30 nmol/mL;Gao 等[19]应用杂交链式反应研制出5’-三磷酸腺苷的AuNPs 比色法适配体传感器,检测限达到10 nmol/mL。由此可知,这三种技术结合的方法检测限低灵敏度高。本研究根据鼠伤寒沙门氏菌核酸适配体设计引发序列以及两个发夹探针,利用杂交链式反应前后链与AuNPs 之间的相互作用,构建一种灵敏度高、操作成本低、高效的鼠伤寒沙门氏菌比色检测方法。
1 材料与方法
1.1 仪器与试剂
UV-1800 紫外可见分光光度计,日本岛津公司;数显恒温磁力搅拌器,金坛市科析仪器有限公司;台式高速冷冻离心机,上海力中科仪器有限公司;KYC-100B 空气恒温振荡仪,CIMO 新苗仪器有限公司;DYY-11 型电泳仪,北京六一仪器厂;IQ350 凝胶成像系统,美国GE 公司。
氯金酸(AuCl3HCl·3H2O)、柠檬酸钠(C6H5Na3O7·2H2O)、氯化钠(NaCl)、Ultra GelRed、TE Buffer(pH=8.0)、50×TAE Buffer(pH=8.5)均购买于北京鼎国药业有限公司;蛋白胨、酵母浸粉、琼脂粉均购买于长春市华益生物科技有限责任公司。本研究设计的寡核苷酸均购自库美生物技术有限公司,并且通过高效液相色谱(HPLC)技术纯化,寡核苷酸的序列如下:Salmonella typhimuriumaptamer(aptamer)[20]:5’-TAT GGC GGC GTC ACC CGA CGG GGA CTT GAC ATT ATG ACA G-3’;Single-stranded DNA(ssDNA):5’-CGG TGA CGC CGC CAT CCG-3’;Hairpin DNA1(Hp1):5’-CGC CGC CAT CCG TGT TGT CGG ATG GCG GCG TCA CCG-3’;Hairpin DNA2(Hp2):5’-ACA ACA CGG ATG GCG GCG CGG TGA CGC CGC CAT CCG-3’
1.2 试验菌株
鼠伤寒沙门氏菌(Salmonella typhimurium,S.typhimurium)ATCC10376、金黄色葡萄球菌(Staphylococcus aureussubsp.aureus,S.aureus)CICC21600、铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)CICC21636、痢疾志贺氏菌(Shigella dysenteriae,S.dysenteriae)CICC23829、大肠埃希氏菌(Escherichiacoli,E.coli)CICC23657、嗜热链球菌(Streptococcus thermophilus,S.thermophilus)CICC20174、福氏志贺氏菌(Shigella flexneri,S.flexneri)CMCC51252 均来自吉林农业大学食品科学与工程学院食品质量与安全实验室保藏菌株。
1.3 AuNPs 的制备
参照文献[19]采用氯金酸还原柠檬酸三钠制备AuNPs。取0.01%的氯金酸溶液100 mL 于250 mL 锥形瓶中,在加热磁力搅拌器上加热至沸腾,然后迅速向沸腾的溶液中滴加1.0%柠檬酸钠溶液4.0 mL;当无色溶液逐渐变为酒红色,继续磁力搅拌加热,保持沸腾状态30 min 停止加热。将得到的AuNPs 室温下冷却,4 ℃冰箱保存备用。
1.4 琼脂糖凝胶电泳
将Hp1、Hp2 在95 ℃下加热10 min 变性处理,然后室温下冷却1 h。取100 nmol/L的Hp1、100 nmol/L的Hp2、100 nmol/L 的Hp1 和100 nmol/L 的Hp2、100 nmol/L 的Hp1 和100 nmol/L 的Hp2 以及50 nmol/L的ssDNA,分别37 ℃震荡孵育45 min。杂交链式反应后用1×TAE 缓冲液制备2%琼脂糖凝胶,110 V 电泳40 min。
1.5 杂交链式反应时间的优化
杂交链式反应是本实验采用的信号放大方法,所以杂交链式反应的时间对检测的灵敏度以及信号放大效率,起到重要作用。杂交链式反应时间短,不利于双链的形成,灵敏度低。因而我们对杂交链式反应的时间进行优化,使检测体系达到最佳状态。在进行检测时,我们分别取时间:20、25、30、35、40、45、50、55、60、65、70 min 分别进行杂交链式反应的反应时间。反应结束后加入AuNPs 室温下孵育后,0.75 mol/L NaNO3作用下,静置5 min,测定体系在400~800 nm 波长下吸光度。根据吸光度比值,确定杂交链式反应的最佳反应时间。
1.6 Hp1/Hp2与AuNPs 反应时间
Hp1/Hp2与AuNPs 反应达到动态平衡时间是比色体系的关键。我们采用10、20、30、40、50、60、70 min 不同时间进行Hp1/Hp2与AuNPs 孵育反应。反应结束后将加入0.75 mol/L NaNO3溶液,静置5 min,测定体系在400 nm~800 nm 波长下吸光度,根据吸光度比值选出最佳孵育时间。
1.7 Hp1/Hp2 的浓度
杂交链式反应中Hp1、Hp2 的浓度同样会影响反应的灵敏度,取Hp1/Hp2 浓度为60、70、80、90、100、110、120 nmol/L 分别进行杂交链式反应,37 ℃孵育45 min;反应结束后加入70 μL AuNPs 室温下孵育50 min。最后加入0.75 mol/L NaNO3溶液,静置5 min,测定体系在400 nm~800 nm 波长下吸光度,根据吸光度比值选出最适浓度。
1.8 基于核酸适配体和杂交链式反应比色方法建立
取不同浓度的鼠伤寒沙门氏菌分别加入50 nmol/L aptamer,37 ℃恒温孵育10 min,向溶液中加入浓度为50 nmol/L 的ssDNA,37 ℃恒温震荡30 min。加入100 nmol/L 的Hp1/Hp2 各10 μL 进行杂交链式反应,37 ℃孵育45 min;反应结束后加入70 μL AuNPs室温下孵育50 min。最后加入0.75 mol/L NaNO3溶液,静置5 min,测定体系在400 nm~800 nm 波长下吸光度。
1.9 人工污染牛奶样品检测
从牛奶样品中取检样25 g(mL),加入225 mL 缓冲蛋白胨水于均质袋内进行均质,均质后于36±1 ℃培养12 h。分别取900 μL 样品分别添加100 μL 鼠伤寒沙门氏菌(浓度为2.74×103、3.01×104、3.24×105、2.65×106、2.98×107CFU/mL),用基于核酸适配体结合杂交链式反应体系进行检测,结果与平板计数法对比,计算加标回收率。
1.10 数据处理与分析
实验数据采用Oringin 2018和IBS SPSS 24.0软件进行统计分析。ANOVA 进行方差分析,Duncan 进行显著性分析。
2 结果与讨论
2.1 比色法原理
单链DNA 由于其暴露的含氮碱基带有正电,通过分子之间静电吸附在带有负电的AuNPs 表面,单链DNA 可以保护AuNPs 在盐诱导下不发生聚集。双链DNA 和核酸适配体具有更高级的结构,很难与AuNPs发生吸附作用。因此根据鼠伤寒沙门氏菌特异性核酸适配体(aptamer)序列利用NUPACK 分析设计引发序列(ssDNA)和单链Hp1、Hp2。在鼠伤寒沙门氏菌存在下,aptamer与鼠伤寒沙门氏菌特异性结合后,在体系中加入ssDNA 引发Hp1、Hp2 打开发夹结构,发生杂交链式反应,形成带负电的双螺旋长链DNA,与溶液中负电AuNPs 相互排斥。Hp1、Hp2 不再保护AuNPs,盐的诱导作用下,溶液颜色由红色变为蓝色。当溶液中不存在鼠伤寒沙门氏菌时,aptamer与ssDNA杂交,ssDNA 不在引发Hp1、Hp2 打开发夹发生杂交链式反应,因此Hp1、Hp2与带负电的AuNPs 静电吸附,在盐作用下保护AuNPs 不发生聚集,颜色不发生变化。基于适配体的杂交链式反应比色法检测鼠伤寒沙门氏菌的原理如图1 所示。

图1 基于适配体的杂交链式反应比色法检测鼠伤寒沙门氏菌的原理图Fig.1 Schematic illustration of colorimetric assay for S.typhimurium detection based on aptamer and hybrid chain reaction
2.2 柠檬酸三钠还原法制备AuNPs
由AuNPs 在400~800 nm 的紫外-可见光谱(图2)可知:AuNPs 在约为525 nm 处有明显的紫外吸收峰,根据文献[21-23]中可知胶体金的最大吸收峰波长与平均粒径具有良好的线性相关性,线性关系回归方程为Y=0.4271X+514.56,其中X 为纳米金平均粒径、Y 为最大吸收峰波长。根据AuNPs 最大吸收峰波长525 nm计算得出平均粒径为24.4 nm。

图2 AuNPs 的紫外-可见光表征图Fig.2 UV absorption spectrum of colloidal gold particles
2.3 凝胶电泳实验
琼脂糖凝胶电泳用来验证杂交链式反应中Hp1、Hp2 可以在ssDNA 引发下形成的杂交长螺旋。由图3所示,泳道1 是分子量50~500 的Marker;泳道2 是100 nmol/L 的Hp1 和100 nmol/L 的Hp2 以及50 nmol/L 的ssDNA;泳道3 是100 nmol/L 的Hp1/Hp2;泳道4 和5 分别是100 nmol/L 的Hp2 和100 nmol/L的Hp1。由图2 可知:只有Hp1/Hp2 存在时不发生杂交链式反应,当加入ssDNA 到Hp1 和Hp2 中,发生杂交链式反应。由此说明ssDNA 可以成功引发Hp1、Hp2 发生杂交链式反应。
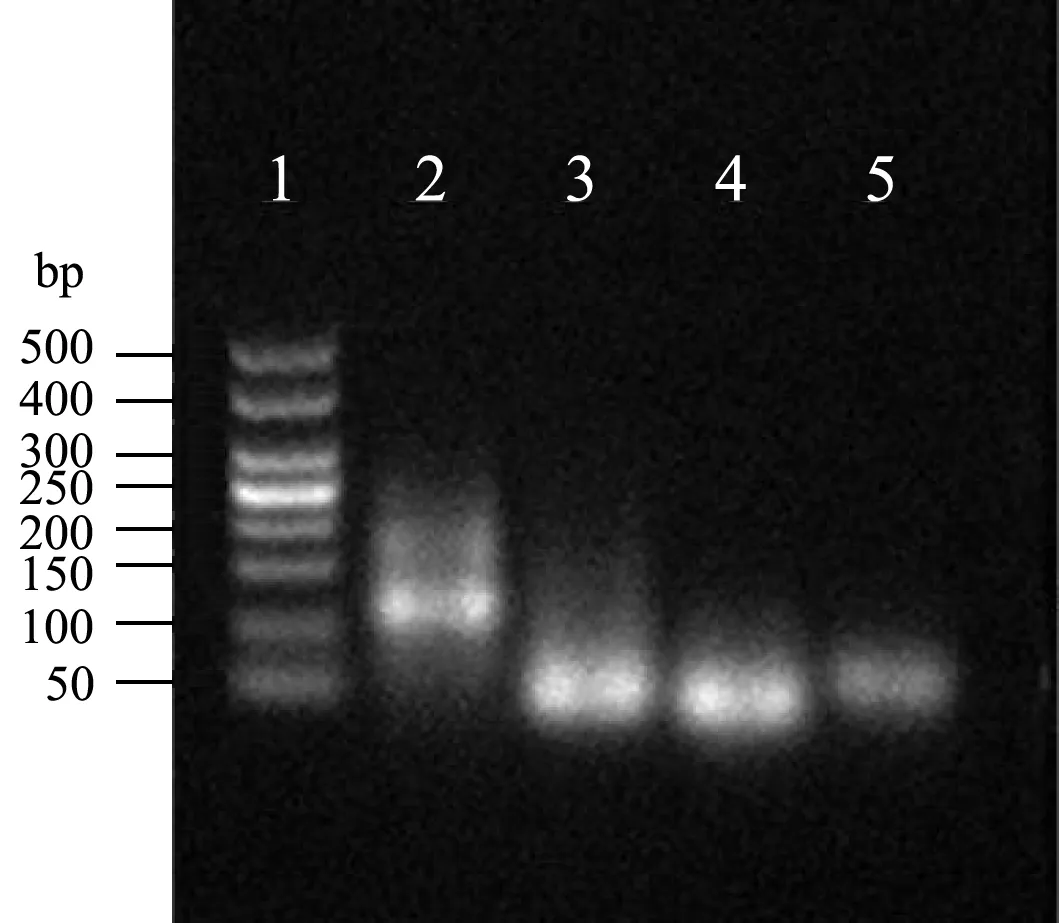
图3 凝胶电泳实验Fig.3 Gel electrophoresis experiment
2.4 基于核酸适配体杂交链式反应体系验证
为验证研究建立的比色方法将0 CFU/mL与107CFU/mL 浓度的鼠伤寒沙门氏菌加入体系中,经过杂交链式反应后,在进行纳米金比色。由图4 可知:当不存在鼠伤寒沙门氏菌时,溶液颜色为红色,在紫外可见吸收光谱中,525 nm 处形成特征峰;当存在鼠伤寒沙门氏菌时,溶液颜色变为蓝色,在630 nm 处出现新的特征峰,并且在525 nm 处的特征峰下降。由此表明:鼠伤寒沙门氏菌可以使体系的颜色以及吸光度发生改变。

图4 基于核酸适配体杂交链式反应结合纳米金比色检测鼠伤寒沙门氏菌Fig.4 Absorption spectra and photographs of AuNPs based on aptamer and hybrid chain reaction colorimetric in S.typhimurium
2.5 杂交链式反应时间的优化
杂交链式反应的反应时间直接影响了体系的信号。如图5 所示,A630/525 值随着孵育时间的增长而增大,当杂交链式反应时间达到45 min 后,A630/525值不在增加。说明杂交链式反应时间在45 min 左右,杂交链式反应几乎达到饱和状态。因此,杂交链式反应最佳反应时间为45 min。

图5 杂交链式反应时间优化Fig.5 Optimization of HCR hybridization time
2.6 Hp1/Hp2与AuNPs 反应时间
Hp1/Hp2与AuNPs 的结合时间对体系的信号也存在影响,如图6 所示,A630/525 值随着孵育时间的增长而增加,当Hp1/Hp2与AuNPs 的结合时间达到50 min 后,A630/525 值不再增加。因此,Hp1/Hp2与AuNPs 最佳反应时间为50 min。

图6 Hp1/Hp2与AuNPs 反应时间优化Fig.6 Optimization ofHp1/Hp2-AuNPsincubation binding time
2.7 Hp1/Hp2 的浓度
Hp1/Hp2 是杂交链式反应的重要组成部分,在AuNPs 聚集过程中起着至关重要的作用。如图7 所示,A630/525 值随着Hp1/Hp2 的浓度的增加而增大,但当Hp1/Hp2 浓度大于100 nmol/L 时,体系的A630/525值最大。当Hp1/Hp2 的浓度继续增大,A630/525 值降低。因此,选择100 nmol/L 的Hp1/Hp2 作为体系的最佳浓度。

图7 Hp1/Hp2 的浓度优化Fig.7 Optimization of Hp1/Hp2 concentration
2.8 鼠伤寒沙门氏菌测定的标准曲线
在最佳条件下,采用适配体结合杂交链式反应以及AuNPs 比色法检测鼠伤寒沙门氏菌。图8a 给出了基于核酸适配体杂交链式反应以及纳米金比色体系对不同浓度的鼠伤寒沙门氏菌的紫外可见吸收光谱。吸光度A630/525 值与鼠伤寒沙门氏菌浓度在103~107CFU/mL 范围内可以达到良好的线性关系(图8b)。线性方程为Y=0.18636 LgX-0.12807(R2=0.9933),检测限为6.3×101CFU/mL。

图8 (a)不同浓度的鼠伤寒沙门氏菌紫外可见吸收光谱、(b)鼠伤寒沙门氏菌浓度与吸光度比(A630/525)关系曲线图Fig.8 (a) UV vis absorption spectra for colorimetric assay toward S.typhimuriumwith different concentrations;(b)Linear calibration curve of the degree of absorbance ratio(A630/525) versus S.typhimurium concentration concentration
2.9 比色法对鼠伤寒沙门氏菌检测的特异性
选用S.aureus、P.aeruginosa、S.dysenteriae、E.coli、S.thermophilus、S.flexneri几种菌作为对照组,检验本方法的特异性。实验结果如图9 所示:只有鼠伤寒沙门氏菌实验出现颜色变化,并且具有显著的高吸光度比(A630/525);对照组存在的情况下,体系的颜色在相同的条件下依然是红色,吸光度比无显著变化。结果表明本方法具有特异性。
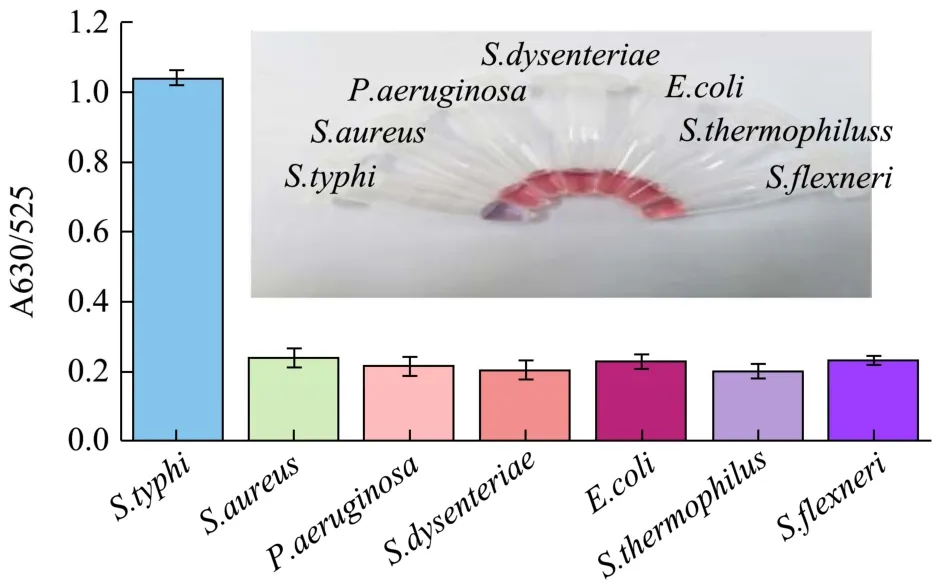
图9 不同菌存在下AuNPs 溶液的吸收比(A630/525)Fig.9 The absorption ratio (A630/525) of AuNPs solution in the presence of different strains
2.10 人工污染牛奶中的鼠伤寒沙门氏菌检测
采用本方法检测人工污染牛奶样品中的鼠伤寒沙门氏菌并且与平板检测方法对比。结果见表1:加标回收率在90.05%~109.97%之间,与平板计数法相比,结果没有显著差异性,表明本方法灵敏度较高,准确性较好,可用于牛奶中鼠伤寒沙门氏菌的检测。

表1 人工污染牛奶中检测结果Table 1 Test results of artifically infected milk samples
3 结论
本研究建立了基于鼠伤寒沙门氏菌核酸适配体的杂交链式反应比色检测方法。在优化条件下比色法检测鼠伤寒沙门氏菌的最低检测限为 6.3×101CFU/mL,线性范围为103~107CFU/mL,R2=0.9933,在人工污染牛奶中加标回收率为90.05%~109.97%。本研究通过杂交链式反应实现信号放大,反应不需要酶的参与,不需要变温调控,操作简单,利用紫外光谱定量分析,也可以肉眼直接判断实验结果,建立一种快捷有效的鼠伤寒沙门氏菌检测方法。
