胆道系统恶性肿瘤免疫治疗的研究进展及展望①
2022-01-05甄自力沈哲民孙培龙
甄自力 沈哲民 孙培龙
(复旦大学附属金山医院普外科,上海201508)
胆道系统恶性肿瘤(biliary tract cancers,BTC)是起源于胆管上皮细胞的恶性肿瘤,可发生于肝内胆管、肝外胆管等不同部位,主要包括肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)和胆管癌(cholangiocarcinoma,CCA)。其中,ICC 是仅次于肝细胞性肝癌的第二大原发性肝癌,发病率约占原发性肝癌的10%~15%,近年来发病率不断上升,ICC起病隐匿,发病时已处于晚期,因此其恶性程度及死亡率较高,但由于近年医疗水平的提高,对ICC的治疗效果有了一定的改善[1-2]。治愈BTC 的主要治疗方式是完全切除肿瘤或进行肝移植,但即使采取这些积极干预的方法复发率仍高达50%[3]。同时,绝大多数BTC 患者在明确诊断时已进入晚期阶段而无法进行手术干预,未经治疗的中位生存期为3~6 个月,五年生存率为5%~10%[4]。在现行的诊疗标准下,这些晚期患者在接受最佳治疗方案后中位生存期仍小于1年[5]。因此,探寻能够针对BTC 有效的新的治疗方法至关重要。
近年来,恶性肿瘤免疫治疗是肿瘤治疗领域的一个重大突破,并且已被证明可通过诱导自身免疫系统攻击肿瘤细胞,达到有效治疗耐药性实体恶性肿瘤(如非小细胞肺癌、黑色素瘤等)的效果[6]。作为炎症相关性肿瘤,BTC 的免疫抑制微环境能够通过多种机制促进免疫耐受和免疫逃避,但许多研究表明免疫治疗仍存在成功治疗的机会[7]。因此,诱发更加强烈的特异性免疫应答是针对BTC 的一种有效的治疗策略。本综述将回顾免疫检查点阻断、肿瘤疫苗和过继性T细胞转移等BTC免疫学治疗的最新进展,并讨论BTC 免疫疗法的潜在进展及挑战。
1 恶性肿瘤的细胞免疫反应
正常人体的免疫反应可以保护机体免受肿瘤或外来病原体的侵害,同时维持自身适度的免疫耐受防止发生自身免疫性疾病,其中,免疫反应包括固有免疫反应和适应性免疫反应。先天性免疫反应在病原体侵入机体后数分钟到数小时内迅速发生防御反应,主要效应细胞包括自然杀伤细胞(natural killer cell,NK cell)、粒细胞、吞噬细胞等。特异性适应性免疫应答主要是通过树突状细胞(dendritic cell,DC)提呈抗原,从而刺激T 细胞成熟并募集其对肿瘤细胞或外来病原体进行靶向破坏,同时形成免疫记忆(图1)。
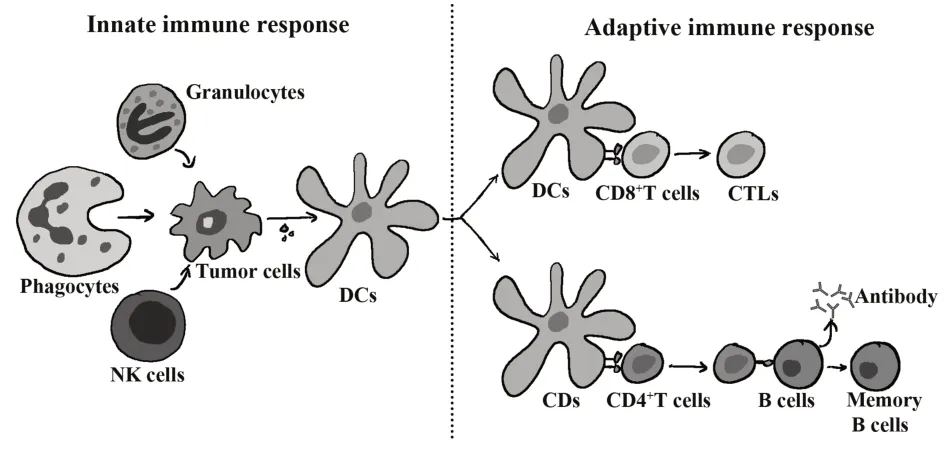
图1 固有免疫反应和适应性免疫反应Fig.1 Innate immune response and adaptive immune response
在某些恶性肿瘤发生过程中,免疫系统可识别出其由于基因表达异常所产生的肿瘤抗原,在早期将肿瘤细胞清除从而抑制疾病发展。然而,具有免疫抑制或免疫逃逸特性的BTC 等恶性肿瘤可通过积累免疫抑制细胞群、呈递有缺陷的抗原、激活抑制性受体-配体通路等机制促进其发生发展[8]。此外,BTC 及其周围的细胞因子、胞外基质、免疫细胞等构成一个具有复杂功能网络的免疫微环境,通过分泌细胞因子或信号传导抑制该部位免疫反应,从而达到驱动免疫逃逸的作用[9]。
2 免疫检查点阻断
免疫检查点是一类细胞膜表面的特定受体,细胞间受体相互作用可抑制免疫反应,而阻断免疫检查点能够使免疫细胞得到激活,增强抗肿瘤免疫反应,可作为恶性肿瘤免疫逃逸的关键调节位点。其中,程序性死亡受体1(programmed cell death-1,PD-1)及其配体(programmed cell death ligand-1,PD-L1)、细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)、淋巴细胞激活基因3(lymphocyte activation gene 3,LAG-3)和T 细胞免疫球蛋白黏蛋白3(T-cell immunoglobulin mucin,TIM-3)等免疫检查点在BTC 免疫治疗中发挥重要作用(图2)。

图2 免疫检查点阻断作用机制Fig.2 Mechanism of immune checkpoint blockade
2.1 PD-1/PD-L1 PD-1 是一种表达于活化的CD4+T细胞、CD8+T细胞、B细胞和NK 细胞上的一种免疫球蛋白超家族抑制分子,在维持免疫耐受和抑制T细胞的细胞毒性中发挥重要作用,PD-1与PD-L1结合可抑制T 细胞的活化并导致其凋亡,在免疫应答中发挥负性调控作用[10]。此外,PD-L1 不仅可以在CCA 肿瘤细胞表达,还出现在肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)细胞膜表面,肿瘤细胞与TAM 上的PD-L1 同时与CD8+T 细胞上的PD-1 结合进一步促进了CD8+T 细胞凋亡和免疫逃逸反应,为肿瘤的进一步生长铺平了道路[11]。BTC 患者体内PD-1+CD8+T 细胞表达量增加不仅预示着肿瘤细胞具有更强的侵略性,也表明患者生存率较低、预后较差。
对ICC 组织免疫组化染色发现,PD-1/PD-L1 可在肿瘤细胞和炎症细胞聚集物中表达。此外,PD-1/PD-L1上调的肿瘤通常与预后较差的不良事件发生相关,表明这些肿瘤可能是成为检查点阻断剂进行治疗的靶点。有研究表明,在ICC 切除样本中有72% 的肿瘤细胞样本表达PD-L1,与PD-L1 阴性相比较,阳性患者的总生存时间明显降低。尽管单独的PD-1 或PD-L1 表达与临床结局无关,但与PD-L1高表达或HLA Ⅰ类抗原低表达的患者相比,低表达的PD-L1 和高表达HLA Ⅰ类抗原的患者总生存时间更长[12]。这些研究为研究BTC 的PD-1/PD-L1 表达对预后的影响提供了理论依据,也为将来评估BTC的检查点抑制疗法的实用性奠定了基础。
在临床方面,一项针对BTC 晚期患者应用PD-L1 抑制剂治疗的临床研究表明,检查点抑制剂治疗耐受性良好,具有较好的抗肿瘤活性,总体缓解率为17.4%[13]。此外,BTC 中一部分人群是由于错配修复缺陷而导致肿瘤发生,而作为PD-1抑制剂的派姆单抗(Pembrolizumab)能够对错配修复缺陷肿瘤有持久的反应,这为错配修复缺陷致BTC 提供了新的治疗思路[14]。目前,多项Ⅰ期和Ⅱ期临床试验正在评估联合检查点抑制剂疗法对晚期BTC 的影响,在很大程度上有助提高BTC的治疗效果。
2.2 CTLA-4 CTLA-4是一种表达在活化T细胞上的抑制受体,主要存在于调节性T细胞,其竞争性结合抗原呈递细胞(antigen-presenting cells,APC)上CD28 的配体CD80 和CD86。CTLA-4 抑制剂使得其无法竞争性抑制APC 和T 细胞结合,导致免疫反应可以正常进行。CTLA-4 被证明在多种肿瘤中具有抑制肿瘤相关性抗原(tumor associated antigen,TAA)的识别和细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)的增殖的效应[15]。
有研究表明,CCA 患者体内CLTA-4 表达水平与肿瘤浸润淋巴细胞数量呈负相关,低表达CLTA-4与总生存时间延长以及无瘤生存密切相关[16]。这证明了CTLA-4 的表达对BTC 患者预后具有显著影响。
靶向CTLA-4 的抗体的许多临床试验正在进行中。CTLA-4 抗体替西木单抗(Tremelimumab)应用于CCA 患者的临床试验表明其抗肿瘤效果明显,同时未发生免疫相关的不良事件,接受CTLA-4 抗体治疗患者的中位生存时间和总生存时间均高于未接受者,同时6 周后活检发现肿瘤浸润CD8+T 细胞明显增加,提示该方法有持久的抗肿瘤免疫反应。
3.3 LAG-3和TIM-3 LAG-3是免疫球蛋白超家族蛋白中的成员,通常能够与Ⅱ类MHC分子高亲和力结合,从而抑制T细胞的共刺激作用[17]。临床上,正在Ⅰ期试验(NCT01968109)中测试抗PD-1 联合LAG-3对免疫检查点的双重阻断。
TIM-3 是一种表达在分泌IFN-γ 的辅助性T 细胞,NK 细胞和CTL 上的跨膜蛋白可与可溶性配体galectin-9 相互作用,从而负性调控T 细胞反应抑制肿瘤免疫应答[18]。在慢性HBV 感染患者体内T 细胞浸润伴随TIM-3 表达增加,且TIM-3/galectin-9 途径表面的存在HBV相关BTC患者预后较差[19]。
3 肿瘤疫苗
随着越来越多的TAA 得到明确,针对肿瘤的疫苗也得到广泛关注与研究。通过使用全细胞疫苗、抗原特异性肽疫苗或搭载抗原的树突状细胞疫苗,机体免疫系统识别肿瘤特异性抗原并对其敏感性升高,使得机体可以快速产生适应性免疫应答以识别和消除肿瘤细胞。
在BTC 相关性抗原中,Wilm 肿瘤蛋白1(Wilm's tumor protein 1,WT1)和黏蛋白1(mucin protein 1,MUC1)受到了密切关注[20]。多种恶性肿瘤中可以检测到WT1 和MUC1 突变,该突变与预后不良和药物耐受性密切相关。研究表明,80%BTC 患者体内出现WT1 突变,90%BTC 患者体内MUC1 过表达,并认为与中位生存期缩短显著相关[21-22]。
一项药物临床研究中,8 名BTC 患者应用WT1肽疫苗联合吉西他滨(Gemcitabine)治疗,这8 例患者耐受良好且未出现剂量毒性反应。疫苗接种后,观察到50% 的BTC 患者出现2 个月的病情稳定期,且总生存时间达到288 d,65% 患者体内可检测到WT1特异性T细胞[23]。另一项药物临床研究中,8例BTC 患者应用MUC1 肽疫苗治疗,由抗MUC1 抗体介导了特异性肿瘤免疫反应,结果显示患者均耐受良好,但其中7例患者病情仍处于进展期[24]。此外,有研究表明,应用5-氟尿嘧啶、Gemcitabine 或IFN-γ治疗可增加ICC 细胞中WT1 和MUC1 抗原的表达,该结果为肿瘤免疫的联合疗法提供了依据[25]。
除了针对WT1 和MCU1 抗原的肿瘤免疫疫苗研究,多个肽抗原联合的疫苗也逐渐在BTC 中受到关注。对9例无法手术的晚期BTC 患者进行淋巴细胞抗原6 复杂基因位点K、TTK 蛋白激酶、胰岛素样生长因子ⅡmRNA结合蛋白3和含DEP结构域的蛋白质1 的四肽疫苗治疗,其中78% 的患者观察到特异性T 细胞应答,除了在接种部位皮肤出现二型超敏反应外,无进展生存期和中位生存时间也显著延长[26]。此外,该研究团队进行了细胞分裂周期相关蛋白1、钙黏蛋白3和驱动蛋白家族成员20A 三肽联合的肿瘤疫苗免疫治疗,参与治疗的9 例患者均出现特异性T 细胞应答,5 例患者疾病出现稳定期,但总生存时间仅9.7个月[27]。虽然接受肿瘤疫苗治疗的患者中位生存期无根本性的改变,但特异性T 细胞应答反应预示着肿瘤疫苗的有效性。
应用搭载抗原的树突细胞疫苗同样可以激活、上调T 细胞反应(图3)。DC 作为最重要的APC,在激活幼稚T细胞和调节初次免疫反应中发挥关键作用,同时诱导产生抗肿瘤T 细胞免疫反应。将WT1和MUC1 抗原搭载于树状细胞疫苗用于治疗65 例无法手术或复发的BTC 患者,其中发热患者的总生存时间明显改善,提示免疫应答有益于患者预后[28]。

图3 搭载抗原的树突细胞抗肿瘤疫苗作用机制Fig.3 Mechanism of anti-tumor vaccine of dendritic cells carrying antigen
4 过继T细胞转移
过继T细胞转移免疫治疗即通过输注患者自身的肿瘤浸润淋巴细胞增加肿瘤特异性免疫反应和肿瘤内T细胞浸润。与肿瘤疫苗诱导的免疫应答相比,过继T 细胞转移增加了肿瘤微环境中活化的CTL细胞的数量,从而形成更强的肿瘤免疫应答。
许多案例证明了过继T细胞转移治疗对BTC的有效性。有病例报道了1例CCA广泛转移的患者在进行自身特异性反应性T细胞扩增并转移后出现长达7 个月的无瘤生存[29]。表明过继T 细胞转移治疗的可行性,作为ICC术后的辅助治疗方法,36例患者纳入了前瞻性临床试验进行活化的T 细胞转移,同时应用搭载抗原的树突细胞疫苗,接受辅助免疫治疗的患者中位生存时间达到18.3个月,总生存时间31.9个月,而未接受者中位生存时间位7.7个月,总生存时间为17.4 个月[30]。表明应用过继T 细胞转移治疗明显有益于BTC 患者预后并能够显著延长生存期。
5 结语及展望
BTC作为胆道系统肿瘤,起病隐匿,发病时往往已经到达晚期,现有的干预手段无法满足对预后的基本要求,迫切需要研究新的有效干预手段以提升患者总生存时间。肿瘤免疫治疗是近年来肿瘤治疗领域的一个重大突破,能够通过诱导自身免疫系统攻击肿瘤细胞达到有效治疗的效果。因此,应用免疫检查点阻断、肿瘤疫苗和过继性T 细胞转移等方法可以促进肿瘤免疫反应,对BTC 进行积极干预,并有效改善患者预后。
虽然目前针对BTC 免疫疗法的研究甚少,但仍有证据表明这种方法将成为未来医生应对BTC 的有力工具。进一步研究证明其具有显著的临床功效以及优化治疗方案是当务之急,同时也应该聚焦于寻找新的靶点以及联合疗法。对于所有晚期BTC患者应用同一种免疫疗法的可行性极低,应根据不同患者选择特定的靶向治疗,比如,对于某一亚群患者使用效力较高的某种方法,抑或是在多肽联合疫苗使用中做到精准靶向治疗。同时,探寻更多的TAA 将有利于为后续个体化治疗提供更加详尽而准确的指导。