LC3相关吞噬作用与动脉粥样硬化①
2022-01-05王建茹朱明军
王建茹 朱明军
(河南中医药大学第一附属医院,郑州450000)
动脉粥样硬化(atherosclerosis,AS)是一种免疫系统参与的慢性炎症性疾病,其发病机制尚未完全阐明,研究者提出了不同的学说从不同的角度对其病理过程进行阐述[1-2]。巨噬细胞、单核细胞等多类细胞均在一定程度上介导AS的发生和发展,其中巨噬细胞在AS 病理过程中的致病作用一直是研究的热点和重点。巨噬细胞不能及时清除凋亡细胞(apoptotic cells,ACs),导致斑块内ACs聚集,促炎因子大量释放,进而诱发继发性坏死核形成,因此,巨噬细胞清除ACs功能障碍是不稳定性斑块形成和进展的重要病理环节[3]。2007年,SANJUAN 等[4]在巨噬细胞吞噬LPS包裹的颗粒、酵母多糖、大肠埃希氏菌的过程中首次发现了LC3 相关吞噬作用(LC3-associated phagocytosis,LAP)的现象。LAP 是近年来发现的巨噬细胞新的吞噬形式,可通过高效清除ACs、病原体等,介导包括AS 在内的多种自身免疫性、炎症性疾病的病理过程[5-6]。本文重点对LAP 的相关研究进展及其与AS的关系进行综述,旨在为防治AS相关心脑血管疾病提供新的理论依据。
1 LAP的概述
1.1 LAP 的特征 吞噬和自噬是2 个古老、保守的过程,分别涉及溶酶体介导的胞外和胞内物质的降解和清除,他们对细胞摄取营养物质,维持机体的稳态十分重要。吞噬是指吞噬细胞通过受体依赖的形式识别并内吞微生物、ACs等胞外物质,形成吞噬泡然后再与溶酶体融合,消化并降解内吞物的过程[7]。自噬是真核细胞通过溶酶体途径降解胞内蛋白和受损细胞器等物质的过程,该过程以LC3 标记的双层膜结构的自噬泡为主要特征[8]。LAP 的过程为吞噬细胞通过模式识别受体将胞外“cargo”吞噬后,募集自噬相关蛋白形成单层膜结构的吞噬体,最终将内吞物高效降解[9],该过程以形成LC3-Ⅱ修饰的单层膜结构的吞噬体(LAP 小体)为特征(见图1)[10]。
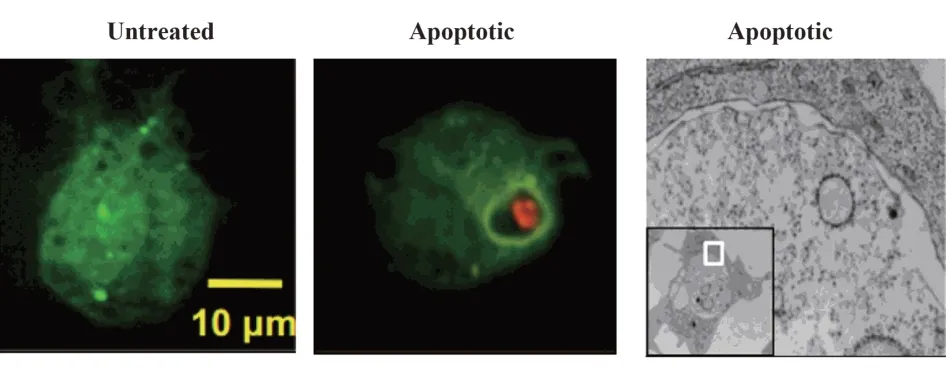
图1 巨噬细胞LAP小体[10]Fig.1 LAP vesicles of macrophages[10]Note:Green.Macrophages with GFP-LCS;Red.Apoptotic cells.
1.2 LAP的过程 LAP作为一种非经典自噬,是吞噬细胞自噬和吞噬作用的桥梁,其过程大致可分为以下几个阶段(见图2)[11-12]。①LAP 的启动:病原微生物、免疫复合物、ACs等多种胞外“cargo”被吞噬细胞表面的模式识别受体识别后启动LAP,这些受体包括TLRs、c 型凝集素Dectin-1、FcR、PtdSer-R(主要为TIM4),这些受体功能障碍可能会导致LAP受损。②单层膜吞噬体的形成:吞噬细胞胞内级联信号被激活,细胞骨架重组,胞膜向细胞内凹陷形成吞噬杯,然后吞噬杯封闭将胞外“cargo”包裹在内,形成单层膜结构的吞噬体。③LAP 小体的形成:单层膜吞噬体形成LAP 小体的过程需要膜修饰和ROS 的产 生。 由class ⅢPI3K 复 合 物(包 括VPS15、VPS34、Beclin-1、UVRAG、Rubicon)产生的PI3P 迅速向单膜吞噬体膜募集(PI3P 修饰)。然后PI3P 与p40phox 亚型结合,活化NOX2 复合物[该复合物由胞质源的NOX2 成分(p47phox、p40phox、p67phox、Rac1)和吞噬体源的NOX2 成分(NOX2、p22phox)组成],进而诱发ROS 的释放;p22phox 亚型与Rubicon直接结合可起到稳定NOX2复合物的作用。PI3P和ROS 能活化自噬机制中的ATG12-ATG5-ATG16L1和LC3-PE 共轭体系,诱导LC3-Ⅱ向单层膜吞噬体募集(LC3-Ⅱ修饰),形成LC3+吞噬体即LAP 小体。上述的分子机制中的相关成员功能受损会影响LAP的整个过程。④内吞物的降解:LAP 小体迅速与溶酶体融合,促进吞噬溶酶体的成熟,加速水解酶等降解内吞物,完成整个处理过程。
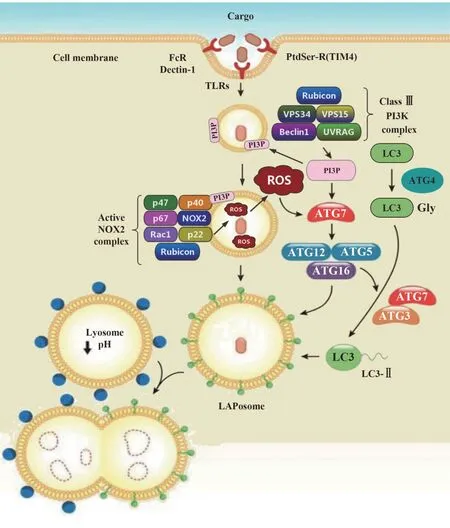
图2 LC3相关吞噬作用(LAP)过程概述[11]Fig.2 Overview of LC3-associated phagocytosis(LAP)process[11]
1.3 LAP 的功能 LAP 的目标是将胞外“cargo”降解,而LAP后的最终结果在很大程度上取决于“cargo”。经病原微生物活化的LAP 有利于MHC-Ⅱ类分子抗原递呈,可增强吞噬细胞清除病原微生物的能力,提高适应性免疫[13]。体内ACs 与TIM4 结合诱导的LAP 可促进吞噬细胞及时高效清除ACs,并限制促炎因子IL-1β、IL-6 的释放,促进抗炎因子IL-10、TGF-β 的释放,进而抑制炎症反应[10]。FcR 识别体内循环免疫复合物激活的LAP 能诱导免疫细胞分泌大量IFN-α,介导自身免疫[12]。LAP 在免疫反应过程中促成了不同的结果,参与了多种自身免疫性、炎症性疾病的病理过程[5-6,14]。
2 LAP在AS病理过程中可能的作用机制
AS 是一个慢性血管炎症性自身免疫性疾病,LAP 可能通过清除病原微生物、清除ACs、抑制炎症、调控免疫等多种效应途径介导了AS 的病理过程。流行病学、病理学以及动物模型研究显示,病原微生物感染在AS 及其并发症中起重要作用[15-17]。LAP 可及时高效吞噬和降解宿主细胞内的病原体,在清除病原微生物感染过程中发挥重要作用[13]。研究报道,流感病毒参与了AS 的病理过程,流感病毒可通过ATG16L1 的WD40 区域,活化LAP 从而被及时杀灭[13,15,18]。ACs 清除障碍所激活的自身免疫反应是系统性红斑狼疮和AS 的共同致病机制,LAP缺陷导致的ACs积聚及炎症因子的释放介导了系统性红斑狼疮的病理过程[19-20]。以上研究显示,LAP缺陷可加剧AS的病变程度及其相关疾病进展。
AS 初期,脂蛋白沉积于血管内皮下,经过氧化后,产生大量的促AS细胞因子,并募集炎症细胞(如中性粒细胞、单核细胞等)向血管壁迁移,导致血管壁出现大量的促AS 细胞浸润[21-27]。巨噬细胞、平滑肌细胞等吞噬沉积在血管壁的脂质后,形成泡沫化细胞,同时,这些泡沫细胞又可分泌细胞外基质加剧脂蛋白在内皮下的滞留和促炎细胞因子的释放[22-27]。AS 病变处存在大量免疫细胞,巨噬细胞是这些免疫细胞中重要的组成部分。巨噬细胞LAP作为一个潜在的血管炎症调节器,以免疫沉默的形式,在清除修饰的脂质和脂蛋白方面发挥着重要作用[5]。
AS 进展期,炎症环境、脂质负载等因素致使AS病变处许多病变细胞发生凋亡,同时,LAP、胞葬作用、吞噬作用等功能障碍,导致大量ACs和细胞碎片集聚,继而形成坏死核,并释放大量促炎因子,推动AS的病理进展[22-28]。晚期阶段,AS以血管壁存在大量ACs 聚集、大的坏死核、薄的斑块纤维帽、斑块破裂等为特征,巨噬细胞LAP 缺陷可能与晚期AS 有关[29]。特异性敲除巨噬细胞Atg5 后,晚期AS 模型小鼠的病变程度进一步加剧,病变处ACs大量集聚,坏死核面积扩大,大量炎性因子释放以及炎症小体活化;炎症环境可促使周围巨噬细胞分泌基质金属蛋白酶,使纤维帽变薄易破溃,进而诱发急性血栓栓塞事件[29-30]。这些研究表明,LAP 相关信号分子的功能障碍可损伤LAP,导致AS 病变处ACs 积聚、炎症因子释放,从而促进AS的病理进程。
3 总结
AS是导致包括心、脑血管疾病在内的多种血管疾病的重要病理基础[2]。针对AS 不同阶段的病理机制,现代医学家提出了相应的治疗方案和措施如血运重建、他汀药物治疗等,然而,由AS导致的心脑血管病的患病率及死亡率仍不断上升而且呈年轻化趋势。因此,积极探究AS 的发病病理机制,发掘新的干预靶点并开发新的防治措施,具有十分重要的临床和社会意义。本文结果提示,增强LAP 功能是有效干预AS 进展、减少AS 相关性疾病诱导的不良血管事件发生的可能潜在性靶点。然而,现阶段关于LAP 功能障碍参与AS 病理过程的相关研究尚存在诸多不足和盲点,需要进一步证实,比如LAP可调控细胞代谢重编程、胰岛素抵抗等,还与巨噬细胞极化、自噬等表型存在一定的相关性,它们在AS 病理过程中是否存在协同或拮抗作用尚需进一步探索。另外,LAP是一个相对较新的研究领域,尚有诸多问题需要探究,比如是否有其他分子参与LAP 过程;LAP 的相关研究结果大都仅停留在基础实验的层面,是否能应用到人类等等。总之,LAP在AS病理过程中的作用机制研究仍面临诸多挑战,深入的探索研究将会为进一步阐释AS 的病理机制及其治疗措施带来新的曙光。