河南省某一淡水养殖环节中非O1/O139群霍乱弧菌毒力基因及分子分型分析
2022-01-05炊慧霞吴玲玲贾松树韩志伟
炊慧霞,陈 磊,吴玲玲,贾松树,韩志伟
非O1/O139群霍乱弧菌是指除O1群和O139群以外的霍乱弧菌血清群,呈世界性分布,广泛存在于自然界中,在污水、海水、河水等水体,海产品、动物和人群中均能检出,已成为一个公共卫生问题[1]。近年来国内外关于非O1/O139群霍乱弧菌致病的报道逐渐增多,在国内非O1/O139群霍乱弧菌是引起夏、秋季腹泻和食物中毒的主要病原菌,是重要的食源性致病菌[2-6]。
在河南省境内,根据河南省地区食品安全风险监测结果显示[7],河南省淡水养殖环节致病性弧菌监测的312份样品(淡水鱼、养殖水体和淤泥)中检出81株霍乱弧菌,其中非O1/O139群73株,占90.12%,检出率颇高,由其引起的食品安全隐患不容忽视。为进一步了解其毒力基因分布及分子分型情况,为食品安全风险评估及防控提供数据支持,进行如下研究。
1 材料与方法
1.1 菌株来源 选择2018年河南省淡水养殖环节监测中某一采样点检出的所有非O1/O139群霍乱弧菌菌株50株及从腹泻病人分离出的非O1/O139群霍乱弧菌菌株3株,共计53株。按季度采样进行检测,每季度采集1次。
1.2 试剂 哥伦比亚血平板购自贝瑞特生物技术(郑州)有限责任公司,脑心浸液肉汤培养基购自北京陆桥技术股份有限公司,细菌全基因组提取试剂盒(Ta KaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0)购自大连宝生物公司,dsDNA HS分析试剂盒(Invitrogen Qubit○RdsDNA HS Assay Kit)购自美国Thermo Fisher Scientific公司。上述培养基及试剂均在有效期内使用,且使用之前均经过技术性验收。
1.3 仪器 高速冷冻离心机(德国Sigma公司),N60-Touch超微量分光光度计(德国IMPLEN公司),Qubit 4.0荧光定量仪(美国Thermo Fisher Scientific公司)。
1.4 基因组DNA提取及全基因测序 将超低温冷冻保存的菌株划线接种于哥伦比亚血平板上,37℃培养18~24 h,分别挑取上述培养物单个菌落接种于脑心浸液肉汤培养基中,37℃培养18~24 h,分别吸取2 m L于无菌离心管中10 000 r/min离心5 min,弃上清,将沉淀物重新悬浮于无菌超纯水中,再次10 000 r/min离心5 min,弃上清,将沉淀物重新悬浮于无菌超纯水中,浊度控制在5.0左右,后续操作按照Ta KaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0操作手册进行基因组DNA提取。用N60-Touch超微量分光光度计(德国IMPLEN公司)测定基因组DNA纯度,用Qubit 4.0 DNA-HS进行定量,基因组DNA浓度75~168 ng/μL,最终体积是60μL。将提取的基因组DNA样品送至北京诺禾致源生物信息科技有限公司进行全基因组测序,实验流程:对基因组DNA进行质控检测,将检测合格的DNA样品用超声波破碎仪随机打断成长度约为350 bp的片段,经末端修复、加A尾、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。库检合格后,用Illumina NovaSeq PE150进行测序。经过预处理后得到clean data,使用SOAP denovo、SPAdes和Abyss组装软件进行组装,然后使用CISA软件进行整合,采用gapclose软件对初步组装结果进行优化和补洞,从而得到最终的组装结果,过滤低测序深度(小于平均深度的0.35)的reads去除同lane污染。
1.5 多位点序列分析及进化树分析 基于全基因测序结果,选择霍乱弧菌adK、gyrB、mdh、metE、pntA、purM、pyrC等7对管家基因[8]作为MLST分析基因,利用Pub MLST-Vc数据库(https://pubmlst.org/bigsdb?db=pubmlst_vcholerae_seq def&page=download Alleles)对53株霍乱弧菌菌株进行序列分型(sequence type,ST)。将7个管家基因序列串联,用最小生成树方法进行分子进化分析,,自建perl脚本使用SVG模块绘制,参数最大边长度设置为50,透明度设置为0.5。
1.6 毒力基因分析 基于全基因测序结果,利用VFDB数据库,通过BLASTN软件进行比对,对53株非O1/O139群霍乱弧菌进行毒力基因进行筛选,设定核苷酸最小一致性为80%。
2 结 果
2.1 53株非O1/O139群霍乱弧菌测序结果描述
53株非O1/O139群霍乱弧菌Contig number(>500 bp)为5~95个,N50 length为168 505 bp~1 018 069 bp,基因组大小为3.37 MB~4.37 MB,G+C含量47.24%~47.84%。基因岛为3~12个,平均长度8 966~19 544 bp;前噬菌体为1~10个,平均长度为5 951.5~73 574 bp。
使用SignalP(Version 4.1)、TMHMM(Version 2.0c)工具进行预测,检测是否含有信号肽及跨膜结构,综合预测蛋白序列是否是分泌蛋白。预测为分泌蛋白的个数为201~270个。
对于TNSS系统,通过蛋白序列功能数据库注释结果中,提取分泌系统相关蛋白进行注释。对于革兰氏阴性菌,另外采用EffectiveT3软件(Version 1.0.1)预测T3SS效应蛋白。预测为Ⅱ型分泌系统效应蛋白的个数为12~13个,预测为Ⅵ型分泌系统效应蛋白的个数为0~5个,预测为Ⅰ、Ⅳ、Ⅴ、Ⅶ型分泌系统效应蛋白的数量均为0个。预测为T3SS效应蛋白的个数为132~169个。
2.2 53株非O1/O139群霍乱弧菌毒力基因检测结果 对53株非O1/O139群霍乱弧菌进行全基因测序,参照VFDB数据库,通过BLASTN软件进行比对,进行毒力基因筛选。50株来源于淡水养殖环节非O1/O139群霍乱弧菌菌株40.00%~100.00%具有MSHAⅣ型菌毛和Ⅳ型性菌毛等黏附因子毒力相关基因,6.00%~100.00%具有荚膜多糖抗吞噬因子毒力相关基因,100.00%具有鞭毛趋化因子或运动因子毒力相关基因,20.00%~98.00%具有hap/vvp和nan H等酶类毒力相关基因,0%~100.00%均具有肠杆菌素受体、血红素受体、周质结合蛋白依赖的ABC转运系统、弧菌素生物合成因子和弧菌素利用因子等铁摄取因子毒力相关基因,100.00%均具有luxS和cqsA密度感应系统毒力基因,0%~100.00%具有EPSⅡ型分泌系统、Ⅲ型分泌系统及效应蛋白、VASⅥ型分泌系统及效应蛋白等分泌系统毒力相关基因。42.00%~100.00%具有RTX、tlh和hlyA等毒素毒力相关基因。
3株来源于病人的非O1/O139群霍乱弧菌菌株0~3株具有MSHAⅣ型菌毛和Ⅳ型性菌毛等黏附因子毒力相关基因,1~3株具有荚膜多糖抗吞噬因子毒力相关基因,3株具有鞭毛趋化因子或运动因子毒力相关基因,2~3株具有hap/vvp和nanH等酶类毒力相关基因、肠杆菌素受体、血红素受体、周质结合蛋白依赖的ABC转运系统、弧菌素生物合成因子和弧菌素利用因子等铁摄取因子毒力相关基因,3株均具有luxS和cqsA等密度感应系统毒力相关基因,0~3株具有EPSⅡ型分泌系统、Ⅲ型分泌系统及效应蛋白、VASⅥ型分泌系统及效应蛋白等分泌系统毒力相关基因。3株具有RTX、tlh和hlyA等毒素毒力相关基因。
毒力相关因子基因具体检测结果见表1。
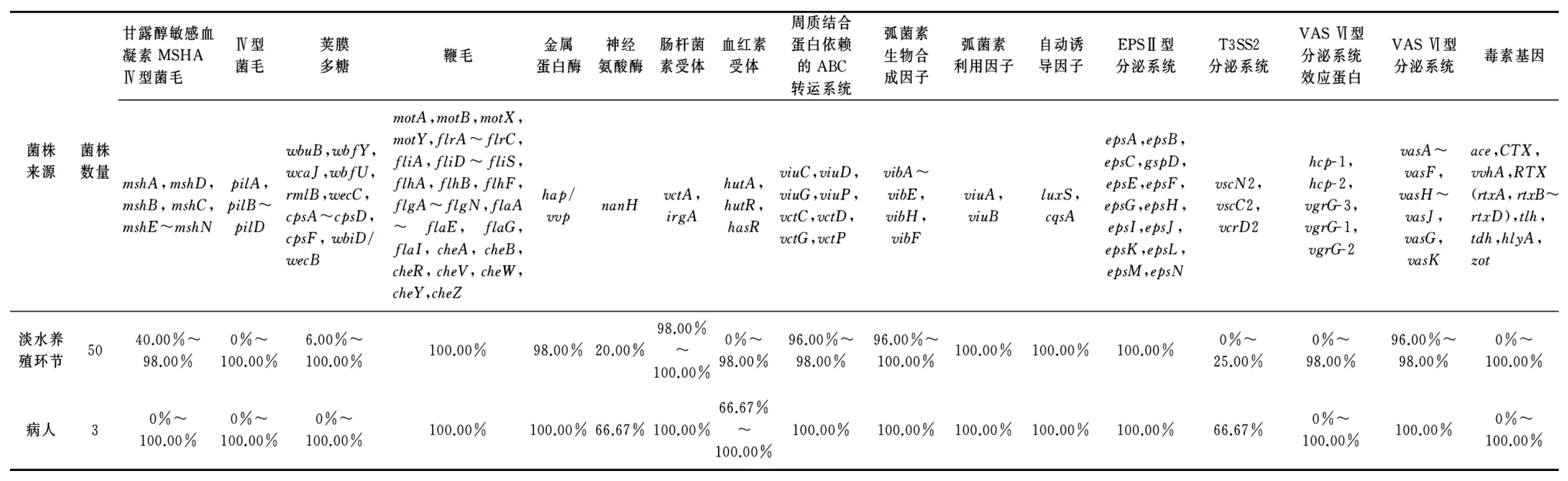
表1 53株非O1/O139群霍乱弧菌毒力相关因子基因检测结果Tab.1 Virulence related factor genes testing results in 53 strains of non-O1/O139 Vibrio cholerae
2.3 53株非O1/O139群霍乱弧菌ST型分布 53株非O1/O139群霍乱弧菌菌株分属19个ST型,其中50株来源于淡水养殖环节的非O1/O139群霍乱弧菌菌株分属17个ST型,依次为ST4(19株,占38.00%),ST5(6株,占12.00%),ST7(3株,占6.00%),ST11(3株,占6.00%),ST16(3株,占6.00%),ST3(2株,占4.00%),ST6(2株,4.00%),ST15(2株,占4.00%),ST17(2株,占4.00%),ST1(1株,2.00%),ST8(1株,2.00%),ST9(1株,2.00%),ST10(1株,2.00%),ST12(1株,2.00%),ST13(1株,2.00%),ST14(1株,2.00%),ST18(1株,2.00%)。3株来源于病人的 非O1/O139群霍乱弧菌菌株分属2个ST型,分别为ST19和ST20。19个ST型等位基因位点变异差异数在1~7个,其中来源于淡水养殖环节的非O1/O139群霍乱弧菌菌株17个ST型等位基因位点变异差异数在1~7个,来源于病人的非O1/O139群霍乱弧菌菌株2个ST型与来源于淡水养殖环节的非O1/O139群霍乱弧菌菌株ST1、ST2、ST6和ST10属同一簇,与ST1有6个等位基因位点变异差异数,最小生成树进化关系图见图1。

图1 53株非O1/O139群霍乱弧菌最小生成树进化关系图Fig.1 Evolution of minimum spanning tree of 53 non O1/O139 Vibrio cholerae strains
3 讨 论
非O1/O139群霍乱弧菌是重要的食源性致病菌,有研究显示其致病因子,除个别可产生霍乱毒素或类霍乱毒素外,主要包括外膜蛋白、脂多糖、热稳定毒素、蛋白酶、溶血素/溶细胞素、磷脂酶、转录调节因子、RTX外毒素、三型分泌系统和六型分泌系统等[9-11],其中,肠毒素、蛋白酶、溶血素和三型分泌系统是非O1/O139群霍乱弧菌重要的致病因子[12]。对2018年河南省淡水养殖环节中某一监测点的淡水养殖池塘检出的所有非O1/O139群霍乱弧菌50株和来源于2018年病人的非O1/O139群霍乱弧菌3株进行全基因测序,利用VFDB数据库,通过BLASTN软件进行比对,对53株非O1/O139群霍乱弧菌进行毒力基因筛选,发现来源于淡水养殖环节和来源于病人的非O1/O139群霍乱弧菌菌株均具有MSHAⅣ型菌毛和Ⅳ型性菌毛等黏附相关因子、荚膜多糖抗吞噬因子、鞭毛趋化因子或运动因子、hap/vvp和nanH等蛋白酶类,肠杆菌素受体、血红素受体、周质结合蛋白依赖的ABC转运系统、弧菌素生物合成因子及弧菌素利用因子等铁摄取因子,luxS和cqsA等密度感应系统,EPSⅡ型分泌系统、Ⅲ型分泌系统、VASⅥ型分泌系统及效应蛋白等分泌系统,RTX、tlh及hlyA等20种毒素毒力相关因子基因,缺失AFC、IVB型菌毛、Ⅲ型分泌系统效应蛋白、ace、CTX、tdh、zot等毒力相关因子基因,部分毒力相关因子或部分菌株的毒力相关因子毒力基因不全。两种不同来源菌株的毒力因子基因携带情况相近,除MSHAⅣ型菌毛毒力因子mshA基因、荚膜多糖wbuB基因、wbfY基因、rmlB基因、血红素受体hutA基因及Ⅲ型分泌系统vscC2和vcrD2基因外,部分菌株二者携带相同的毒力因子基因。两种不同来源菌株具有蛋白酶、溶血素和Ⅲ型分泌系统等非O1/O139群霍乱弧菌重要的致病因子,均不具有肠毒素致病因子。有文献报道,霍乱弧菌中主要有两个毒力基因簇,一个是编码霍乱毒素基因的CTXΦ丝状噬菌体,另一个是毒素共调菌毛TCP,TCP是霍乱弧菌在肠道的重要定植因子,CTXΦ丝状噬菌体能够通过TCP受体感染其他具有TCP的非产毒霍乱弧菌,将具有CTXAB基因的CTXΦ进行转移,使非产毒株转变为产毒株[13-15]。本次研究中50株淡水养殖环节和3株病人来源菌株均未发现CTXAB基因和/或TCP基因,尚未发现将具有CTXAB基因的CTXΦ进行转移使非产毒株转变为产毒株现象。有数据显示,甲鱼与霍乱疫情中感染来源与甲鱼高度相关[16-19],研究发现,MSHA、毒素共调菌毛(toxin-coregulatedpili,TCP)和几丁质结合蛋白(N-acetylglucosaminebinding protein A,GBP)是霍乱弧菌的3个重要定居因子,其中MSHA是霍乱弧菌定居于浮游生物表面的重要因子,而TCP和GBP在霍乱弧菌定植于哺乳动物小肠时发挥主要作用[20-22]。本次研究中50株淡水养殖环节来源菌株中40%具有mshA基因,3株病人来源菌株则缺失mshA基因,两者均不具有TCP基因,推测非O1/O139群霍乱弧菌菌株具有一定浮游生物表面定植能力,可以在一些水产品表面定植,但因不具有TCP等定植于哺乳动物小肠基因,影响非O1/O139群霍乱弧菌部分致病能力。
本次研究中53株非O1/O139群霍乱弧菌分属19个ST型,ST4和ST5是优势ST型,养殖环节来源的菌株与病人来源的菌株分属不同的ST型。
河南省淡水养殖环节非O1/O139群霍乱弧菌菌株MLST分型多样化,携带多种毒力相关因子,部分菌株与病人菌株携带的毒力基因相同,虽然分属不同的ST型,但还是存在食品安全风险,提醒有关部门采取措施,降低由于淡水养殖环节中非O1/O139群霍乱弧菌污染导致从养殖场到餐桌的污染风险,减少非O1/O139群霍乱弧菌感染引发的食源性疾病的发生,保障食品安全。
利益冲突:无
引用本文格式:炊慧霞,陈磊,吴玲玲,等.河南省某一淡水养殖环节中非O1/O139群霍乱弧菌毒力基因及分子分型分析[J].中国人兽共患病学报,
2021,37(12):1091-1095.DOI:10.3969/j.issn.1002-2694.2021.00.154
