COVID-19疫苗保护效力及挑战
2022-01-05杨朝国杨晶艳吴俐莎刘继芬
杨朝国,杨晶艳,吴俐莎,刘继芬,刘 武
截止到2021年9月19日,全球有311个候选的2019冠状病毒病(coronavirus disease 2019,COVID-19)疫苗正在研究中,其中117个临床试验中的疫苗的开发平台所占比例从高到低依次为蛋白亚单位疫苗、病毒载体疫苗、mRNA疫苗、灭活疫苗、DNA疫苗、病毒样颗粒疫苗、病毒载体+抗原提呈细胞疫苗、减毒活疫苗,正在进行Ⅲ期和Ⅳ期临床试验的疫苗分别有35个和9个[1]。已获准紧急使用的疫苗包括BBIBP-Cor V(中国国药集团)和Corona Vac(中国北京科兴)等灭活严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-Co V-2)疫苗,BNT162b2(美国辉瑞/德国Biontech/中国复星医药)和mRNA1273(美国莫德纳)等编码全长S蛋白的m RNA疫苗,Ad5-nCo V(中国康希诺生物)、Ad26.COV2.S(美国强生)、Ch Ad Ox1-S(英国阿斯利康/牛津大学)和Gam-COVID-Vac(r Ad5/r Ad26联合载体疫苗,俄罗斯Gameleya研究所)等编码全长S蛋白的腺病毒载体疫苗,ZF2001(S蛋白受体结合域二聚体,中国智飞生物)等重组蛋白亚单位疫苗[2-3]。
COVID-19疫苗诱导人体产生的免疫力对防止SARS-Co V-2感染及相关疾病流行、降低重症率与死亡率以及限制病毒传播极为重要。从2020年底开始,通过Ⅲ期临床试验、批准紧急使用的COVID-19疫苗在全球多地开展人群接种。虽然随机临床试验是评价疫苗干预效果的“金标准”,但也存在明显局限如样本量与亚组分析、限制性纳入标准、在人群大规模疫苗推广中不可复制的高受控条件等,这些都会影响疫苗的有效性和安全性[4]。因此,需要在非受控条件下跨越不同人群对疫苗的核心问题有效性、持久性和安全性进行评估。同时SARS-Co V-2变异株不断出现,可能逃逸现有疫苗保护,威胁疫苗效力,对相关疾病防控带来挑战。本文对COVID-19疫苗保护效力、持久性、病毒变异与再感染、抗体依赖性增强效应及致病性自身免疫等进行综述。
1 SARS-CoV-2变异
截止到2021年5月17日,在SARS-Co V-2 S蛋白中至少发现了6 200个氨基酸替代、缺失和插入类型[5]。到2021年9月19日,WHO公布了12种“进一步监测的变异株(alerts for further monitoring)”、5种“待观察的变异株(variant of interest,VOI)”和4种“值得关注的变异株(variant of concern,VOC)”(表1)。进一步监测的变异株是指怀疑遗传学改变将影响病毒特性,有迹象表明其可能构成未来风险,但目前证据不清楚,在新证据出现之前需要加强监测和评估的SARS-Co V-2变异株。VOI是指已知或预计遗传学改变会影响病毒特性如传播、致病性、免疫逃逸、诊断或治疗逃逸,确定引起重大社区传播或多个聚集性感染,在多个国家随着时间推移病例数与相对流行率同时增加或提示全球公共卫生面临新风险的SARS-Co V-2变异株,包括Eta(B.1.525)、Iota(B.1.526)、Kappa(B.1.617.1)、Lamda(C.37)和Mu(B.1.621),Epsilon(B.1.427/B.1.429)、Zeta(P.2)和Theta(P.3)已 从VOI排除。VOC是指符合VOI,证实其与一定程度上具有全球公共卫生意义的下列一个或多个变化有关的SARS-Co V-2变异株:①在COVID-19流行病学方面,传播能力或有害变化增加;②毒力增强或临床疾病表现加重;③公共卫生和社交措施或正在使用的疫苗、诊断和治疗的效力下降[6]。
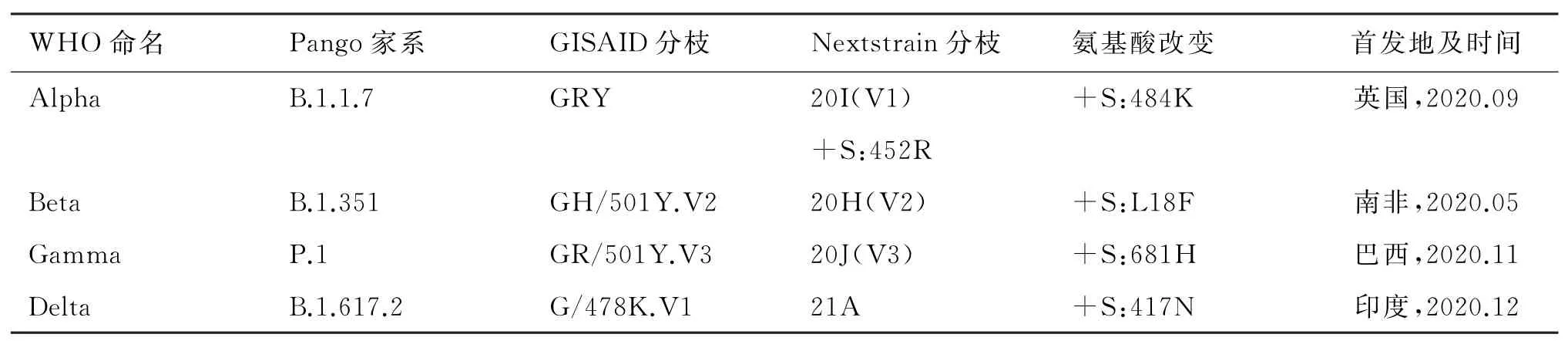
表1 SARS-CoV-2值得关注的变异株的特性[6]Tab.1 Characteristics of SARS-CoV-2 variants of concern
2 COVID-19疫苗保护效力
2.1 mRNA疫苗保护效力 2020年12月至2021年2月1日以色列Clalit健康服务中心数据显示,接受BNT162b2疫苗接种人群596 618人,按1∶1匹配未接种疫苗人群为对照组,两组人群在可能与疫苗接种、感染和(或)COVID-19严重性相关的可变因素相匹配且无SARS-Co V-2 PCR阳性记录。疫苗保护效力见表2。预防有记载感染和有症状COVID-19的效力在各亚组人群间一致,但多个危险因素共存的人群稍微偏低[4]。结果显示,第一剂疫苗接种后1月内随时间推移对SARS-Co V-2感染及其相关各种临床类型疾病的保护率都明显增加,二剂疫苗接种后的保护率高于一剂疫苗接种。2021年1月24日至4月3日以色列全国4 714 932人完成BNT162b2疫苗二剂接种,年龄16~85岁以上,在随访中位时间7周期间,第二剂疫苗接种后≥7 d,疫苗保护效力与前一组人群基本一致,对COVID-19死 亡 的 保 护 效 力 为96.7%(95%CI.96.0%~97.3%),94.5%为Alpha变异株SARSCo V-2感染[7]。两组以色列人群的保护率提示随着疫苗接种覆盖范围增加,人群SARS-Co V-2感染及相关疾病、住院、严重疾病、死亡都下降。
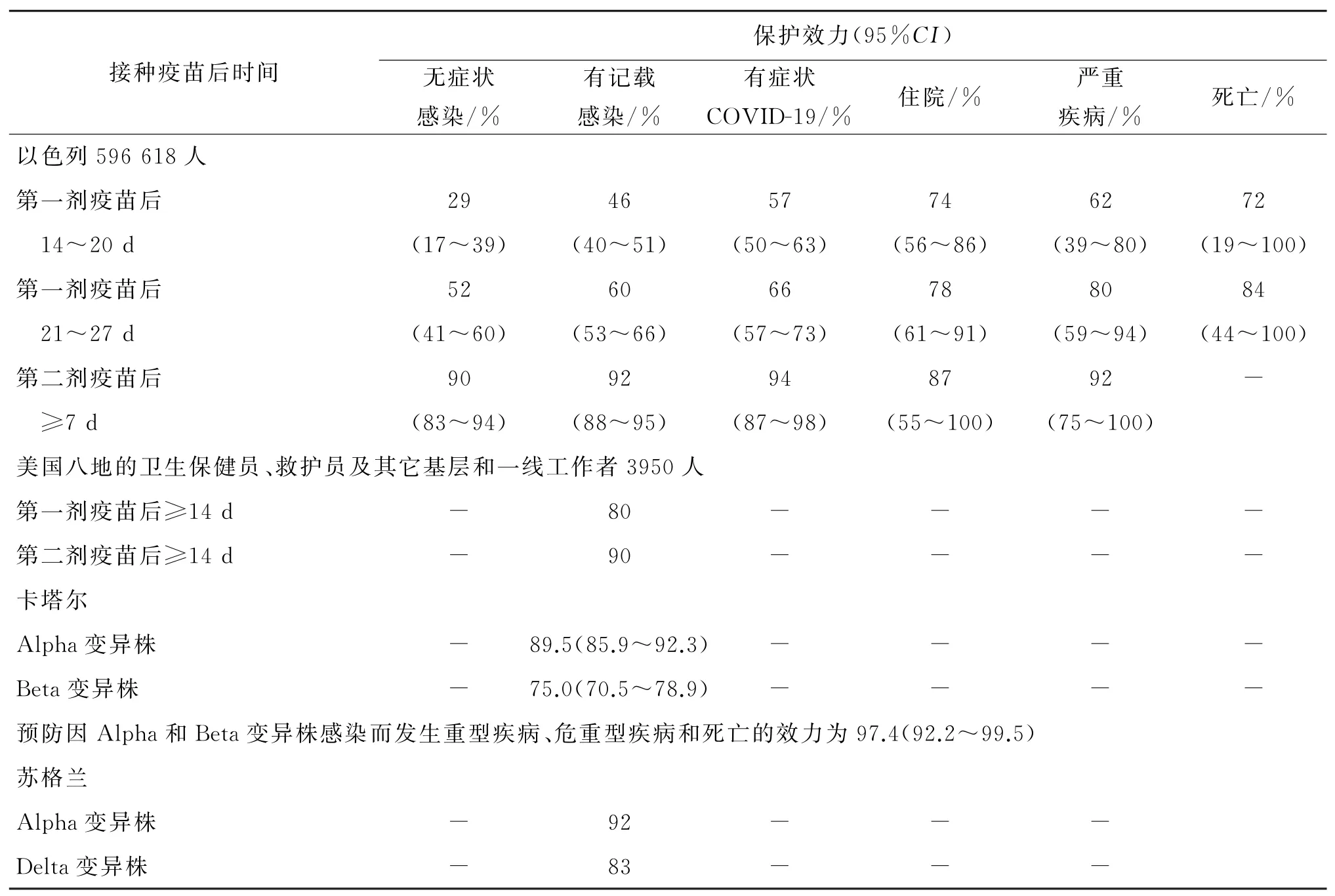
表2 mRNA疫苗保护效力Tab.2 Protective effectiveness of mRNA vaccine
2020年12月14日-2021年3月13日美国八地3 950名卫生保健员、救护员及其它基层和一线工作者接种BNT162b2或m RNA1273疫苗,预防SARS-Co V-2感染的效力见表2[8]。对美国卫生保健员、救护员及其它基层和一线工作者的保护率比以色列普通人群低2%~5%。提示COVID-19 m RNA疫苗可有效预防成人感染SARS-Co V-2,但对高风险人群保护效力低于普通人群。
卡塔尔国家COVID-19数据库数据表明,BNT162b2疫苗第二剂接种后≥14 d,抗Alpha和Beta变异株的效力见表2;疫苗接种人群与SARSCo V-2抗体阴性人群的SARS-Co V-2感染率比较,疫苗预防Alpha和Beta变异株感染的效力分别为87.0%(95%CI81.8~90.7)和72.1%(95%CI66.4~76.8)[9]。在苏格兰,BNT162b2疫苗抗Alpha和Delta变异株的效力见表2[10]。对变异株感染及相关疾病的保护率降低约5%~20%。提示COVID-19疫苗可有效预防SARS-Co V-2变异株感染及相关疾病,但抗变异株的效力降低,给COVID-19疫苗带来挑战。
大规模接种m RNA疫苗可有效预防SARSCo V-2(包括变异株)感染、COVID-19及相关住院、严重疾病和死亡,按程序完成二剂疫苗接种后,保护效力与随机临床试验结果(94%~95%[11-12])基本一致。保护效力与人群感染风险、流行毒株、社区流行状态、人群和个人防护、社交措施等有关,对高风险人群的保护效力低于普通人群,抗变异毒株的效力低于野生型毒株。
2.2 灭活疫苗保护效力 2021年2月2日—5月1日,智利,年龄≥16岁(包括80岁以上)的10 187 720名接受Corona Vac疫苗全程免疫者,疫苗保护效力见表3[13]。Corona Vac疫苗Ⅲ期临床试验结果显示,土耳其11 303名18~59岁志愿人群第二剂接种后≥14 d,89.7%受试者产生S蛋白受体结合域(receptor-binding domain,RBD)抗体,RBD抗体阳性者中92.0%产生保护水平中和抗体,疫苗保护效力见表3;在巴西医务人员中,Corona Vac疫苗保护效力见表3,抗B.1.128、P.1和P.2变异株的中和抗体血清学转换率或几何平均滴度无差异[14]。Corona Vac疫苗对Gamma变异株仍有效,在智利、土耳其和印度尼西亚Corona Vac疫苗保护效力高于巴西,可能是巴西人群先前接触过SARS-Co V-2而具有一定免疫力[15],加之医务人员为SARSCo V-2感染高风险人群。

表3 CoronaVac疫苗保护效力(95%CI)Tab.3 Protective effectiveness of CoronaVac vaccine(95%CI)
在斯里兰卡科伦坡,接种BBIBP-Cor V灭活疫苗二剂后血清学转换率为95%,20~39岁人群血清学转换率(98.9%)高于>60岁人群(93.3%);第二剂接种后6周时81.25%的受种者具有血管紧张素转化酶2(angotensin converting enzyme 2,ACE2)受体封闭抗体,血清抗体滴度与COVID-19康复者血清无差异;疫苗接种者血清中野生型毒株和Alpha变异株的RBD抗体显著低于康复者血清,但Beta和Delta变异株的RBD抗体无差异[16]。
灭活疫苗可有效预防SARS-Co V-2(包括变异株)感染及相关疾病、住院、中度和重度疾病、入住ICU和死亡,对≥60岁人群的保护效力与不分年龄人群的总体保护效力一致。疫苗保护效力与人群感染风险、流行毒株、社区流行状态、人群和个人防护、社交措施等有关,对高危人群的保护效力低于普通人群。
COVID-19疫苗保护效力与Ⅲ期临床试验结果基本一致,对防控SARS-Co V-2感染及其相关疾病流行具有极其重要意义。随着疫苗接种人群覆盖范围增加,SARS-Co V-2感染及相关疾病、住院、中度和重度疾病、入住ICU和死亡都下降。COVID-19疫苗有助于控制SARS-Co V-2感染及相关疾病流行,对高流行率地区可缓解不堪重负的医疗系统。但需要持续高度关注SARS-Co V-2变异对疫苗效力的影响。
3 COVID-19疫苗的挑战
大规模人群接种COVID-19疫苗对降低SARS-Co V-2感染率、相关疾病及其重症与死亡率、遏制病毒传播和变异具有极其重要意义,但也有急待解决的问题。
3.1 COVID-19疫苗对特殊人群的免疫原性、有效性、安全性和免疫方案 年龄是SARS-Co V-2感染相关严重疾病和死亡的最大危险因素之一,年龄相关的免疫系统衰退称为免疫衰老,这与对感染性和非感染性疾病的敏感性增强、严重疾病和死亡率增加有关,也限制疫苗的效力[17]。BNT162b2疫苗第一剂接种后,血清中和作用及结合性IgG/Ig A随年龄增加而降低,80岁以上老人明显降低且血清对Alpha、Beta和Gamma变异株的中和效力显著低于野生型毒株,但产生免疫应答的老人SARS-Co V-2 S蛋白特异性记忆B细胞高于无免疫应答者,第二剂疫苗接种后各年龄都检测到了对VOCs的中和作用[18];第二剂疫苗接种后,抗体应答差异与年龄和性别显著相关,女性强于男性,年龄较小者抗体滴度大于年龄较大者,而与体重指数和高血压无统计学意义相关性[19],对Alpha、Beta和Delta变异株的中和抗体下降与年龄增加显著相关,与性别和体重指数无关[20]。BBIBP-Cor V灭活疫苗二剂接种后,血清中和抗体滴度与年龄高度相关,但与性别几乎无关,50岁以下约90%可检出中和抗体,而60岁约25%、大于80岁约50%未检测到中和抗体[21]。对172名先前未感染SARS-Co V-2的80岁及以上老年自愿受试者研究显示,与二剂BNT162b2疫苗接种标准间隔时间3周比较,间隔11周~12周血清抗体峰值高3.5倍,但 细 胞 免 疫 应 答 低3.6倍[22]。提示老年人为高风险人群,尤其是VOCs流行区域;对老年人,有必要施行特定措施以提高疫苗免疫应答,设计有效保护老年人的疫苗及免疫方案;老年人延迟第2次接种可增强体液免疫应答,但需进一步评估长期免疫力和持久性。对优化COVID-19疫苗免疫方案、提供长期抗SARS-Co V-2感染免疫保护以及制订疫苗接种政策有重要价值。
因年龄、疾病、治疗及共发病等因素,癌症病人是重型COVID-19高危人群,能否对SARS-Co V-2或COVID-19疫苗产生足够强的保护性免疫应答仍不清楚。167例慢性淋巴细胞白血病患者接种BNT162b2疫苗二剂后,抗体应答率为39.5%,积极治疗中的病人仅为16%;261例SARS-Co V-2阳性的癌症患者中,实体瘤和血液肿瘤患者血清学转换率分别为94.5%和81.7%[23]。对500例癌症病人(97.8%实体瘤和2.2%血液肿瘤,平均年龄62.5[21]~88岁)与1190例健康保健工作者研究显示,二者血清SARS-Co V-2抗体阳性率无差异,但癌症病人血清SARS-Co V-2刺突(spike,S)蛋白和核衣壳(nucleocapsid,N)蛋白的IgG类抗体浓度显著低于健康保健工作者[24]。在接种二剂BNT162b2疫苗后,化疗中的实体癌症病人(102例,年龄66[IQR 56~72]岁)血清抗S蛋白-IgG阳性率为90%,健康人(78例,年龄62[IQR 49~70]岁)为100%,癌症病人血清抗S蛋白-IgG滴度(1931[IQR,509~4 386]AU/m L)低于健康人(7160[IQR,3 129~11 241]AU/m L)[25]。治疗中的癌症病人接种一剂m RNA疫苗产生弱免疫应答,随后在21 d时第二次接种免疫应答改善[26]。提示癌症病人对SARSCo V-2或COVID-19疫苗的免疫应答低于健康人,实体恶性肿瘤患者比血液肿瘤患者产生的保护性免疫应答更强;癌症病人可接种COVID-19疫苗,但效力、持久性和安全性尚需进一步研究,优化疫苗接种全程方案很重要。
明确COVID-19疫苗对孕妇和哺乳妇女的保护效力和安全性,有助于孕妇疫苗接种和健康保健决策。一队列研究显示,COVID-19 m RNA疫苗诱导孕妇、哺乳妇女和非孕妇女产生的抗体滴度中位数(四分位范围)分别为5.59(4.68~85.89)、5.74(5.06~6.22)和5.62(4.77~5.98),3类人群血清抗体滴度无统计学差异,都高于妊娠期间感染SARSCo V-2诱导产生的抗体滴度;脐带血和乳汁中也存在抗体,脐带血中和抗体滴度(52.3[11.7~69.6])低于母亲血清(104.7[61.2~188.2]);第2次接种增加母亲血液和乳汁中IgG,Ig A不增加[27]。患COVID-19的不同孕龄母亲都可将SARS-Co V-2特异性抗体转移给新生儿[28]。提示COVID-19 m RNA疫苗可诱导孕妇和哺乳妇女产生强体液免疫应答,免疫原性和免疫反应性与非孕妇女相似;COVID-19疫苗或SARS-Co V-2感染诱导母亲产生的抗体可通过胎盘和乳汁转移给新生儿,使其获得免疫力,但保护新生儿免遭SARS-Co V-2感染的抗体滴度仍不清楚。初步研究显示,孕妇接种COVID-19 mRNA疫苗后未出现与疫苗相关的妊娠或新生儿安全性问题[29]。但尽管没有安全问题,母亲接种COVID-19疫苗对母亲、妊娠、新生儿、儿童等的影响还需大样本随访研究。
为保护青少年现场学习和社会交流,构建群体免疫,青少年需要安全有效的COVID-19疫苗。随机对照临床试验结果显示,BNT162b2 m RNA疫苗诱导青少年(12~15岁)产生的免疫应答强于青年成人(16~25岁);第一剂接种后第二剂接种前保护效力为75%(95%CI7.6~95.5),第二剂疫苗接种后≥7 d保护效力为100%(95%CI75.3~100);随访1个月无疫苗相关的严重不良事件[30]。Corona-Vac疫苗对3~17岁健康儿童和青少年1/2期临床试验结果显示,1.5μg二剂接种或3.0μg二剂接种,Ⅰ期临床试验中和抗体血清学转换率均为100%,几何平均滴度(GMT)分别为55.0(95%CI38.9~77.9)和117.4(95%CI87.8~157.0),Ⅱ期临床试验中和抗体血清学转换率分别为96.8%和100%,GMT分 别 为86.4(73.9~101.0)和142.2(124.7~162.1),无疫苗相关的严重不良事件[31]。提示COVID-19疫苗对儿童和青少年的效力与安全性不低于成人,但COVID-19疫苗对青少年的长期安全性、抗体应答、效力、持久性尚需进一步评估。
为人人公平享有接种COVID-19疫苗的权利,构建群体免疫保护屏障,COVID-19疫苗对特殊人群的免疫原性、有效性和安全性以及疫苗组分与免疫方案等都是急迫需要解决的问题。
3.2 保护性免疫力持久性 SARS-Co V-2感染或疫苗诱导的保护性免疫力持久性对认识和预测COVID-19的流行过程、制定防控策略及人群免疫方案至关重要,但至今仍不确定。对164例COVID-19康复者随访到症状出现后180 d,血液中和抗体动力学有5个模式:①阴性(12%),未产生中和抗体;②快速下降(27%),从症状出现后约20 d中和抗体水平开始变化,180 d内血清学还原;③缓慢下降(28%),症状出现后180 d时中和抗体仍阳性;④持续稳定(32%),中和抗体水平峰值变化,但下降很小;⑤延迟应答(2%),在症状出现后90 d或180 d时中和抗体水平增加[32]。提示不同个体中和抗体动力学差异大,预测免疫力持久性可能需对个体准确测定中和抗体水平。COVID-19疫苗诱导的中和抗体动力学是否也具有个体化特征,对疫苗接种后免疫力持久性可能产生影响,这对在疫情应对中的公共卫生和社会防控措施具有重要意义。
抗病毒免疫力持久性的关键是记忆B/T细胞,再次遭遇相同病毒或疫苗时可迅速产生强烈免疫应答而清除病毒。病毒清除后骨髓中长寿命记忆浆细胞可存活数十年持续分泌抗体形成长期免疫保护。77例轻型COVID-19病人在SARS-Co V-2感染后前4个月SARS-Co V-2 S蛋白的抗体快速下降,随后7个月逐渐下降,11个月时仍可检出,血液抗体浓度动力学呈双相性特征(图1),在急性免疫应答期抗体浓度快速上升达到高峰值,随后抗体浓度下降(因急性免疫应答期大多数浆细胞寿命短),几个月后抗体浓度趋于平稳几乎恒定在最大浓度的10%~20%,这与急性免疫应答期浆细胞的10%~20%变成长寿命记忆浆细胞一致,表明从短寿命浆细胞产生抗体变换为长寿命记忆浆细胞产生抗体;血清S蛋白的抗体滴度与感染后7~8个月时康复者骨髓浆细胞(BMPCs)数量有关,无SARS-Co V-2感染或疫苗接种史者未检测到S蛋白特异性BMPCs;COVID-19康复者血液也检出了S蛋白特异性记忆B细胞[33-34]。提示骨髓长寿命记忆浆细胞长期产生抗体(急性免疫应答期的10%~20%)提供稳定免疫保护,长寿命BMPCs是保护性抗体持续重要来源,是持久免疫力重要部分。骨髓中长寿命记忆浆细胞可能是长期免疫力的最佳预测因素。
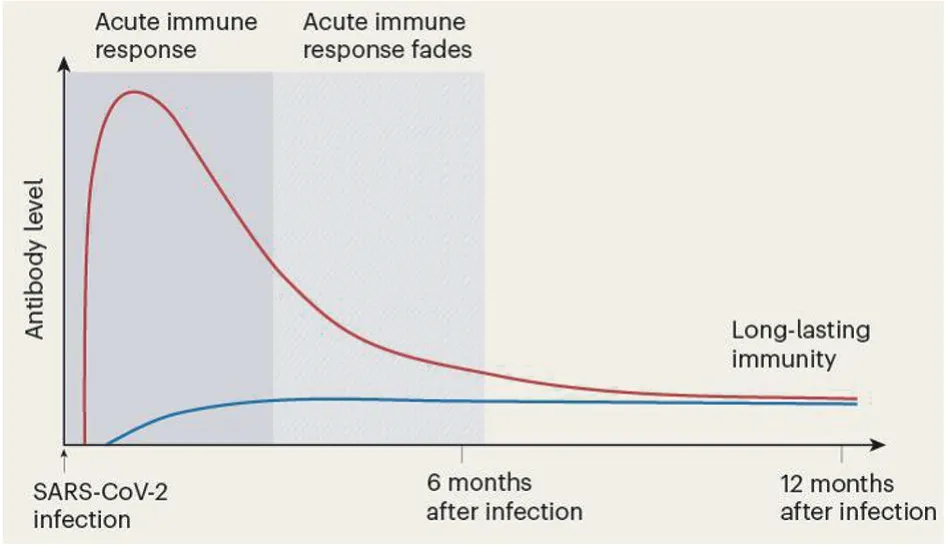
图1 SARS-CoV-2感染免疫应答[33]Fig.1 Immune response to SARS-CoV-2 infection[33]
63例COVID-19康复者在感染后6~12个月,外周血中和SARS-Co V-2活性及S蛋白RBD特异性记忆B细胞数量保持相对稳定;感染1年后m RNA疫苗接种可增加体液免疫应答的所有成分,SARS-Co V-2特异性抗体水平比疫苗接种前升高50倍以上,产生对VOCs的血清中和活性,与疫苗接种获得的抗最初Wuhan Hu-1毒株的中和活性相当甚至更高[35]。提示中和抗体浓度在感染后6~12个月稳定,记忆B细胞通过体细胞高频突变持续增强SARS-Co V-2特异性抗体应答,m RNA疫苗接种可产生抗SARS-Co V-2变异株抗体和记忆B细胞。
目前大多数关于SARS-Co V-2的研究都是分析免疫应答急性相,持续时间在感染或疫苗接种后几个月,监测T细胞、B细胞和抗体。COVID-19疫苗免疫应答是否产生分泌SARS-Co V-2抗体的长寿命记忆浆细胞不清楚,疫苗接种产生的浆细胞可能一部分会变成长寿命记忆浆细胞,形成长期免疫记忆,这还需要证实。COVID-19疫苗诱导的记忆性免疫应答、抗体动力学与持久性有待进一步阐明。
3.3 病毒变异与再感染的发生 临床试验证实COVID-19疫苗具有良好保护效力,但如果SARSCo V-2突变属于或靠近S蛋白主要抗原位点,可产生抗原性不同于原始毒株的变异株[5,36]。Beta变异株对单克隆抗体和COVID-19康复者血浆的抗性最强,其次为Gamma和Alpha变异株,抗性等级与S蛋 白N-末 端 域(N-terminal domain,NTD)和RBD中导致主要抗原改变的突变对应,尤其是NTD中Y144del和242-244del突 变 及RBD中K417N/T、E484K和N501Y突 变,RBD突 变 影 响更大;抗体结合活性与中和活性有很好的相关性,逃逸突变减弱机体对NTD或RBD应答。提示NTD和RBD为SARS-Co V-2 S蛋白的主要抗原域,对NTD和RBD应答可能联合参与多克隆应答的整体保 护,Alpha、Beta和Gamma变 异 株 的RBD中K417N、E484K和N501Y突变对抗体中和作用具有重大影响,NTD突变降低变异株对超级位点抗体和康复者血浆的中和敏感性[5]。SARS-Co V-2 S蛋白主要抗原漂移增加的新变异株逃逸现有抗体治疗和疫苗保护将对抗体治疗和疫苗效力带来重大挑战。
感染或疫苗诱导的抗体对SARS-Co V-2变异株的中和作用降低。BNT162b2疫苗接种二剂后,2周或4周时人血清对Kappa、Delta、Eta及B.1.618变异株的中和滴度均降低[37];分别有3%(5/159)和5%(9/159)的人血清缺乏Beta和Delta变异株的中和抗体活性,与野生型毒株比较,对Delta、Beta和Alpha变异株的中和抗体滴度分别下降5.8倍、4.9倍和2.6倍[20]。与野生型毒株比较,灭活疫苗BBIBP-Cor V和重组二聚体RBD疫苗接种者血清对SARS-Co V-2 501Y.V2变异株的几何平均中和滴度 分 别 降 低1.5倍 和1.6倍[38]。提 示SARSCo V-2变异株对中和抗体敏感性下降,预示疫苗效力降低和病毒传播性增加双重挑战。虽然SARSCo V-2变异株可部分逃逸感染或疫苗诱导的体液免疫应答,但仍有保护效力,S蛋白特异性T细胞激活不受变异株突变影响[5,20,36,39-41]。SARS-Co V-2变异株对疫苗诱导的中和抗体的敏感度仍支持疫苗接种构成群体免疫屏障,但需要实时监测病毒突变及其对疫苗效力的影响。有保护作用的中和抗体水平及其下降多大程度才会影响疫苗保护效力和增加疾病严重性仍不清楚。
SARS-Co V-2 S蛋白的多种突变与再感染的可能性增加有关。对接种BNT162b2或m RNA1273疫苗二剂后至少2周的417人随访,2人发生再感染,尽管有证据表明这2人具有疫苗效力,但SARS-Co V-2 PCR试验阳性,并出现COVID-19症状,病毒基因组测序结果显示这2人感染的SARSCo V-2均为突变株[42]。巴西出现了由B.1.1.28(7个突变)和B.1.2(15个突变)变异株引起的SARSCo V-2再感染[43]。意大利对普通人群随访平均280(SD41)d,再感染 率 为0.31%(5/1 579,95%CI0.03%~0.58%)[44]。英国对保健工作者随访7个月,再感染率为1.87%(155/8 287)[45]。美国罗德岛监狱中BNT162b2或m RNA-1273疫苗接种者SARS-Co V-2再感染率为1.13%[46]。提示SARSCo V-2 S蛋白改变使病毒对中和抗体敏感性下降,导致SARS-Co V-2变异株逃逸感染或疫苗诱导的中和抗体,在疫苗接种后存在变异毒株再感染风险,需要持续防控和诊断SARS-Co V-2感染,跟踪研究疫苗接种人群再感染的变异株特征。SARS-Co V-2 Delta变异株S蛋白NTD和RBD的多种突变增强免疫逃逸、再感染发生和快速传播。从暴露到第1次SARS-Co V-2 m RNA PCR阳性间隔时间,Delta变异株为4.00 d(IQR 3.00~5.00 d,峰值3.71 d),而2020年早期流行毒株为6.00 d(IQR 5.00~8.00 d,峰值5.61 d);第1次PCR阳性时SARS-Co V-2载量,Delta变异株感染者比2020年早期流行毒株感染者高1 260倍[47]。Delta变异株可抵抗一些抗NTD和RBD的单克隆抗体的中和作用,COVID-19康复者血清抗Delta变异株的能力比Alpha变异株低4倍,接种一剂BNT162b2或Ch Ad Ox1-S疫苗者血清几乎不能抑制Delta变异株,接种二剂疫苗后对Delta变异株的中和滴度比Alpha变异株低3~5倍[48]。实际上,接种一剂BNT162b2或Ch Ad Ox1-S疫苗后抗Delta变异株的效力(30.7%,95%CI25.2~35.7)低于Alpha变异株(48.7%,95%CI45.5~51.7),二种疫苗结果相近;接种二剂疫苗后,BNT162b2疫苗抗Delta和Alpha变异株的效力分别为88.0%(95%CI85.3~90.1)和93.7%(95%CI91.6~95.3),Ch Ad Ox1-S疫苗抗Delta和Alpha变异株的效力分别为67.0%(95%CI61.3~71.8)和74.5%(95%CI68.4~79.4)[49]。BNT162b2和Ch Ad Ox1-S疫苗对Delta变异株感染及相关疾病的保护效力比Alpha变异株低5%~8%,比野生型毒株(94%~95%)低近30%。提示SARS-Co V-2 Delta变异株比野生型毒株和其它变异株传播和复制更快,在感染早期传染性更强,对COVID-19疫苗诱导的中和抗体敏感性更低,高传播性与逃逸RBD和非RBD中表位的抗体有关;COVID-19疫苗对Delta变异株感染及相关疾病仍具有保护效力,但保护效力降低给疫苗带来重大挑战。
联合应用RBD和NTD反应性中和抗体可能为改善治疗或疫苗的诱人方法。已确认的SARSCo V-2中和抗体大多数识别RBD多个已知位点,封闭RBD与ACE2相互作用。对COVID-19康复者抗S蛋白-IgG库蛋白质组学分析显示,免疫应答主要直接针对RBD以外的表位(>80%),血浆NTD特异性抗体和其它非RBD特异性抗体普遍存在并影响抗SARS-Co V-2保护作用和抗体逃逸[50]。NTD特异性中和抗体识别由可移动发夹和柔性环组成的无多糖、正电性的表面,RBD特异性抗体识别非重叠表位[51]。自然感染诱导的NTD特异性抗体具有中和作用,机制为抑制病毒感染过程的病毒粘附后阶段,封闭病毒进入或融合,还通过Fc段介导的生物学活性抗SARS-Co V-2感染[52]。提示治疗抗体或疫苗靶向更多的非RBD抗原(如NTD)位点可限制抗体逃逸、疫苗或感染诱导的免疫力下降。
SARS-Co V-2变异引起抗原漂移增强变异株对中和抗体的抵抗性,感染或COVID-19疫苗诱导的抗体对变异株的中和活性降低,随着病毒突变位点累积将对疫苗保护效力带来重大挑战,需要持续监测。但对现有变异株仍然有保护效力,目前COVID-19康复者或疫苗接种者再感染SAR-Co V-2为低风险事件。
3.4 抗体依赖性增强效应 SARS-Co V-2 S蛋白抗体对机体防御病毒感染起着关键作用,但病毒抗体并不总是起保护作用,抗体依赖性增强(Antibody-dependent enhancement,ADE)效应可促进感染或疾病加重甚至致死性再感染。ADE效应已在登革热病毒、猫传染性腹膜炎冠状病毒、SARS和MERS等感染中报道。对来自COVID-19病人的一系列S蛋白单克隆抗体筛查发现针对S蛋白NTD特定位点的抗体增强S蛋白与ACE2结合能力及SARS-Co V-2感染性,重型和非重型COVID-19病人都产生感染增强性抗体及中和抗体,但重型病人抗体水平更高,这种感染增强性抗体也以很低的频率出现于未感染者[53]。提示SARS-Co V-2感染可诱生中和抗体也可产生感染增强性抗体。当中和抗体浓度高时,感染增强性抗体不起作用。但在感染前或早期中和抗体水平很低,感染增强性抗体可能影响COVID-19疾病进展过程。SARS-Co V-2变异株丢失中和抗体的表位可能意味着感染增强性抗体的效应发生改变,变异株与感染增强性抗体的关系需要关注。
3.5 致病性自身免疫 COVID-19与许多自身免疫表现有关,包括致病性自身抗体产生、自身免疫病和免疫相关性疾病新发,如Guillain-Barre综合征、免疫性甲状腺异常、川崎病等。COVID-19病人最常见的自身免疫表现是抗磷脂抗体(APLA)(47.1%,49/104),包括抗心磷脂、狼疮抗凝物和β2糖蛋白Ⅰ,APLA能与细胞膜结合并诱导高凝状态,导致血栓形成[54]。另一致病性自身抗体是血小板因子4(PF4)抗体,其介导Ch Ad Ox1-S疫苗接种后异常凝血(尤其脑静脉血栓形成)和血小板减少,已导致了一些病例死亡。PF4抗体与PF4上的肝素结合位结合使PF4四聚体聚集并形成免疫复合物,进而引起FcRγIIA依赖的血小板活化而引起血栓形成[54-56]。虽然这是罕见事件,但后果严重,为保证疫苗接种者的安全,疫苗诱导的血栓性血小板减少综合征的研究极为重要。COVID-19疫苗接种诱导的自身免疫仍不清楚,还需要进一步研究。
4 总结与展望
COVID-19疫苗保护效力与Ⅲ期临床试验结果一致,SARS-Co V-2变异株抗原漂移导致疫苗抗变异株感染的保护效力有所下降,但COVID-19疫苗对现有变异株感染及相关疾病仍有保护效力,为疫苗接种最终控制SARS-Co V-2感染及相关疾病流行提供了希望。同时SARS-Co V-2变异株也引起了再感染的发生,应加快疫苗接种速度,尽快构建群体免疫保护屏障,遏制病毒传播和变异,并持续跟踪病毒突变累积与疫苗保护效力,开发研究变异毒株的疫苗,未来在原始毒株疫苗群体免疫基础上,实施变异毒株疫苗的加强免疫,有效防控再感染及其相关疾病的发生。
血液抗体动力学呈双相性特征,对COVID-19疫苗保护效力持久性评价时,应关注血液中和抗体的动力学个体化特性,不应期望在免疫记忆相维持急性免疫应答期的高浓度抗体特征。另外,针对癌症病人、孕妇、儿童、免疫力低下等特殊人群的COVID-19疫苗与免疫方案及其保护效力和安全性等还需要系统研究。这些对在疫情应对中的公共卫生和社会防控措施具有重要意义。
利益冲突:无
引用本文格式:杨朝国,杨晶艳,吴俐莎,等.COVID-19疫苗保护效力及挑战[J].中国人兽共患病学报,2021,37(12):1108-1117.DOI:10.3969/j.issn.1002-2694.2021.00.164
