西藏牦牛多杀性巴氏杆菌的分离鉴定及药敏分析
2022-01-05王玉恒吉哈利彭燕娟索朗卓嘎于子淇周海娟其美央宗丹真次旦包玉花
王玉恒,吉哈利,彭燕娟,索朗卓嘎,于子淇,邓 愧,周海娟,其美央宗,丹真次旦,包玉花*
(1.西藏自治区兽医生物药品制造厂,西藏 拉萨 850000;2.西藏莲茎生物科技有限公司,西藏 拉萨 850000)
牦牛主要生活在西藏高海拔地区,具有耐严寒、耐疲劳、善于走陡坡险路等优点,对西藏畜牧业发展具有重要作用[1]。近年来,牦牛的细菌病感染率、死亡率逐渐增加,已严重影响到牦牛健康及养殖户经济收入。因此,研究牦牛细菌性传染病非常必要。
多杀性巴氏杆菌是一种两端钝圆、中央微凸的革兰氏阴性短杆菌,能引起牛、羊、鸡、兔等多种动物患急性败血型、炎性出血型等症状为主的传染病。该病主要以呼吸道、消化道、皮肤黏膜损伤及吸血蚊虫叮咬等方式传播。截至目前,对多杀性巴氏杆菌分离鉴定、诊断、治疗以及防控的研究越来越多[2-4]。如1954年廖延雄[5]首次研究了牦牛多杀性巴氏杆菌的培养特性及生化特性;1979年郭大和等[6]从我国水牛、黄牛组织中分离出了多杀性巴氏杆菌,经鉴定均为B型;1985年肖克宇等[7]发现了培养多杀性巴氏杆菌的新方法;1995年魏天文等[8]研究了一种检测实验动物的多杀性巴氏杆菌的ELISA竞争抑制法;2001年Townsend等[9]根据Pm荚膜编码基因设计特异性引物,建立了一套分子生物学的鉴定及分型方法;2016年李春生等[10]研究了青海牦牛A型多杀性巴氏杆菌的分离鉴定;2018年蔡其刚等[11]研究了牦牛出血性败血症的病原分离及鉴定;2019年阚威等[12]在青海病死牛组织中分离出了4株病原菌,并鉴定为荚膜血清A型多杀性巴氏杆菌。本试验对病死牦牛的内脏组织进行了细菌分离,并通过涂片镜检、生化鉴定、荧光定量PCR法对分离细菌株进行鉴定,再利用17种抗菌药物对该细菌株进行药敏分析,以期为该病的诊断、治疗以及防控提供理论依据。
1 材料与方法
1.1 主要试剂
细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;SYBR™ Green Master Mix试剂,购自赛默飞世尔科技(中国)有限公司;胎牛血清,购自北京索莱宝科技有限公司;细菌培养基、细菌微量生化鉴定管、抗菌素药敏片,均购自杭州微生物试剂有限公司;分析纯均为国产。
1.2 主要仪器
荧光定量PCR仪(QS1,赛默飞世尔科技(中国)有限公司),体视显微镜(CX21FS1C,奥林巴斯(广州)工业有限公司),生化培养箱(SHP-300,上海鸿都电子科技有限公司),高速冷冻离心机(TGL16,湖南星科科学仪器有限公司),电热恒温水浴锅(HH-2A,北京科伟永兴仪器有限公司),电子天平(0.001 g)(SY204C,上海佑科仪器仪表有限公司),其余试验耗材均为国产。
1.3 样品来源
样品来源于西藏自治区那曲市安多县某养殖户的一头病死牦牛,无菌采集心脏、肝脏、肾脏、脾脏、喉管及淋巴结等组织样品,共计11份。2020年12月24日送至西藏自治区兽医生物药品制造厂兽医实验室。
1.4 试验方法
1.4.1 病料触片镜检 将采集的病料心脏、肝脏、肺脏、淋巴结等组织的病变部位触片,革兰氏染色,镜检。
1.4.2 病原菌分离及培养 将组织病料接种于含有5%血清的肉汤中进行增菌,37℃条件下培养24 h。再将血清肉汤划线接种于营养琼脂平皿、血清琼脂平皿、麦康凯琼脂平皿和三糖铁琼脂斜面,37℃条件下培养24 h,观察菌落形态。随机挑选单菌落接种于血清肉汤,培养24 h,涂片染色镜检。
1.4.3 生化鉴定 按照细菌微量生化鉴定管说明书,将血清肉汤培养物接种至生化反应管,观察显色反应。结果判定参照《兽医微生物学》中多杀性巴氏杆菌生化鉴定标准,详见表1。

表1 多杀性巴氏杆菌生理生化指标
1.4.4 细菌基因组DNA提取 取纯化后血清肉汤培养物1 ml,参照细菌基因组DNA提取试剂盒说明书进行细菌DNA提取。
1.4.5 引物合成 参考Townsend K M等[9]研究文献,设计多杀性巴氏杆菌鉴定引物,由北京擎科生物科技有限公司合成,引物序列及大小见下表2。
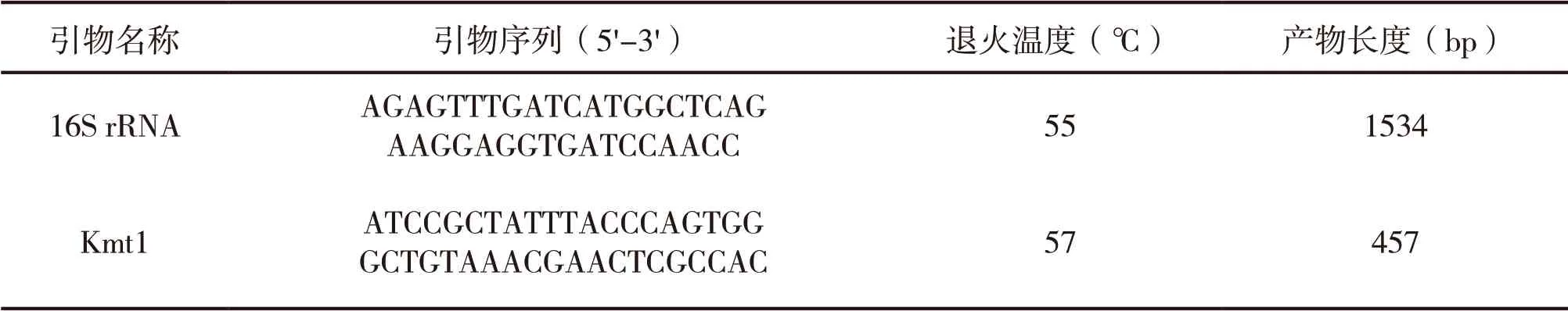
表2 Real-time PCR引物信息
1.4.6 荧光定量PCR反应体系及条件 多杀性巴氏杆菌荧光定量PCR反应体系为20 μl,具体操作如下:SYBR™ Green Master Mix 10 μl,上游引物和下游引物(10 μmol/L)各1 μl,DNA模板1 μl,ddH2O 7 μl。PCR扩增条件:50℃ 2 min,95℃ 2 min,95℃ 15 s,退火温度(表2)15 s,72℃ 1 min,共35个循环,每个循环结束时采集荧光信号;溶解曲线:测量温度为50~95℃。每组样品重复检测3次,分析扩增曲线及扩增溶解曲线。
1.4.7 药敏试验 取已鉴定培养后菌液200 μl滴加至血清琼脂平皿,用无菌涂菌棒涂布菌液,保证涂布均匀。再用镊子取药敏片贴至血清琼脂平皿表面并压平,37℃条件下培养18 h后,测量抑菌圈直径。每种药物3个重复,计算平均值,判定敏感程度。药敏试验抑菌圈直径判定标准见表3。
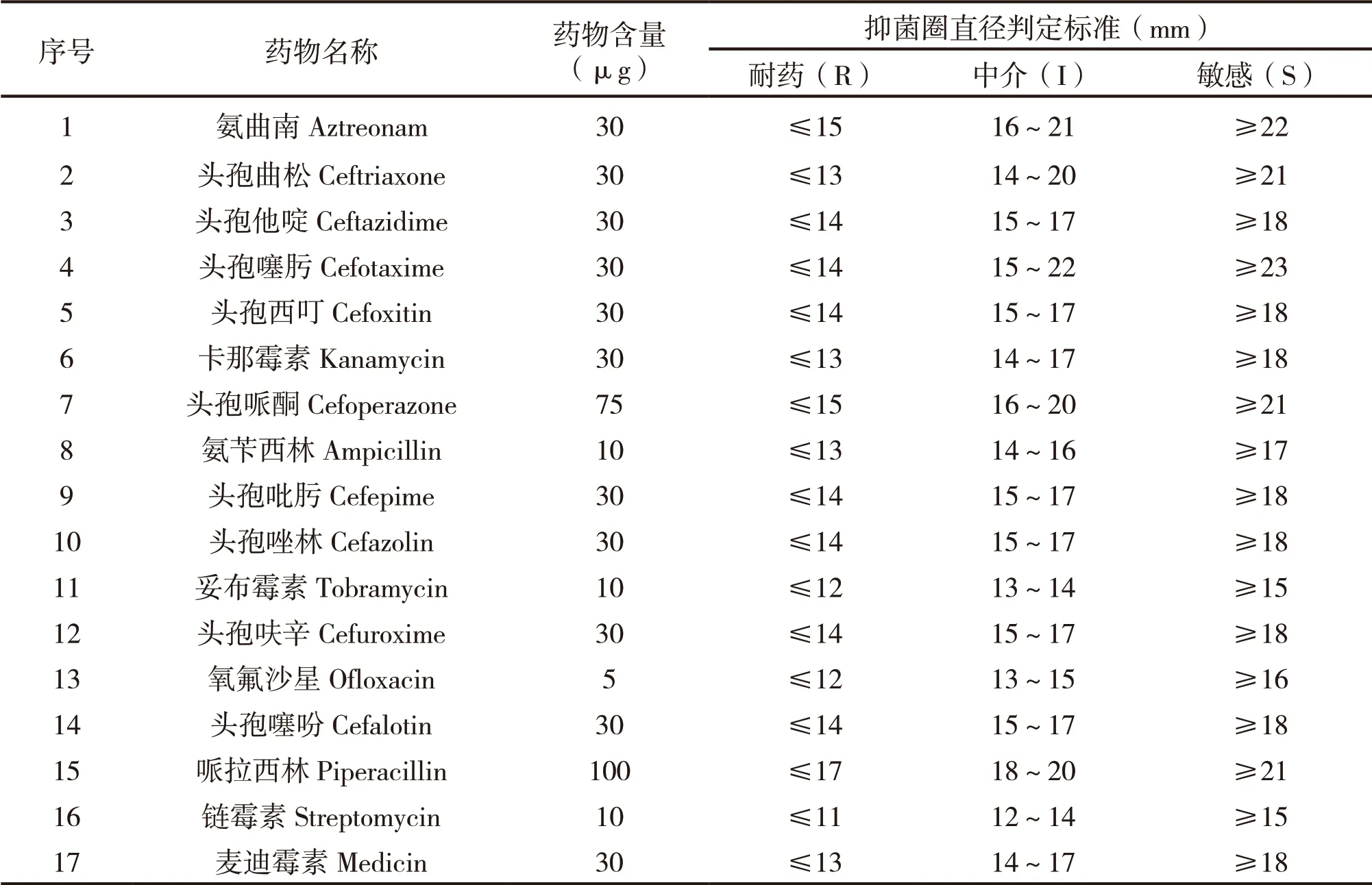
表3 药敏试验抑菌圈直径判定标准
2 结果
2.1 病料镜检结果
在肺脏、肝脏病料组织中,镜检到短小杆菌。经革兰氏染色,结果为革兰氏阴性杆菌,见图1。
图1 病料组织的革兰氏染色
2.2 病原分离培养结果及菌落形态特征
将病料组织的5%血清肉汤培养液接种于血清琼脂平皿,培养24 h,形成了表面光滑、湿润、边缘较整齐的半透明灰白色菌落,无溶血情况;接种于营养琼脂平皿上菌落贫瘠,且直径小于血清琼脂平皿上的菌落;接种于麦康凯琼脂平皿上未见生长;三糖铁琼脂斜面底部变为黄色。挑取血清琼脂平皿上的菌落,涂片镜检为革兰氏阴性短杆菌,见图2。

图2 细菌液的革兰氏染色
2.3 生化鉴定结果
经细菌微量生化鉴定,该细菌株产酸不产气,可分解葡萄糖、蔗糖和甘露醇,不发酵乳糖、麦芽糖,氧化酶、触酶、鸟氨酸脱羧酶、吲哚试验均为阳性,脲酶试验为阴性,表明该细菌株符合多杀性巴氏杆菌生化鉴定标准。
2.4 荧光定量PCR扩增结果
以细菌组DNA为模板,利用荧光定量PCR检测法对多杀性巴氏杆菌鉴定引物进行扩增。由图3、图4可知,Kmt1基因的扩增曲线有明显的S型指数增长曲线,且溶解曲线为单峰;由图5、图6可知,16S rRNA的扩增曲线有明显的S型指数增长曲线,且扩增溶解曲线为单峰。表明该细菌株DNA基因组中能扩增出多杀性巴氏杆菌鉴定基因。
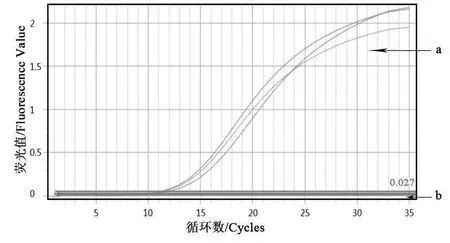
图3 Kmt1基因的扩增曲线
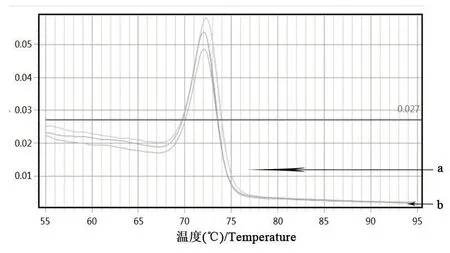
图4 Kmt1基因的溶解曲线

图5 16S rRNA的扩增曲线
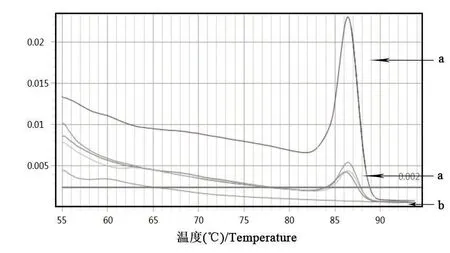
图6 16S rRNA的溶解曲线
2.5 药敏试验结果
药敏试验检测了该细菌株对链霉素、头孢类等17种抗菌药物的敏感程度。由表4可知,该细菌株对头孢曲松、头孢他啶、氧氟沙星、麦迪霉素等13种抗菌药物表现为敏感,对氨曲南、头孢噻肟、哌拉西林、链霉素等4种抗菌药物表现为中介,无抗菌药物表现为耐药。
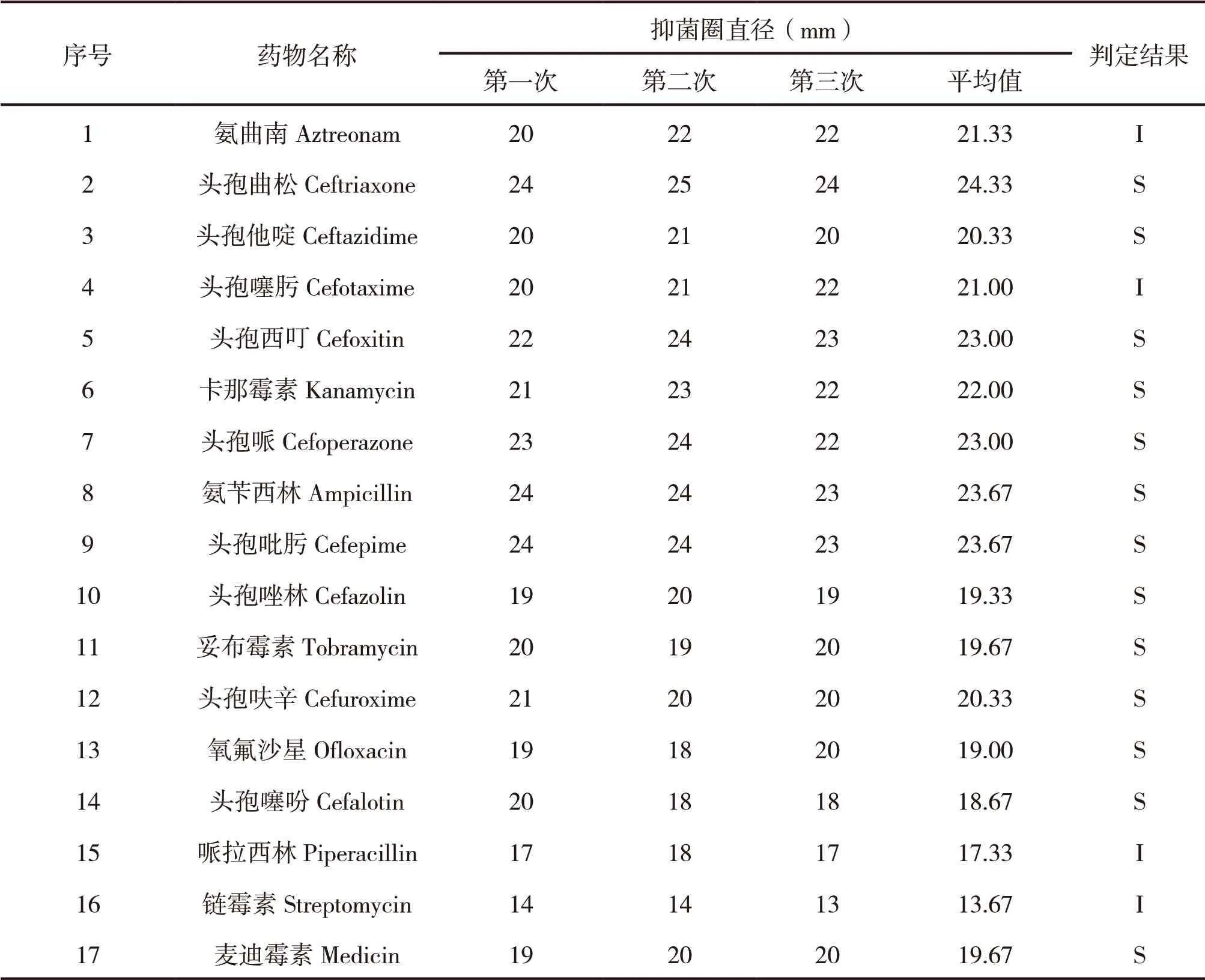
表4 药敏试验结果
3 讨论
受西藏地区空气稀薄、气压低、含氧量少等因素影响,大多数牦牛的呼吸系统易遭受损伤。多杀性巴氏杆菌主要侵袭呼吸系统、局灶性感染以出血性败血症为主要特征,是影响西藏牦牛健康的主要细菌之一。
首先,本研究无菌采取病死牦牛组织样品11份,触片镜检发现大量革兰氏阴性短杆菌,再利用5%血清肉汤培养液复壮,接种于血清琼脂平皿、营养琼脂平皿、麦康凯琼脂平皿等平皿,结果显示该细菌株在血清琼脂平皿可形成表面光滑、湿润、边缘较整齐的半透明灰白色菌落,无溶血情况;在营养琼脂平皿上菌落贫瘠,且直径小于血清琼脂平皿的菌落;在麦康凯琼脂平皿上未见生长;三糖铁琼脂斜面底部变为黄色,菌液镜检为革兰氏阴性短杆菌,因此初步怀疑为巴氏杆菌。
其次,利用微量生化鉴定管对该细菌株进行了生化鉴定,结果显示该细菌株符合多杀性巴氏杆菌生化鉴定标准。
再次,以细菌组DNA为模板,用荧光定量PCR检测法对多杀性巴氏杆菌鉴定引物进行扩增,结果显示该细菌株DNA基因组中能扩增出多杀性巴氏杆菌鉴定基因,进一步表明该细菌株为多杀性巴氏杆菌株。
最后,利用17种抗菌药物对该细菌株进行了药敏分析,结果显示链霉素、头孢类等17种抗菌药物中13种抗菌药物对该细菌株有抑制作用。
4 结论
本试验对病死牦牛内脏组织进行了细菌分离,再通过涂片镜检、生化鉴定、荧光定量PCR法对分离细菌株进行了鉴定,结果表明分离细菌株为多杀性巴氏杆菌株。通过药敏试验发现,头孢曲松、头孢他啶、氧氟沙星、麦迪霉素等13种抗菌药物对该细菌株有显著抑制作用,但其抑菌机理还需进一步研究。对氨曲南、头孢噻肟、哌拉西林、链霉素等4种抗菌药物表现为中介,无抗菌药物表现为耐药。
