银腺杨PagAG2 基因的时空表达分析
2022-01-05钟姗辰武舒王黎苏晓华张冰玉
钟姗辰,武舒,王黎,苏晓华,张冰玉
(林木遗传育种国家重点实验室,国家林业和草原局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091)
杨属(PopulusL.)植物分布广泛,不仅具有较高的经济和生态价值,同时也是木本模式植物,在林木分子生物学研究等方面具有重要作用。然而,作为北方城市重要的道路绿化和城市景观树种,杨树在提高城市绿化水平的同时,也因其花粉在每年春季大量飘散而引起了一定的植源性污染问题。杨树雄株散落的花粉以空气为传播媒介,通过人体呼吸及皮肤接触造成呼吸道疾病和皮肤过敏等问题,危害着人体健康[1-3]。除更换树种外,目前关于花粉污染的应对策略主要还包括人工喷水增湿、增强地表对花粉的吸附能力等。另外,日益发展的生物技术推动了林木遗传育种进程,有望成为解决花粉等植源性污染的有效途径之一。目前关于杨树的研究主要聚焦于其材性及抗逆性等方面,而对杨树的生殖发育研究相对较少。
杨树童期较长且雌雄异株,不同于大多数由萼片、花瓣、心皮(雌蕊/雄蕊)、胚珠4 轮结构组成的被子植物花,杨树的雌花和雄花均高度简化,其中,雄花着生于苞片腋间,由退化的盘状花被和雄蕊构成,花药为黄色或红色,一般情况下药隔无明显突出[4]。花药为四孢型,成熟的花药壁由一层表皮、一层内层、两层中层和单层绒毡层组成。表皮宿存,内层发育成纤维状增厚,中层是短命的,其中一层在小孢子阶段变为扁平,最后被挤碎,另一层则在花药开裂前解体;绒毡层细胞早期是单核的,而当花粉母细胞减数分裂时则成为双核或多核的,它们在花粉单核时期开始退化,至双核期消失[5]。杨树性别特异的花器官发育是一个复杂的过程,但与其他被子植物花发育类似,杨树的花发育也分为开花诱导、花的发端和花器官发育3 个受众多基因调控的复杂过程,且它们具有相似的花器官特性基因[6]。
随着研究的不断深入,花器官形成的相关理论逐步完善,由最初的“ABC”模型假说发展成为“ABCDE”模型及四聚体模型,其中,A类和E类基因决定花萼特征,A、B 和E类基因一起调控花瓣发育,B、C 和E类基因共同决定雄蕊发育,C类和E类基因决定心皮发育,D类和E类决定胚珠发育[7-8]。杨树花发育的相关器官特异性基因的作用不全同于其他开花植物,近年来调控杨树花器官发育的多个ABCDE类基因功能被解析,如:A类基因中的AP1同源基因PTM1、PTM2和B类基因中的AP3同源基因,它们在杨树雌/雄株中的表达有所差异,可能参与了杨树的性别决定[9-10];B类基因中的PI的同源基因PdPI和C类基因PTAG1和PTAG2,与杨树花发育密切相关并且可能影响营养器官的形成和发育[6,11-12];E类基因中的PTM3、PTM4及PTM6,在杨树雌/雄株中花发育过程中持续表达,在胚珠、花药原基中有着非常高的表达量[13]。
AGAMOUS(AG)是MADS-box 基因中研究较为充分的一类基因,属于植物特有的MIKC 型C类MADS-box 基因,包括euAG/PLENA(PLE)谱系和AGAMOUS-like11(AGL11)谱系,可与其他基因互作共同控制雄蕊及心皮的发育[8,14-17]。在拟南芥中,AG可控制拟南芥花发育后期的花粉形成[18-20]。另有研究表明,在拟南芥AG突变体的花器官四轮结构中出现了第三轮结构(雄蕊)转化为花瓣、第四轮结构(心皮)发育成一个新的花的情况,而第一、二轮的花结构(萼片及花瓣)与野生型拟南芥花器官并无差异[21-23]。另外,抑制AG会导致菠菜雄性不育[24]。而AGAMOUS(AG)及其同源基因在单性花发育的研究中鲜有报道,在毛果杨雌株中,AG(PtAG1及PtAG2)和STK(AGL11)基因在杨树种毛发育中表现出较强的功能保守性,共同抑制种毛的形成[12],而该基因在杨树雄花花发育中的作用尚无报道。
本研究基于AG2在被子植物花器官的决定作用,对银腺杨‘84K’(Populus alba×P.glandulosa‘84K’)PagAG2基因时空特异性进行了检测,为进一步研究其在杨树雄花花发育中的功能,进而有针对性地对杨树生殖发育进行调控奠定基础。
1 材料和方法
1.1 试验材料及相关试剂
银腺杨‘84K’(Populus alba×P.glandulosa‘84K’)花序于2019 年2月22 日采自北京市中国林科院内(115.7°~117.4° E,39.4°~41.6° N),组培材料生长于温度25℃、光强2300 Lx、光周期16 h/8 h 的组织培养间中;RNA 提取试剂盒购自Aidlab 公司(北京);Premix TaqTM 酶购、反转录试剂盒、qRT-PCR 试剂盒均购自Takara 公司(日本);固定液由50%FAA 固定液100 mL、无水乙醇50 mL、37%甲醛溶液10 mL、冰乙酸5 mL加DEPC·H2O 定容至100 mL;RNA 预杂交液/杂交液由20×SSC 30 mL、50×Denhardt's 10 mL、10%SDS 5 mL、10 mg·mL−1Salmon DNA 1 mL、Formamide(甲酰胺)50 mL、ddH2O 4 mL,充分混匀后使用0.45 μm 滤膜去杂质后使用;抗荧光淬灭封片剂购自生工生物公司(上海)。
1.2 方法
1.2.1 银腺杨‘84K’雄花的水培及石蜡切片制作 取‘84K’杨越冬花枝,2019 年2月22 日置于温室水培(0 d),每日更换一次水。对水培后1 周内的花序连续采样(0、3、4、5、6、7 d),置于PBS 固定液中立即真空抽气固定,并依次完成脱水、透明、浸蜡、包埋、修块、切片、粘片、脱蜡步骤,以番红—固绿法染色[25]。染色完成染色后,在光学显微镜(OLYMPUS 公司(BX51)产品)下观察、拍照记录。
1.2.2 实时定量PCR(qRT-PCR)分别提取‘84K’杨组培苗的根、茎、叶及水培后2 周内的花序连续采样(水培后0、3、4、5、6、7 d 的花序)的总RNA,并反转录合成cDNA。使用荧光定量PCR 仪(Roche 公司(Light Cycle 480Ⅱ)产品)进行qRT-PCR 反应,反应体系为cDNA 模板2 μL,Primer-F(10 μmol·L−1) 0.8 μL,Primer-R(10 μmol ·L−1) 0.8 μL,XTB Green Premix TaqII(TliRNaseH Plus,2×)10 μL,ddH2O补足至20 μL。其扩增条件为预变性95℃,30s;变性95℃,5s,退火60℃,30s,40个循环;熔解曲线为95℃ 5 s,65℃ 1 min。以Actin为内参基因,每个样品进行3 次重复,用2−ΔΔCT算法进行分析[26],引物见表1。

表1 qRT-PCR 表达分析引物Table 1 Primers used in qRT-PCR analysis
1.2.3 荧光原位杂交(FISH)基于碱基互补的原则,利用荧光原位杂交技术将细胞原位杂交技术和荧光技术有机结合,用荧光素标记的已知外源RNA 作探针,与‘84K’杨雄花组织切片杂交,与待测核酸的靶序列专一性结合,通过检测杂交位点荧光来显示PtAG2核苷酸序列在‘84K’杨雄花中的位置。根据待检测目的基因序列,采用Primer Premier 6.0软件设计,并用探针合成仪器(UNICORN 5.31,沃特曼)合成RNA 探针(表2),荧光素标记反义RNA 核酸探针,以正义RNA 探针为阴性对照。将‘84K’杨雄花序样品放入配制好的固定液(50%FAA 固定液100 mL、无水乙醇50 mL、37%甲醛溶液10 mL、冰乙酸5 mL,加DEPC·H2O 定容至100 mL)中固定12 h 后经梯度酒精脱水后浸蜡、包埋、切片(SQ2125,徕克公司)、摊片(PPTHK-21B,徕克)、捞片,62℃烤箱烤片2 h。石蜡切片脱蜡后,将切片于修复液中煮沸10~15 min,自然冷却。滴加蛋白酶K(20 ug·mL−1)37℃消化,纯水冲洗后PBS 洗3 次,每次5 min。滴加预杂交液,37℃于杂交仪(S500-24,Thermo-Brite)孵育1 h。倾去预杂交液,滴加探针杂交液,置于恒温箱57℃度杂交过夜。洗去杂交液,2×SSC,37℃洗10 min,1×SSC,37℃洗2 次,每次5 min,0.5×SSC 室温洗10 min。切片滴加DAPI 染液,避光孵育8 min,冲洗后滴加抗荧光淬灭封片剂(Anti-Fade Mounting Medium,生工)封片,置于荧光显微镜下(CX41,OLYMPUS)观察并采集图像(紫外激发波长330~380 nm,发射波长420 nm,发蓝光;FAM(488)绿光激发波长465~495 nm,发射波长515~555 nm,发绿光;CY5 红光激发波长510~560 nm,发射波长590 nm,发红光)。所有试剂、仪器均需DEPC 处理。
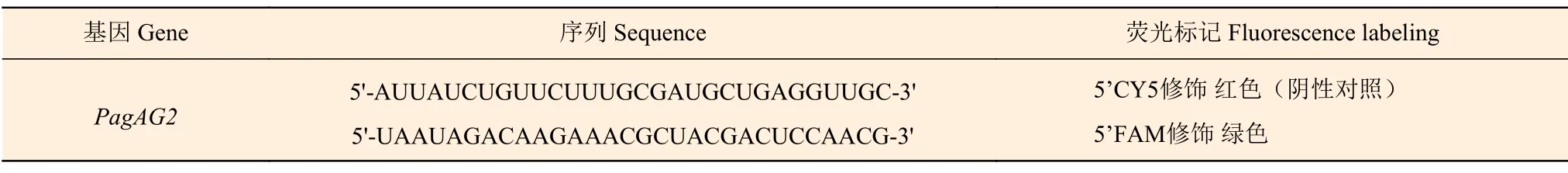
表2 RNA 探针序列Table 2 RNA probe sequences
2 结果与分析
2.1 杨树雄花发育形态学观察
杨树雄花为柔荑花序,着生于苞片腋间,雄蕊被退化的盘状花被所包围。‘84K’杨越冬花枝自水培之日(0 d)起,其雄花花芽迅速膨大并将苞片撑开,整个花序覆有白色绒毛(3 d),第4 天可见红色花药,之后整个花序继续伸长,随着花药的成熟花药颜色由红转为黄,由于花发育的顺序由下向上,花序轴上端的花和下部的花的发育时期相差较大,雄花开始有部分花粉散出,至7 d 时,花粉大量散出,苞片脱落。水培后第0、3、4、5、6、7 天的花序度(3 个样品)测量均值分别为0.8、2.5、3.1、3.7、6.5、8 cm(图1)。

图1 ‘84K’杨雄花序Fig.1 Male inflorescences of Populus alba×P.glandulosa ‘84K’
从石蜡切片结果看出:取样时杨树雄花花药中的单倍体的小孢子已从四分体中释放,游离于花粉囊中,取样0~7 d 随花药横切面增大,纤维状带逐渐展开,绒毡层浓缩继而解体,中层降解,至7 d 时药隔每侧的2 个花粉囊互相连通,待花粉囊开裂出现花药裂口,成熟的花粉依而从花粉囊内散出而传粉(图2)。

图2 ‘84K’杨雄花花药切片Fig.2 Anther section of Populus alba×P.glandulosa ‘84K’
2.2 PagAG2 在‘84K’杨雄花序不同发育时期及营养器官的表达分析
利用qRT-PCR 技术检测了PagAG2在‘84K’杨不同器官及其雄花花序不同发育时期的表达差异。结果表明,PagAG2在雄花发育的过程中,水培后1 周内的花序样品中PagAG2的表达量逐渐升高后降低,6 d 达到顶峰(图3A),之后回落,7 d 可见PagAG2降至整个观察期最低,药隔两侧花粉囊互相连通、花粉成熟将大量散开花粉,这一过程十分迅速,PagAG2基因与杨树雄花花发育密切相关。然而,值得注意的是,PagAG2在根、茎、叶这些营养器官中也有一定表达(图3B),并且在茎中的表达量高于根和叶,但均低于整个观察期的雄花。

图3 PagAG2 在‘84K’杨雄花序(A)及营养器官(B)中的表达检测Fig.3 Expression of PagAG2 inPopulus alba×P.glandulosa ‘84K’
2.3 PagAG2 在‘84K’杨雄花中的原位表达
通过原位杂交的技术手段检测了PagAG2在杨树雄花中的具体表达部位。用PagAG2特异性探针对‘84K’杨雄花花序进行原位杂交,洗脱后,其荧光显微镜镜检拍照结果见图4。在样本中可以清晰地观察到亮绿色杂交信号覆盖整个视野中的花序组织,而红色阴性对照仅出现在花药周围的花被组织。PagAG2在‘84K’杨雄花花药中特异性表达。

图4 PagAG2 在‘84K’杨雄花中的原位杂交分析Fig.4 In situ hybridization analysis of PagAG2 expression in male flowers Populus alba×P.glandulosa ‘84K’
3 讨论
杨树花发育过程涉及大量的基因调控,C类基因AG编码的MADS-box 转录因子在其中起着关键作用,包括终止花分生组织的生成、调控雄蕊/心皮/胚珠的发育,并与A类基因相互拮抗[27-31]。Brunner 等[11]的研究表明,PtAG2在毛白杨雌株和雄株中的表达模式一致,表明它们不太可能在功能上与树的性别相关,但却对杨树雌/雄花相关组织的形成和发育有着重要作用。本试验中,PagAG2在‘84K’杨雄花花序中的表达具有时空特异性。通过实时定量PCR 检测水培后0~7 d 的‘84K’杨雄花花序PagAG2基因表达量,时间上PagAG2在花组织中的相对表达量先增加后降低,从对应的雄花花序外部形态及石蜡切片上看,其表达量是随着雄花花序发育而逐渐升高,在花药成熟时达到顶峰,并在花粉成熟散落后降低。另外,本试验通过实时定量检测了PagAG2‘84K’杨根、茎、叶的表达量,利用荧光原位杂交展现了PagAG2花序中的表达部位,空间上PagAG2的转录水平在杨树花序表达量高于营养器官,并且花粉为PagAG2在花序中具体表达部位,在花序中的整个花药均有表达。PagAG2表达与‘84K’杨雄花发育密切相关,有望作为基因工程改良杨树花粉的目标基因。植物生殖发育的整个过程在一定程度上均受到MADS-box 基因调控[32]。另外,已有研究表明,MADS-box 蛋白在杨树营养器官生长发育中也发挥重要作用,如杨树SVL参与营养芽休眠过程,PTM5、ADF、LRR、FPF1被证明能够调控木质部的形成等[9,33-37]。目的基因PagAG2除可能参与杨树雄花花发育,还可能参与杨树营养组织的生长发育调控。实时定量PCR 试验中,‘84K’杨幼期根、茎、叶营养组织中也检测到了PaAG2转录物,但其转录水平低于试验材料自水培日起到花粉成熟并大量散落的整个观察期的花组织。已有研究表明,AG表达的水平对于确定器官身份是重要的[38],AG的表达受其它基因的调节,如CURLY LEAF能够阻止营养期AG在叶中表达[39],Brunner 等[11]推测,PtAG2营养表达可能是杨树中不太严格的抑制控制的结果,但该基因是否参与杨树其他组织的某些生长发育调控,需要对其做进一步的基因功能分析。
杨树基因组几乎包含了拟南芥所有调控开花的主要同源基因[40-41],在对模式植物拟南芥的研究中,发现了促进花器官发育的多聚MADS-box 蛋白复合物的形成。MADS-box 蛋白以二聚体的形式与下游靶基因结合,实现对拟南芥生长发育的调控作用,如AG、AP2和AGL1在拟南芥中能够形成同源二聚体蛋白共同决定花器官特性[42-43]。随着研究的深入又提出了四分子模型,即2 个MADS 蛋白形成二聚体,又分别与靶基因结合后形成蛋白四聚体,共同对花器官的建成起作用,四聚体PIAP3-SEP3-AG 控制雄蕊的分化,过表达PI-AP3-SEP3-AG 植物的营养叶转化为雄蕊状器官[44],这也为其他物种中MADS-box 基因相关调控机理的研究提供了参考,杨树PagAG2也可能与其他它因形成多聚体,共同实现复杂的调控作用。
4 结论
本研究对‘84K’杨PagAG2基因的表达模式进行了研究。时间上PagAG2表达量随着花粉成熟先增加后降低,空间上PagAG2在杨树花序表达量高于营养器官,并且花粉为PagAG2在花序中具体表达部位,PagAG2与‘84K’杨雄花花发育密切相关,有望作为基因工程改良杨树花粉的目标基因,而PagAG2的转录物在杨树幼期根、茎、叶组织中也能被检测得到,其是否参与杨树其他组织的生长发育调控,在相关育种工作中需要对该基因做进一步的基因功能分析,以便利用基因编辑等技术沉默杨树花发育相关基因PagAG2,产生对营养生长无副作用的少花粉、无花粉表型,从而为从源头上解决杨树花粉过敏的问题提供一种有效途径。
