麻疯树JcBRL3 基因的克隆及在花发育过程中的功能分析
2022-01-05陈雨倩雷世康徐刚
陈雨倩,雷世康,徐刚*
(1.贵州大学贵州省森林资源与环境研究中心/贵州省高原山地林木培育重点实验室/林学院,贵州 贵阳 550025;2.西南大学生命科学学院,重庆 400715)
油菜素内酯(BR)是一类甾醇类植物激素,在很低的浓度下即可表现出很强的生理生化效应[1],能参与调控植物生长发育和逆境胁迫等许多重要的生理过程[2]。BRI1(brassinosteroid insensitive 1)作为BR 的受体,在BR 信号转导中起重要作用。BRI1 属于富含亮氨酸重复类受体激酶(LRRRLK),其结构主要由胞外区、跨膜区和胞内激酶区3 部分组成[3],其中,胞外区包括1 个亮氨酸拉链基序,1 个N 端信号肽,25 个富含亮氨酸重复单位(LRR)以及在第21 和第22 个LRR 之间有一个由70 个氨基酸组成的ID(island domain)结构[4-5],该结构是BR 的识别区域[6];而BRI1-like3(BRI1-like receptor genes 3)作为BRI1 蛋白家族成员,也参与了BR 信号识别转导过程[7-8]。
研究发现,BRI1 在植物花发育上有着重要的作用,Nie 等在番茄(Solanum lycopersicumL.)中过表达了SlBRI1基因,结果发现番茄花变大且花瓣和花柱变长[9];Singh 等发现,小麦(Triticum aestivumL.)TaBRI1基因在拟南芥(Arabidopsis thalianaL.)中过表达会导致转基因拟南芥提前开花[10];雷世康等发现,麻疯树(Jatropha curcasL.)油菜素内酯受体基因JcBRI1介导的BR 途径可能对麻疯树雌花发育有一定的促进作用[11]。然而,目前关于BRL3 参与花发育方面的研究还未见报道。
麻疯树果实含油率高达60%,是最具潜力的生物柴油原料树种[12]。然而,由于麻疯树结实少、种子产量低等原因严重阻碍了其大规模种植和发展,而雌雄花比例低(约为1/30~1/10)是导致麻疯树结实少的重要原因之一[13]。本研究从麻疯树花蕾转录组数据中筛选到了一个性别差异表达的油菜素内酯受体蛋白基因BRI1-like3(BRL3),利用RACE PCR 技术获得了JcBRL3基因的全长cDNA;通过LC-MS/MS 技术鉴定了JcBRL3的原核表达产物(蛋白质);通过在线软件对JcBRL3 蛋白的结构进行了生物信息学分析;通过qRT-PCR 技术分析了该基因在麻疯树花发育过程中的表达模式,并通过该基因的转基因烟草对其功能进行了初步验证。
1 材料与方法
1.1 试验材料
本研究材料为贵州省黔西南州贞丰县采集而来麻疯树花蕾,收集完花蕾样品后将其放进非冻型组织RNA 保护液中。将不同时期的麻疯树花蕾在4℃平衡48 h 后分成9类,分别为性别未分化时期、雌花大孢子母细胞时期、雌花大孢子母细胞分裂期、雌花单核胚囊期、雌花胚囊成熟期、雄花小孢子母细胞时期、雄花四分体时期、雄花单核花粉粒时期以及雄花花粉粒成熟期[11],随后放入−80℃超低温冰箱中保存备用。
1.2 试验方法
1.2.1 总RNA 提取及JcBRL3基因全长cDNA 克隆 麻疯树总RNA 的提取参照Plant RNA Kit(OMEGA)说明书进行。采用SMARTer®RACE 5′/3′ Kit(Clontech)试剂盒进行5′/3′ RACE 扩增,引物见表1。PCR 产物用NuceloSpin Gel and PCR Clean-Up Kit(TaKaRa)胶回收纯化后与pUC19载体连接,利用In-Fusion®HD Cloning Kit(TaKaRa)进行转化,筛选阳性克隆于生工生物工程股份有限公司(上海)测序验证。将测序成功的5′cDNA 片段、3′cDNA 片段和已知中间片段通过DNAMAN软件拼接,从而获得JcBRL3基因全长cDNA 序列。

表1 本研究所用引物及其序列 Table 1 Primers sequences and ways of use in this study
1.2.2 原核表达载体构建及诱导表达 使用限制性内切酶Hind III 和NdeI 对目的基因ORF 与原核表达载体pET-30a(+)进行双酶切,经胶回收纯化连接后转化到Escherichia coliDH5α 感受态细胞中。提取阳性菌株质粒进行测序验证,将测序正确的重组载体(pET-30a-JcBRL3)分别转化到E.coliBL21(DE3)和E.coliRosetta(DE3)感受态细胞中。挑取单克隆接种于含卡那霉素(50 μg·mL−1)的LB 液体培养基中过夜培养,其中,E.coliRosetta(DE3)中需再加入氯霉素(20 μg·mL−1)。次日以1:100 的体积比接种到LB 液体培养基中(抗生素与之前相同),待OD600为0.5~0.8 时,向液体培养基中加入IPTG(终浓度为0.1 mmol·L−1),分别置于15℃和37℃下进行培养,培养时间均为16 h,诱导JcBRL3 重组蛋白的表达,再用SDSPAGE 电泳对重组蛋白的表达进行检测。
1.2.3 蛋白质质谱分析及鉴定 将SDS-PAGE 凝胶的目的条带切下装入离心管中,经脱水脱色后使用胰蛋白酶于37℃水浴过夜酶解,之后提出肽段制成冻干粉。取5 μL 含0.1%TFA 的溶液将干粉重新溶解,再按1:1 的比例与α-氰基-4-羟基肉桂酸饱和溶液混合(含50%ACN 和1%TFA),制成上样液,取1 μL 样品进行质谱点靶鉴定[11]。质谱数据分析和蛋白鉴定采用Mascot 2.1(Matrix S cience)软件进行。
1.2.4 JcBRL3 蛋白结构分析 利用在线工具分别对麻疯树JcBRL3 蛋白的信号肽(SignalP 4.1 Server)、跨膜结构(TMHMMServerV.2.0)、磷酸化位点(NetPhos3.1Server)、二级结构(GOR4)、三级结构(SWISS-MODEL)以及保守结构域(NCBI-CDD)进行预测和分析。利用Uniport 数据库检索JcBRL3 蛋白,通过Clustal X 软件对与JcBRL3 蛋白含相同结构域的同源蛋白进行多重比对分析。通过MEGA 6.0 软件的邻接法(Neighbor-Joining),Poissoncorrection 模型,Bootstrap 检验为1 000 来构建系统发育树。
1.2.5JcBRL3在花发育过程中的表达分析 按照Plant RNA Kit(OMEGA)试剂盒说明书分别提取麻疯树花蕾9 个关键发育时期的RNA,对RNA 浓度和质量进行检测后,取等量RNA 反转录形成cDNA。所用荧光定量PCR 引物见表1。以麻疯树花蕾未分化时期为对照组,以β-Actin和Tubulin为内参基因,每个样品设置3 个技术重复与3 个生物重复,相对表达量采用2−ΔΔCT法计算,再利用SPSS20.0 软件对数据进行单因素方差分析(Oneway ANOVA)。
1.2.6JcBRL3基因过表达载体的构建通过Golden Gate assembly 技术构建JcBRL3基因ORF与载体pBWA(V)KS-ccDB 的植物过表达载体。通过冻融法将pBWA(V)KS-BRL3 质粒转化到根癌农杆菌LBA4404 感受态细胞,涂板于含卡那霉素(50μg·mL−1)和利福平(20μg·mL−1)的YEP 固体培养上,挑取阳性菌落测序验证。将测序正确的农杆菌菌液划线培养,挑取单菌落接种于YEP 液体培养基中过夜培养,第2 天取1 mL 菌液加入到50 mL YEP 液体培养基中,当OD600培养到0.4~0.7 时,将菌液转移到离心管中,离心收集菌体。
1.2.7 叶盘法转化烟草及转基因烟草的分子检测 用MS 重悬液重悬农杆菌,再通过叶盘转化法将目的基因转入烟草K326,之后置于培养基中培养到烟草幼苗形成,再对其进行移植。分别提取野生型烟草和转基因烟草的DNA 与RNA,进行PCR 与RT-PCR 检测,判断目的基因是否整合至烟草抗性植株基因组中以及能否在烟草体内转录成功,检测所用引物见表1。
1.2.8 烟草花粉粒电镜扫描观察 采集2 株野生型及3 株转基因烟草处于散粉期的花药,每株3 个(共15 个),经戊二醛和锇酸双重固定、脱水干燥、对花粉粒喷金处理后于扫描电镜(SU8100)下观察拍照并计算花粉粒畸形率。
2 结果与分析
2.1 麻疯树JcBRL3 基因cDNA 全长序列的克隆
利用RACEPCR技术获得JcBRL3基因的5'RACE 和3'RACE 片段(图1),经拼接得到cDNA全长4755bp,该基因的开放阅读框(ORF)为3618 bp,编码1 205 个氨基酸,分子量为130.71 kDa,等电点(pI)为6.06(GenBank登录号:MG879232)
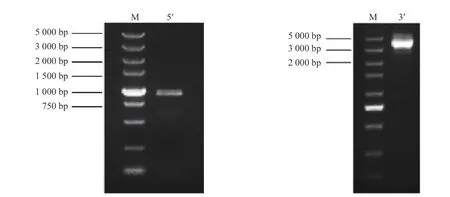
图1 麻疯树JcBRL3 基因RACE PCR 电泳检测Fig.1 The JcBRL3 gene of Jatropha curcas RACE PCR electrophoresis detection
2.2 原核表达载体构建及诱导表达分析
将构建好的原核表达载体pET-30a(+)-JcBRL3 转化到E.coliBL21(DE3)与E.coliRosetta(DE3)感受态细胞中,在15℃与37℃温度下诱导16 h 后,离心收集菌体进行SDS-PAGE 分析。结果表明:JcBRL3 蛋白大约在80 kDa 左右出现目的条带,与预测的蛋白理论分子量几乎一致,说明JcBRL3基因在E.coliBL21(DE3)与E.coliRosetta(DE3)中均可成功表达,且在相同的诱导时间,15℃与37℃不同的诱导温度下,JcBRL3蛋白有同样的表达情况(图2)。
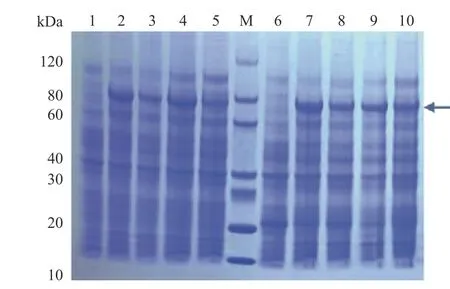
图2 pET-30a-JcBRL3 重组蛋白的SDS-PAGE 检测Fig.2 SDS-PAGE detection of pET-30a-JcBRL3
2.3 麻疯树JcBRL3 蛋白质质谱鉴定
质谱鉴定结果表明:JcBRL3 在原核表达系统得到表达,共有16 条特异的肽段与JcBRL3 蛋白(A0A067KCE7)氨基酸序列相匹配(表2),序列覆盖率达到了100%,蛋白分子量为84.7 kDa,蛋白得分为615,这表明JcBRL3基因的表达产物就是JcBRL3 蛋白(A0A067KCE7)。
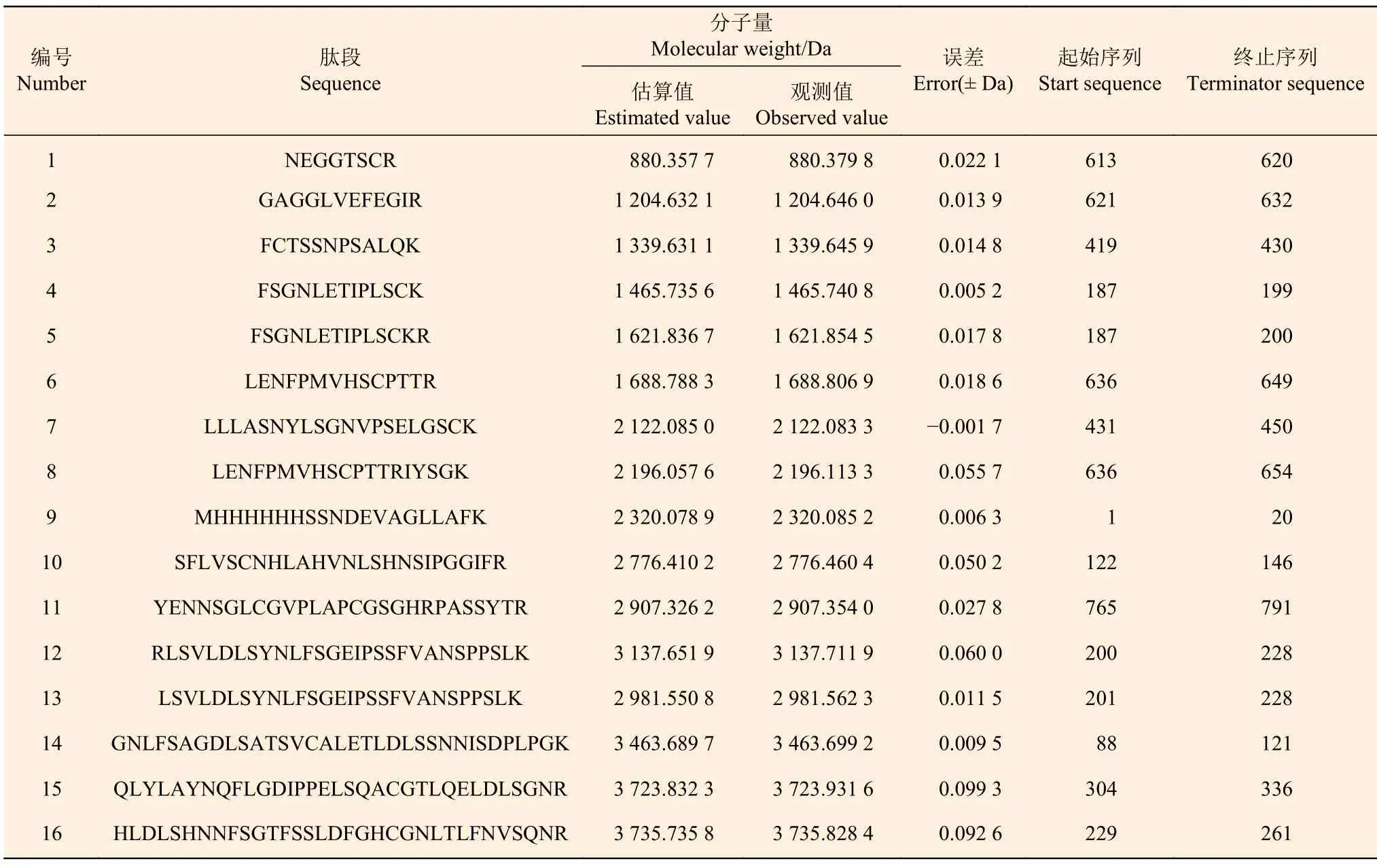
表2 16 条匹配肽段 Table 2 16 matched peptide segments
2.4 麻疯树JcBRL3 蛋白结构分析
信号肽预测结果表明:JcBRL3 蛋白存在信号肽结构,切割位点位于第24 位与第25 位氨基酸之间(图3A)。跨膜结构预测结果表明:JcBRL3 属于跨膜蛋白,具有1 个跨膜区,位于第813 至第835 氨基酸处,推测该蛋白可能定位至细胞膜上,作为膜受体蛋白参与信号转导(图3B)。磷酸化位点分析表明:JcBRL3 蛋白有101 个丝氨酸(Ser)、9 个酪氨酸(Tyr)和21 个苏氨酸(Thr)磷酸化位点(图4A)。Uniport 数据库分析表明:JcBRL3蛋白结构域位于898~1 175 位氨基酸之间,为丝氨酸/苏氨酸(Serine/Threonine Kinase)活性位点蛋白激酶家族成员。蛋白二级结构分析发现:JcBRL3蛋白二级结构主要为无规则卷曲和α 螺旋,α 螺旋占比25.06%,无规则卷曲占比56.27%,延伸链占比18.67%。(图4B)。蛋白三维结构分析发现:JcBRL3 蛋白的三维结构呈弯曲螺旋管状,是个同源二聚体,以同源二聚体的形式行使功能(图4C)。
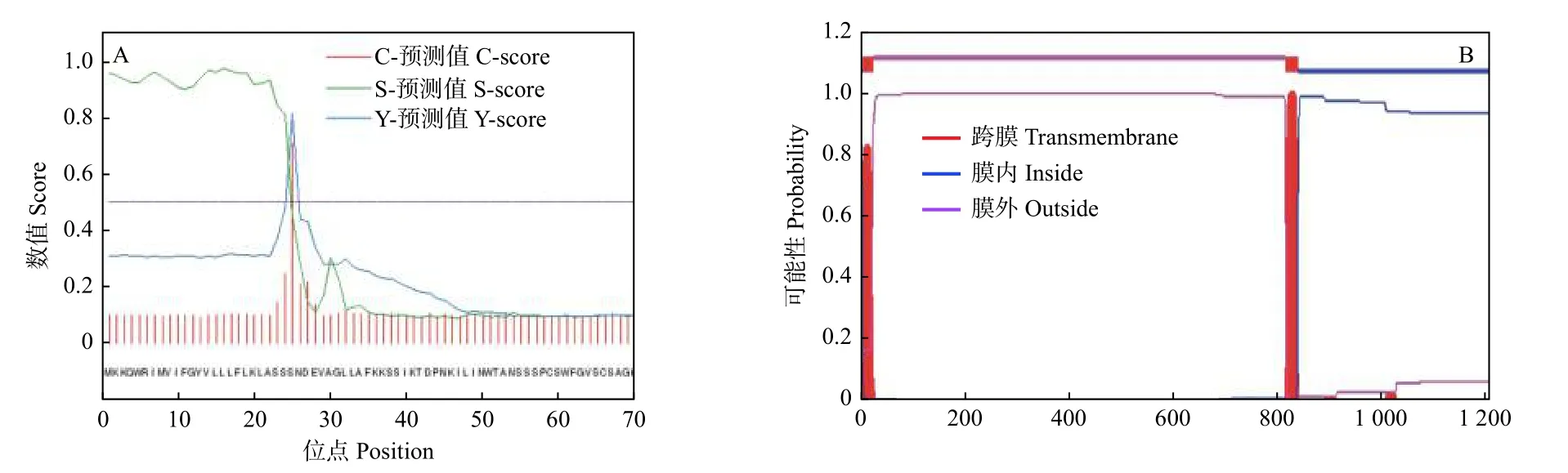
图3 JcBRL3 蛋白信号肽(A)和跨膜结构(B)预测Fig.3 Signal peptide (A) and transmembrane structure (B) prediction of JcBRL3 protein
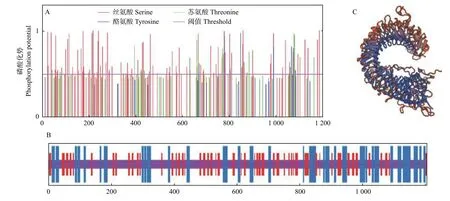
图4 JcBRL3 蛋白磷酸化位点(A)、二级结构(B)和三级结构预测图(C)Fig.4 Prediction of phosphorylation site (A),secondary structure (B) and tertiary structure (C) of JcBRL3 protein
氨基酸序列分析表明:JcBRL3 蛋白含有多个富含亮氨酸重复序列(LRR),并且具有保守重复序列:LxxLxLxxN/CxL,属于富含亮氨酸重复序列类受体蛋白激酶(LRR-RLK)(图5)。对其功能域氨基酸序列多重比对分析发现:JcBRL3蛋白与蓖麻(Ricinus communisL.)和亚洲棉(Gossypium arboreumL.)的BRI1 蛋白相似性分别达94.6%和93.5%,与油桐(Vernicia fordii)的一个LRR-RLK 相似性高达96.8%,表明JcBRL3蛋白可能与它们具有相似的结构(图6)。此外,系统发育树结果显示:JcBRL3 与油桐的一个LRRRLK 蛋白聚集在同一个分支上,表明二者具有较高的同源性(图7)。
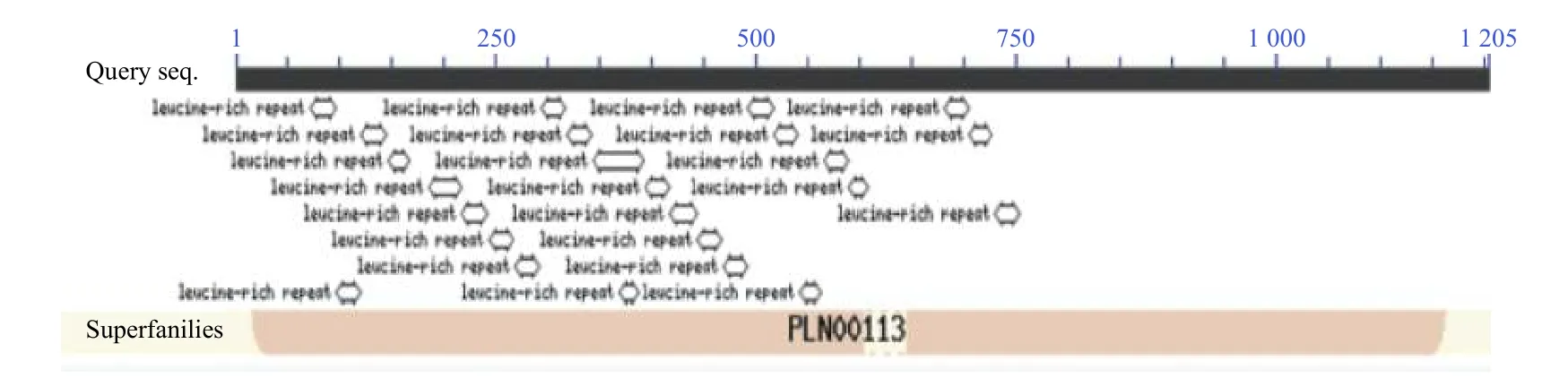
图5 JcBRL3 蛋白保守结构域Fig.5 Conserved domain of JcBRL3 protein

图6 麻疯树JcBRL3 蛋白结构域与其他植物的多序列比对结果Fig.6 Multiple sequence alignment of the JcBRL3 protein domain of Jatropha curcas and other plants
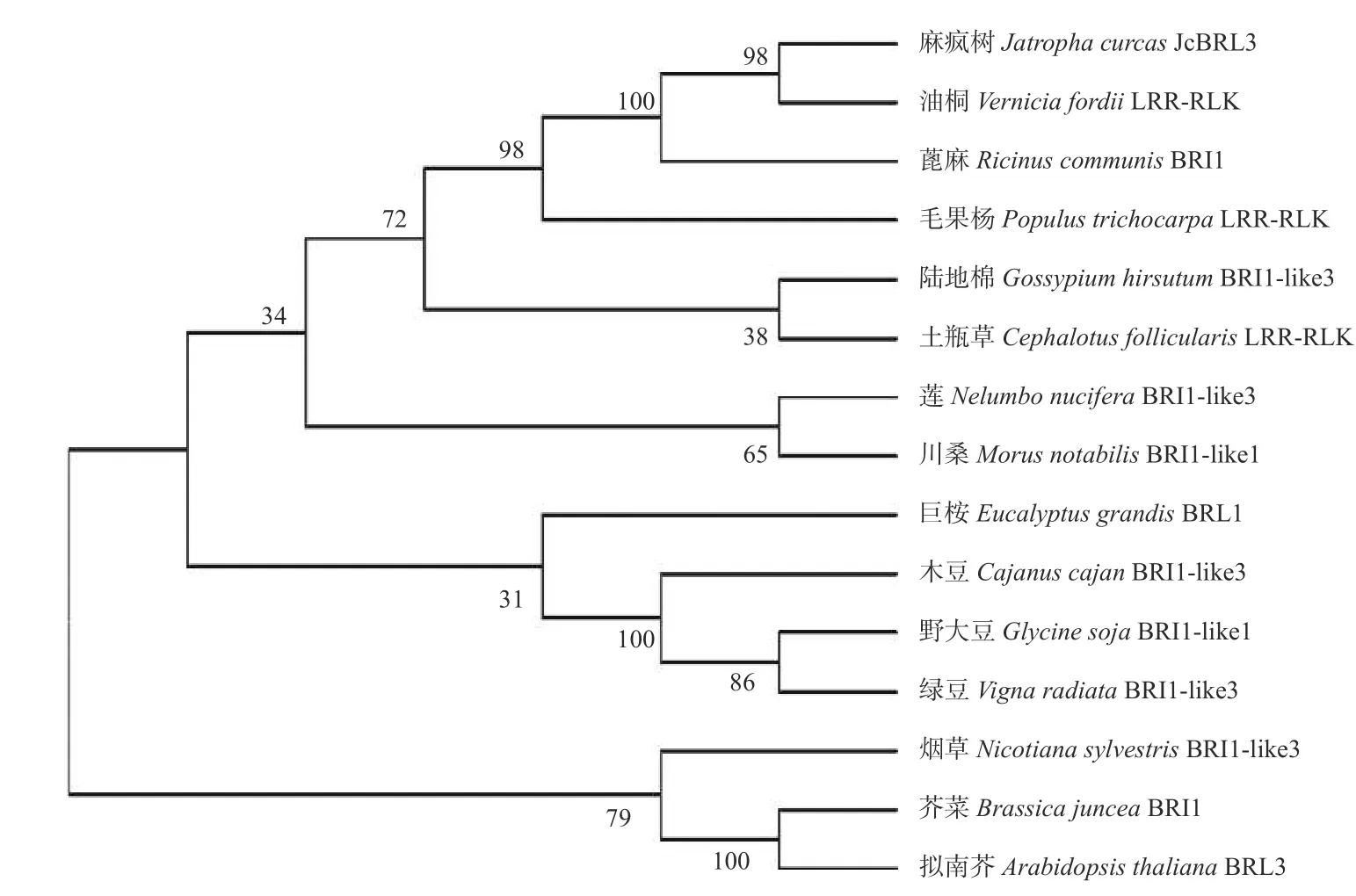
图7 麻疯树JcBRL3 蛋白系统进化树分析Fig.7 Phylogenetic tree analysis of Jatropha curcas JcBRL3 protein
2.5 麻疯树JcBRL3 基因在花发育过程中的表达分析
通过qRT-PCR 技术检测了JcBRL3基因在麻疯树9 个关键花发育时期的相对表达量。结果显示:JcBRL3基因的表达量在雌花中呈现先上升后下降的趋势,其中,在大孢子母细胞时期表达水平最低,在单核胚囊期时表达量达到最高;JcBRL3基因的表达量在雄花中则呈现先上升,后下降,最后再上升的趋势,其中在小孢子母细胞时期表达量最低,在花粉粒成熟期表达量达到最大且高于其它任何时期(图8)。这些分析结果表明JcBRL3基因很可能参与了麻疯树的雌花单核胚囊期发育和雄花花粉粒的成熟过程。
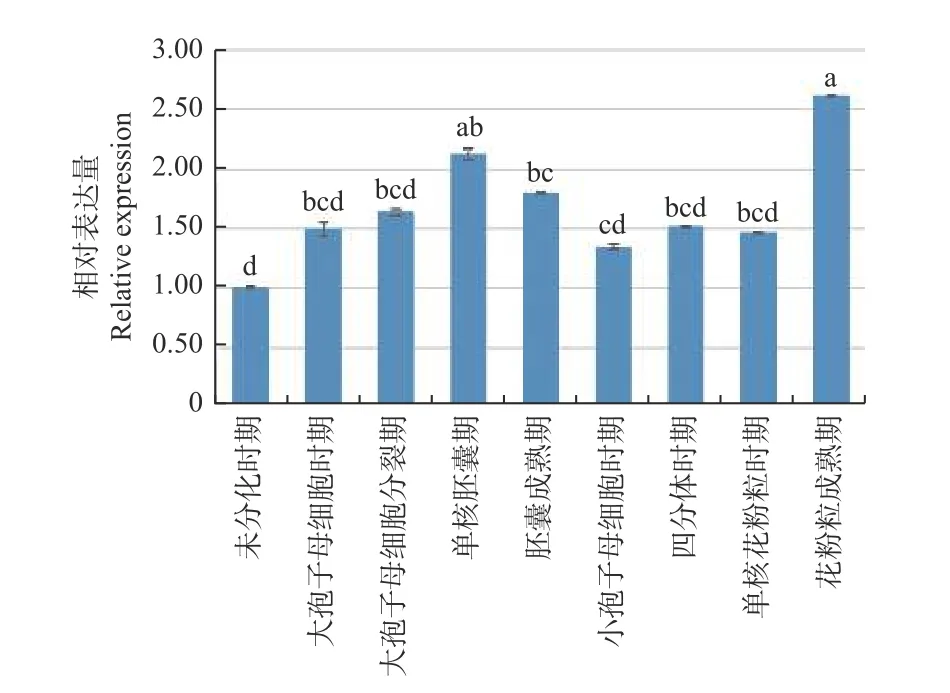
图8 JcBRL3 基因不同发育时期的表达量Fig.8 The expression level of JcBRL3 gene at different development stages
2.6 转基因植株的获得及转基因烟草的分子检测结果
采用叶盘法侵染K326 烟草,经卡那霉素筛选、共培养、选择培养、继代培养及生根培养等过程,成功获得了一批转基因烟草。以转基因烟草基因组DNA为模板进行PCR 扩增,结果显示:野生型烟草未检测到目的条带,9 株转基因植株能成功检测到目的条带,推断麻疯树JcBRL3基因已成功导入K326 烟草基因组中(图9A)。提取了转基因烟草的总RNA 合成cDNA 第一链,通过RTPCR 扩增表明,JcBRL3基因在转基因烟草中成功表达(图9B)。

图9 转基因烟草PCR(A)与RT-PCR 检测(B)Fig.9 PCR (A) and RT-PCR (B) detection of genetically modified tobacco
2.7 转基因烟草花和花粉粒的形态学分析
为了进一步研究JcBRL3基因在花发育的作用,对2 株野生型和3 株转基因烟草的花和花粉进行形态结构分析。经观察发现:2 株野生型K326烟草柱头的位置均高于花药,而3 株转基因烟草的柱头的位置均低于花药(图10A、B)。扫描电镜观察发现:2 株野生型烟草花粉部分凹陷空瘪,平均畸形率为25.4%(图10C、D),而3 株转基因烟草花粉粒基本较为饱满,凹陷空瘪较少,平均畸形率仅为7.1%(图10E、F)。推测JcBRL3基因可能参与了麻疯树雄花发育。

图10 野生型烟草K326 和转基因烟草花及花粉粒的形态分析Fig.10 Morphological analysis of flowers and pollen grains of wild-type tobacco K326 and transgenic tobacco
3 讨论
BR 是一种高活性的植物激素,广泛存在于各种植物中。BR 能调控植物细胞伸长和分裂、维管组织分化、种子萌发和成熟、叶片的形态建成和衰老、生殖发育等一系列植物生长发育过程,还具有增强植物抵抗低温、高温、高盐等非生物逆境的能力[14-15]。在BR 信号传导过程中,首先细胞膜表面受体BRI1 和辅助受体BAK1(BRI1-associated receptor kinase 1)互作形成具有活性的复合物识别BR 信号;之后BR 信号途径通过一系列磷酸化和去磷酸化作用,使BZR1(brassinozole-resisent 1)和BES1(BRI1-EMS-SUPOPRESSOR 1)等转录因子被激活,从而调控BR 应答相关基因的表达[16]。而BRL3 受体作为BRI1 受体蛋白家族成员,也参与了BR 的信号转导[17]。
本研究从麻疯树花发育的转录组中筛选到一个性别差异表达的油菜素内酯受体蛋白基因BRL3,其开放阅读框长3 618 bp,编码1 205 个氨基酸。对其原核表达产物质谱鉴定及蛋白结构分析表明:JcBRL3 蛋白包含1 个胞内功能域、1 个跨膜区以及1 个胞外富亮氨酸重复序列结构,且胞内区具有丝氨酸/苏氨酸活性位点,这与LRR-RLK 的结构一致[18],初步判定JcBRL3 蛋白是一个LRR-RLK类受体激酶。在三维结构上JcBRL3 与拟南芥BRI1-like1 高度相似;在功能域上JcBRL3 蛋白与亚洲棉BRI1 蛋白、蓖麻BRI1 蛋白及油桐的一个LRRRLK 序列相似性极高,这些结果表明JcBRL3 蛋白很可能属于BRI1 家族蛋白。
目前,对于BRL3基因的研究还十分有限,且大都集中于韧皮部形成、维管分化及抗旱性方面[19-20],其参与生殖发育调控的研究尚未涉及。本研究通过对JcBRL3基因在麻疯树花发育过程中的表达模式分析发现,JcBRL3的表达水平在麻疯树雄花花粉粒成熟期达到最高,表明其可能参与了雄花花粉粒成熟的过程;将JcBRL3基因导入烟草中过量表达发现,野生型烟草柱头位置高于花药,而转基因烟草柱头位置低于花药,且其花粉粒较饱满畸形率低,推测这种差异可能是JcBRL3基因参与烟草雌蕊发育导致的。虽然目前的研究尚未直接表明BRL3 能调控雄蕊发育,但大量研究证明BR在植物雄性器官发育方面有不可替代的作用。BR能促进番茄[21]、扁桃(Prunus dulcisL.)[22]、水稻(Oryza sativaL.)[23]及拟南芥[24]等植物的花粉萌发,而BR 信号传导或生物合成缺陷会导致花粉发育缺陷和雄蕊缩短[25]。BR 缺陷与不敏感株系如:cpd、dwf4和bri1皆表现为雄性不育[26-27],而导致这类植株雄性不育的主要原因是花丝变短[28]、花粉数量减少以及绒粘层和小孢子发育异常[25]。此外,研究发现,在拟南芥中BR 可以通过控制MS1、MS2、MYB103、TDF1和SPL/NZZ基因的表达来调控雄蕊的发育,这种调控能够完成的关键在于这些基因的启动子上含有BES1 转录因子的结合位点[25]。已有研究证明BRL3基因的表达能修复bri1突变体的表型缺陷[7],并发现BES1 转录因子能与BRL3启动子上的BRRE 相结合从而调控BRL3[19],这暗示BRL3的表达很可能通过调控雄蕊发育来修复bri1突变体的雄性不育。因此,推测在烟草、拟南芥和麻疯树中极可能存在相同的BR 调控途径,JcBRL3基因的过量表达导致烟草花丝伸长、花粉粒畸形率降低是很明显的BR 增强表型,这种BR 增强型很可能是由BES1 转录因子的调控导致的,而这种推测是否属实还需进一步研究证明。
4 结论
本研究通过RACE PCR 技术成功从麻疯树花蕾中获得了JcBRL3基因的cDNA 全长序列,该基因开放阅读框长3 618 bp,编码1 205 个氨基酸;原核表达产物为JcBRL3 蛋白,预测属于跨膜蛋白,含有多个LLR;qRT-PCR 分析表明,其可能参与了麻疯树雌花单核胚囊期和雄花花粉粒成熟的发育过程;此外,其转基因烟草花药位置高于柱头,花粉粒也较为饱满,进一步表明JcBRL3可能参与了麻疯树雄花发育。而关于JcBRL3 和其介导的BR 信号是如何参与调控麻疯树花发育的还需进一步的研究来揭示。
