不同亚型幽门螺旋杆菌感染与功能性消化不良症状的关系研究
2022-01-05杨静怡魏刚廖应英孙泽群
杨静怡 魏刚 廖应英 孙泽群
功能性消化不良(FD)是指具有餐后饱胀、早饱、上腹痛、上腹部烧灼感等不适症状,经检查排除引起上述症状的器质性疾病,且症状可持续或反复发作,病程超过1个月或在过去的12个月中累计超过12周[1]。FD是临床上最常见的一种功能性胃肠病,以病程长、易复发且难以缓解为主要特点,可引起焦虑、抑郁和躯体化障碍等精神心理疾病,严重影响患者生活质量[2]。FD的病因及发病机制目前仍不明确,目前认为是多种因素引起的临床综合征[3],可能与胃排空延迟、胃肠黏膜慢性炎症、胃容受性扩张不良、胃十二指肠运动协调失常、十二指肠对酸敏感的改变、幽门螺旋杆菌(Hp)感染及精神遗传因素均具有相关性[4]。已有研究发现FD与Hp感染密切相关[5],但关于不同亚型Hp感染与FD之间关系的报道较少。本研究通过前瞻性研究探讨Hp分型与FD症状之间的相关性,同时探讨根除Hp对FD患者的治疗意义,以期对FD患者Hp筛查、治疗及追踪随访提供理论依据,改善FD患者的临床症状,提高其生活质量。
对象与方法
1.对象:2018年10月~2019年8月于我院就诊的FD患者106例,男58例,女48例,年龄26~60岁。纳入标准:(1)年龄18~65岁;(2)符合罗马Ⅳ诊断标准[6];(3)研究期间未进行其他治疗。排除标准:(1)有严重心脑肝肾疾病或恶性肿瘤晚期;(2)年龄<18岁;(3)妊娠期或哺乳期;(4)合并精神疾病;(5)对多种抗生素过敏;(6)接受治疗前1个月内服用过抗生素和抑酸剂;(7)不配合或信息资料不完整。依据14C呼气试验结果将106例患者分为Hp阳性组52例和Hp阴性组54例,两组患者基线资料比较差异无统计学意义(P>0.05),见表1。依据Hp抗体检测结果进一步将Hp阳性组分为Ⅰ型Hp阳性组28例和Ⅱ型Hp阳性组24例,两组患者基线资料比较差异无统计学意义(P>0.05),见表2。本研究经我院伦理委员会批准,所有患者均知情同意并签署知情同意书。
2.方法:收集患者的一般资料,包括年龄、性别和吸烟情况。采用消化不良严重程度指数(DSSI)评估所有患者消化不良症状。采用Hp抗体检测分型试剂盒(购于深圳市伯劳特生物制品有限公司)对Hp进行分型,按照产品说明书进行操作,具体过程如下:将10 μl符合要求的Hp阳性患者血清与洗涤应用液同时加至反应槽中与印迹膜孵育30 min后,洗净3~4次,加入酶联免疫反应试剂反应30 min,再次洗净,加入显色剂反应5~10 min,与标准区带相比即可进行结果判读。得到Hp抗体结果的同时,读出细胞毒素相关蛋白A(CagA)、细胞空泡毒素A(VacA)结果,CagA、VacA同时或任一项为阳性判定为Ⅰ型Hp感染,同时为阴性判定为Ⅱ型Hp感染。采用随机数字表法将Hp阳性组患者分为观察组(26例)和对照组(26例),观察组采用Hp根除治疗(兰索拉唑肠溶片30 mg每日2次,阿莫西林胶囊1 g每日2次,克拉霉素缓释片0.5 g每日2次,胶体酒石酸铋胶囊165 mg每日4次),对照组采用常规性治疗(兰索拉唑肠溶片30 mg每日2次,枸橼酸莫沙必利片5 mg每日3次),分别在治疗结束1、2、3个月后再次对患者进行症状评估,比较两组患者的症状差异。

表1 Hp阴性组和Hp阳性组患者的基线资料比较(例)

表2 Ⅰ型和Ⅱ型Hp阳性组患者的基线资料比较(例)
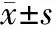
结 果
1.Hp及其不同亚型感染组DSSI评分比较:Hp阳性组患者的DSSI评分较Hp阴性组明显增高[(28.15±7.88)分比(19.55±2.16)分,P<0.01]。Ⅰ型Hp阳性组患者的DSSI评分较Ⅱ型Hp阳性组明显增高[(33.61±6.41)分比(21.79±3.30)分,P=0.01]。
2.观察组和对照组治疗前后DSSI评分比较:观察组和对照组在治疗前DSSI评分比较差异无统计学意义(P>0.05),观察组在治疗结束后1、2、3个月的DSSI评分均明显低于同期对照组(P<0.05),见表3。观察组在治疗结束1、2、3个月后的DSSI评分降低值均明显高于同期对照组(P<0.05),见表4。

表3 观察组和对照组治疗前后不同时间点DSSI评分比较 (分,

表4 观察组和对照组与前1个月DSSI评分的差值比较 (分,
讨 论
近年来有大量研究发现,Hp感染与FD密切相关,FD患者的Hp感染率较高。有文献报道,大约有50%~60%的FD患者合并Hp感染[7],但目前对于Hp感染在FD发病机制中的作用尚不完全明确。有研究显示Hp感染后分泌的酶类和毒力因子会引起或加重消化道黏膜的急慢性炎症,消化道黏膜炎症则直接或间接导致胃肠感觉及运动异常,从而产生FD症状。Hp菌体中含有CagA、VacA、尿素酶(Ure)、热休克蛋白60(Hsp60)和氮素还原酶(RdxA)等抗原蛋白,Hp在感染人体后可刺激产生不同抗体,在Hp产生的抗体蛋白中较为重要的是CagA和VacA[8]。CagA是Hp最具特点的一种毒力蛋白,有研究指出,CagA通过Ⅳ型分泌系统进入宿主体内后诱导胃黏膜内白细胞介素-8水平明显增高,从而导致中性粒细胞、T淋巴细胞等激活、趋化、粘附,导致上皮细胞炎症损害明显加重[9]。VacA的致病机制主要是对上皮细胞的结构和表型产生影响,如破坏上皮细胞的屏障功能、调节炎性反应、导致上皮细胞产生空泡样改变等[10]。VacA可诱导产生多种细胞生物学活动,包括膜通道形成、细胞色素C释放,也可以与细胞膜受体结合导致炎症[11]。依据Hp菌株表达CagA和VacA的不同可将其分为Ⅰ型菌株和Ⅱ型菌株,董欣红等[12]于2016年发现不同分型的Hp菌株产生细胞毒能力不同,致病力也有差异,Ⅰ型Hp比Ⅱ型有更强的致病力,导致的消化道症状也更为严重。本研究结果也显示,Ⅰ型Hp感染FD患者的临床症状重于Ⅱ型Hp感染的FD患者,与上述研究结果一致。
2013年Xu等[13]对中国FD患者进行的一项多中心前瞻性队列研究结果显示,根除Hp后FD患者的症状能得到长远改善。在2015年的京都共识中也建议对Hp感染相关的FD进行根除治疗。本研究结果显示,观察组在治疗结束后1、2、3个月的DSSI评分显著低于对照组,且治疗后观察组消化不良症状的改善程度也显著优于对照组。但本研究样本量较小,对于Hp致病基因的研究和根除Hp对FD患者的治疗意义尚需更大样本量的研究进一步证实。此外,在对FD患者进行根除Hp时也需考虑到抗生素耐药情况和服用多种抗生素的不良反应这一问题,因此,在临床中需结合每例患者的实际情况予以最合适的治疗。
本研究尚存在一些不足之处:一是在患者进行的14C呼气试验在操作过程中存在一些影响到检查结果的因素,如采集标本的时间、次数、进行胃排空的时间、患者有无服用尿素酶等,可能使结果数据出现一定的偏差;二是没有排除药物的安慰剂效应对患者治疗效果的影响。
综上所述,Hp感染可使FD患者的症状加重,其中Ⅰ型Hp感染者更为明显。根治Hp能明显改善Hp阳性FD患者的临床症状。因此,在判断FD患者是否感染Hp的同时,还可以对其进行Hp分型,不仅可为追踪随访患者提供依据,也为临床个体化治疗FD提供理论支持,进一步改善FD患者的生活质量。
