菊状千里光化学成分及抗真菌活性研究
2022-01-05谢小燕王睿睿邹秋萍苏刘艳李艳平何红平
谢小燕,王睿睿,邹秋萍,苏刘艳,李艳平,何红平
云南中医药大学 中药学院,昆明 650500
菊状千里光(SeneciolaetusEdgew.)为菊科(Compositae)千里光属多年生草本植物[1],多生于海拔1 100~3 750m的田边、路边和林下,主要分布于重庆、西藏、湖北、云贵等地。因其具有活血,消肿,祛风,除湿等功效,长久以来,民间常用菊状千里光来治疗肝炎、跌打损伤、瘀积肿痛、乳痈和疮痈肿疡等疾病[2,3]。近年的药理学研究也表明[4-9]菊状千里光具有抗菌、抗病毒、抗肿瘤、抗氧化等多种生物活性。千里光属植物具有丰富的次生代谢产物,包括生物碱类化合物、黄酮类化合物、萜类化合物、酚酸类化合物和香豆素类化合物等[2]。其主要成分为吡咯里西啶类生物碱(PAs)和倍半萜类化合物,其中大部分的倍半萜类化合物具有抗炎、抗细菌、抗结核以及抗真菌感染活性,而吡咯里西啶类生物碱常具有肝毒性[10]。对菊状千里光全草进行了化学成分研究[11-13],从中分离得到27个化合物,包括3个生物碱、4个甾醇类、5个酚酸类、9个黄酮类、4个有机酸类化合物等。目前对这类植物的化学成分研究报道较少,对菊状千里光活性的研究主要集中于挥发油成分和功能性评价,对其中可能具有肝毒性的生物碱类成分和其他活性成分的研究较少。为进一步阐明菊状千里光的化学成分,明确其活性和毒性成分,我们对采自云南省德宏州的菊状千里光植物进行化学成分研究。此外,我们还评价了部分化合物的抗真菌活性和对肝细胞毒性,以期为菊状千里光植物药用资源的合理安全性开发利用提供科学的依据。
1 材料与方法
1.1 仪器及试剂
PrecisaXS125A分析天平(瑞士普利赛斯公司);ZF8三用紫外分析仪(上海康华生化仪器制造厂);BUCHIRotavaporR-205 型旋转蒸发仪(瑞士步琪有限公司);AS2005 中压制备液相仪(江苏汉邦科技有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);PH050 型干燥箱(上海益恒实验仪器有限公司);BUCHI Heating BachB-490 型电热恒温水浴锅(瑞士步琪有限公司);Bruker AM-400核磁共振仪(瑞士Bruker公司)。薄层色谱及柱色谱用硅胶(青岛海洋化工厂);MCI Gel CHP-20P为日本三菱化工;羟丙基葡聚糖凝胶(Sephadex LH-20凝胶)为Pharmacia公司进口分装;十八烷基键合硅胶(Rp-18)为日本富士硅化工产品。所有试剂均为分析纯。氟康唑(南昌弘益药业有限公司,50 mg,171128);DMSO溶剂(MP Biomedicals,LLC,100 mL,Q6949);沙氏液体培养基(广东环凯微生物科技有限公司,250 g,1069251);念珠菌临床耐药株23#(由昆明医科大学第一附属医院李玉叶教授赠送)按常规方法复苏,划板培养于4 ℃下保存。
CO2细胞培养箱(Thermo Electron Corporation);酶标仪(M200 PRO 多功能酶标仪);台式离心机(上海医疗器械有限公司手术器械厂);水处理超滤器(Millipore公司);荧光倒置相差显微镜(日本Nikon公司);超净工作台(苏州安泰空气技术有限公司);正常人肝L-02细胞(购自中国科学院昆明动物研究所);胎牛血清(Hyclone);RPMI-1640(美国Gibco Invitrogen公司);胰蛋白酶(美国Amresco公司);沙堡氏液体培养基。所有试剂均为分析纯。
植物样品菊状千里光全草(晒干)15 kg于2016年9月采于德宏州盈江县铜壁关乡茶山寨。经昆明植物研究所刘思德鉴定为菊状千里光,标本(标本号:201609)保存于云南中医药大学中药学院中药化学实验室。
1.2 提取与分离
菊状千里光干燥全草15 kg,粉碎(80目)后用80%乙醇室温下浸提4次,每次24 h,合并提取液,减压浓缩得浸膏4.3 kg。用2.5% HCl调pH=2,得滤液和沉淀(A)836 g。滤液经氯仿萃取,得氯仿部分(B)80 g。水相用NaOH调pH=10后,分别用氯仿和正丁醇萃取得到氯仿部分(C)33 g和正丁醇部分(D)2.0 kg。A部分(836 g)经MCI色谱,用甲醇-水(3∶7→9∶1)梯度洗脱,得到A1~A4部分。A1(5.8 g)用硅胶柱层析(氯仿-甲醇,20∶1→1∶1)分离,然后用Sephadex LH-20柱层析(氯仿-甲醇,1∶1)纯化,得到9(10.0 mg)和11(14.2 mg)。通过对组分A2(3g)经硅胶(氯仿-丙酮,40∶1→1∶1)和Sephadex LH-20柱层析(氯仿-甲醇,1∶1)得到化合物10(4.9 mg)。A3(5.8 g)采用硅胶柱以石油醚-丙酮(15∶1、10∶1、5∶1、1∶1)洗脱,通过薄层色谱点板合并得到A3-1~A3-3。A3-2以制备型高效液相进行分离纯化,选择较适合A3-2的HPLC分离条件是:色谱柱Zorbax SB-C18(250 mm×9.4 mm,5 μm);检测波长:210 nm;流动相:甲醇-水(40∶60,V/V);流速:3 mL/min等度洗脱,得到4(6.8 mg,tR=16.8 min)和5(5.1 mg,tR= 21.6 min)。B部分先采用硅胶柱层析以氯仿-甲醇(25∶1→1∶1)为洗脱剂进行梯度洗脱,从氯仿-甲醇(15∶1)洗脱部位得到化合物6(6.0 mg)。C部分(30 g)用硅胶柱以氯仿-丙酮(35∶1、25∶1、15∶1、8∶1、3∶1)进行梯度洗脱,得到C1~C5部分。化合物7(11.8 mg)和8(9.7 mg)从C3-1中通过重复硅胶柱色谱氯仿-甲醇(40∶1→10∶1)获得。D部分用D101以水和30%、60%、90%和100%的甲醇进行洗脱得到D1~D4,其中D2(5.7 g)经RP-18色谱,用甲醇-水(20%→90%)洗脱,然后用Sephadex LH-20色谱(氯仿-甲醇,1∶1)纯化,得到1(4.5 mg)和2(7.1 mg)。组分D3在硅胶上用石油醚-丙酮(10∶1)和甲醇(45%→70%,3 mL/min)进行色谱分析后得到化合物3(11.5 mg),其中液相分析制备条件:色谱柱Zorbax SB-C18(250 mm×9.4 mm,5 μm);检测波长:210 nm;流动相:甲醇-水(45∶55,V/V);流速:3 mL/min等度洗脱。
1.3 抑菌实验方法
取96孔板,将阳性药物氟康唑稀释为初浓度1 mg/mL,待测化合物样品用沙氏液体培养基稀释为1 mg/mL的加载液,检测联合用药时,浓度加倍,体积减半,然后进行5倍倍比稀释,共设置6个浓度梯度,每个浓度设3个复孔。各孔加入测试真菌悬液,其中白色念珠菌标准株浓度为1×105CFU/mL,白色念珠菌耐药株浓度为1× 105CFU/mL,于37 ℃培养24 h。酶标仪测定625 nm下的OD值。实验同时设置培养基对空白对照、菌液对照以及氟康唑阳性药物对照。
真菌活性抑制率=(1-样品OD值/
实验对照孔OD值)×100%
(1)
联合指数(FICI)=ECA/A+ECB/B
(2)
公式(2)中A和B分别为两药单用时的EC50值,ECA和ECB分别为两药联合时的EC50值。当EC值高于检测最高限时以做高限浓度的两倍值用以计算FICI。本实验中EC50值的计算以氟康唑的最小真菌生长50%时的抑制百分数来计算。当FICI≤0.5时,表示两药的作用方式为协同;当0.5
1.4 细胞存活率测定
人正常肝细胞株L-02,于37 ℃水浴复苏。用含10% FBS(胎牛血清)、100 U/mL青霉素和100 μg/mL链霉素的1640培养基在37 ℃、5% CO2培养箱中培养。取培养第3代的对数期细胞,用胰蛋白酶消化,以2×104/mL的细胞密度接种于96孔板,设置5个复孔,培养48 h后给予分离得到的生物碱化合物样品,培养24 h后用MTT法于570 nm波长测OD值,计算细胞的存活率以评价生物碱的毒性。
细胞存活率=(给药组平均OD值/
正常对照组平均OD值)×100%
2 实验结果
2.1 结构鉴定
化合物1白色无定型粉末;(+)ESI-MS:m/z382 [M+H]+,HR-ESI-MS(m/z382.186 4 [M+H]+,calcd for C19H28NO7,382.186 6),确定分子式C19H27NO7,不饱和度为7。1H NMR图谱表明分子中存在4个甲基信号[δH2.33(3H,s),1.36(3H,s),0.95(3H,s),1.25(3H,d,J=4 Hz)]和4个次甲基信号,其中包括1个连氧次甲基信号为[δH3.05(1H,s)],1个端基碳的次甲基信号为[δH6.20(1H,br s)]。13C NMR和DEPT谱图显示19个碳原子,包括4个甲基(1个连氮的甲基),5个亚甲基,4个次甲基和6个季碳。化合物的1H NMR、13C NMR和DEPT谱显示该化合物有2个羰基信号[δC178.3(s),170.4(s)],1个双键碳信号[δH6.20(1H,br s);δC136.7,135.2],1个连氮的甲基信号为[δH2.33(3H,s);δC43.3]和一个连氧季碳信号[δC160.1](见表1)。结合上述数据发现化合物1与已知化合物ligularizine[14]的非常相近,最大的不同在于它们的C-12位取代基和C-8位取代基不同,表现在谱图中化合物1的C-12为羟基取代,而C-8位同时连接氮原子和氧负离子,表现为化学位移值在δC160.1。以上波谱数据结合HSQC、HMBC、1H-1H COSY谱确定化合物1为othosenzhe。化合物1的相对构型通过ROESY 相关谱及与文献报道核磁数据比对来确定。从ROESY谱中H-4与H-18、H-19及H-21的相关,表明H-4、H-18、H-19、H-21为β构型;C19-OH为α构型。故化合物1鉴定为othosenine(结构见图1)。

表1 化合物1在CD3OD中的1H(400 MHz)和13C(100 MHz)NMR数据
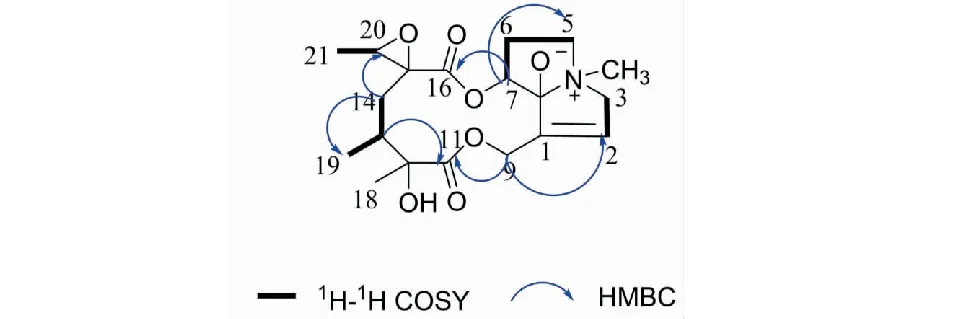
图1 化合物1的化学结构及关键相关Fig.1 Structure and key correlations of compound 1
化合物2白色粉末状结晶(甲醇);1H NMR(DMSO-d6,600 MHz)δ:6.52 (1H,s,H-6′),6.52(1H,s,H-2′),4.83(1H,d,J= 7.3 Hz,H-1″),3.74(6H,s,3′/5′-OCH3),3.58(1H,m,H-1a),3.67(1H,m,H-1b),3.58(1H,m,H-3a),3.67(1H,m,H-3b),3.41(1H,dd,J=11.5,5.7 Hz,H-6″a),3.61(1H,dd,J=11.5,21 Hz,H-6″b),3.19(1H,m,H-3″),3.19(1H,m,H-5″),3.15(1H,m,H-4″),3.03(1H,m,H-3″),2.71(1H,m,H-2);13C NMR(DMSO-d6,150 MHz)δ:152.2(C-3′),152.2(C-5′),137.9
(C-1′),133.2(C-4′),106.7(C-2′,6′),103.0(C-1″),77.1(C-3″),76.5(C-5″),74.2(C-2″),69.9(C-4″),62.7(C-1,3),60.9(C-6″),56.4(3′/5′-OCH3),50.7(C-2)。 以上数据与文献[11]报道的数据基本一致,故化合物2鉴定为2-(4-O-β-D-glucopyranosyl) syringylpropane-1,3-diol。
化合物3白色粉末状结晶(甲醇);1H NMR(DMSO-d6,400 MHz)δ:6.65(4H,s,H-2,2′,6,6′),4.96(2H,d,J= 12.0 Hz,H-1″,1″′),3.74(12H,s,3,5,3′,5′-OCH3),3.60(2H,dd,J= 3.4,1.8 Hz,Hb-6″,6″′),3.53(2H,dd,J= 3.4,0.9 Hz,Ha-6″,6″′),3.41(2H,m,H-4″,4″′),3.40(2H,m,H-2″,2″′),3.37(2H,m,H-3″,3″′),3.15(2H,m,H-5″,5″′);13C NMR(DMSO-d6,100 MHz)δ:152.9(C-3,3′,5,5′),137.6(C-1,1′),133.9(C-4,4′),104.7(C-2,2′,6,6′),103.1(C-1″,1″′),85.5(C-7,7′),77.7(C-5″,5″′),77.0(C-3″,3″′),74.6(C-2″,2″′),71.8(C-9,9′),70.2(C-4″,4″′),61.0(C-6″,6″′),55.8(3,5,3′,5′-OCH3),54.1(C-8,8′)。以上数据与文献[15]报道的数据基本一致,故化合物3鉴定为刺五加苷E。
化合物4白色无定型粉末;1H NMR(DMSO-d6,400 MHz)δ:6.72(2H,s,H-3,5),6.45(1H,d,J=16.0 Hz,H-7),6.35(1H,dt,J=16.0,5.5 Hz,H-8),4.10(2H,d,J=5.5 Hz,H-9),3.77(6H,s,2,6-OCH3),4.75(1H,s,H-1′),3.74(1H,dd,J=11.2,1.8 Hz,H-6′a),3.58(1H,dd,J=11.2,5.0 Hz,H-6′b),3.42(1H,t,J=8.0 Hz,H-2′),3.40(2H,m,H-3′,4′),3.18(1H,m,H-5′);13C NMR(DMSO-d6,100 MHz)δ:153.2(C-2,6),134.4(C-7),133.1(C-1),130.6(C-4),128.9(C-8),105.0(C-3,5),103.8(C-1′),77.7(C-5′),77.1(C-3′),74.6(C-2′),70.4(C-4′),61.9 (C-9),61.5(C-6′),56.8(OCH3)。以上数据与文献[12]报道的数据基本一致,故化合物4鉴定为紫丁香苷。
化合物5黄色粉末状结晶(甲醇);1H NMR(DMSO-d6,400 MHz)δ:12.62(1H,s,5-OH),8.03(1H,d,J=2.0 Hz,H-2′),7.50(1H,dd,J=8.4,2.0 Hz,H-6′),6.90(1H,d,J=8.4 Hz,H-5′),6.45(1H,d,J= 2.0 Hz,H-8),6.21(1H,J=2.0 Hz,H-6),5.50(1H,d,J=7.7 Hz,galactose-1″),3.85(3H,s,3′-OCH3),3.35-3.61(6H,m,galactose);13C NMR(DMSO-d6,100MHz)δ:177.9(C-4),164.6(C-7),161.7(C-5),156.8(C-2),156.3(C-9),149.9(C-3′),147.5(C-4′),133.6(C-3),122.3(C-6′),121.5(C-1′),115.6(C-5′),114.0(C-2′),104.5(C-10),102.1(C-1″), 99.2(C-6),94.2(C-8),76.3(C-5″),73.4(C-3″),71.1(C-2″),68.3(C-4″),60.9 (C-6″),56.4(OCH3)。以上数据与文献[11]报道的数据基本一致,故化合物5鉴定为异鼠李素-3-O-β-D-半乳糖苷。
化合物6黄色粉末状结晶(甲醇);1H NMR(DMSO-d6,400 MHz)δ:12.64(1H,s,5-OH),10.86(1H,s,7-OH),9.70(1H,s,4′-OH),9.34(1H,s,3′-OH),7.30(1H,d,J=2.0 Hz,H-2′),7.27(1H,dd,J=8.1,2.0 Hz,H-6′),6.86(1H,d,J=8.1 Hz,H-5′),6.37(1H,d,J=2.0 Hz,H-8),6.20(1H,d,J=2.0 Hz,H-6),5.23(1H,d,J= 1.4 Hz,Rha-H″-1),0.83(3H,d,J=5.8 Hz,Rha-H″-6);13C NMR(DMSO-d6,100 MHz)δ:177.9(C-4),164.6(C-7),161.8(C-5),156.8(C-2),156.7(C-9),148.9(C-4′),145.3(C-3′),133.6(C-3),122.4(C-6′),121.6(C-1′),116.4(C-5′), 115.6(C-2′),104.4(C-10),102.3(C-1″),99.1(C-6),94.0(C-8),71.7(C-4″),71.0(C-3″),70.5(C-5″),70.2(C- 2″),17.9(C-6″)。以上数据与文献[13]报道的数据基本一致,故化合物6鉴定为槲皮素-3-O-β-D-鼠李糖苷。
化合物7白色粉末状结晶(氯仿);1H NMR(CDCl3,400 MHz)δ:5.34(1H,d,J=5.0 Hz,H-6),5.16(1H,dd,J=8.6,24 Hz,H-22),5.01(1H,dd,J= 8.7,24 Hz,H-23),3.52(1H,m);13C NMR(CDCl3,100 MHz)δ:140.8(C-5),138.3(C-23),129.3(C-22),121.7(C-6),71.8(C-3),56.9(C-14),56.0(C-17),51.2(C-24),50.1(C-9),42.3(C-13,4),40.5(C-20),39.7(C-12),37.3(C-1),36.5(C-10),31.9(C-2,7,8,25),28.9(C-16),25.4(C-28),24.4(C-15),21.2(C-21),21.1(C-11,26),12.1(C-18,29),19.4(C-19),19.0(C-27)。以上数据与文献[16]报道的数据基本一致,故化合物7鉴定为Δ5,22-豆甾烯醇。
化合物8白色粉末(氯仿);1H NMR(CDCl3,600 MHz)δ:6.11(1H,br s,H-2),5.47(1H,d,J= 11.1 Hz,H-9a),5.09(1H,br s,H-7),4.33(1H,d,J=11.1 Hz,H-9b),3.42(1H,br d,J=18.1 Hz,H-3a),3.28(1H,br d,J= 18.1 Hz,H-3b),2.98 (1H,q,J=5.4 Hz,H-20),2.90(1H,m,H-5a),2.61(2H,m,H-5b,6a),2.22(1H,m,H-6b),2.13(1H,d,J=14.4 Hz,H-14),2.06(3H,s,N-Me),1.91(1H,dq,J=6.6,11.0 Hz,H-13),1.33(3H,s,Me-18),1.23(3H,d,J=5.4 Hz,Me-21),1.14(3H,d,J= 6.3 Hz,Me-19);13C NMR(CDCl3,150 MHz)δ:191.9(C-8),177.8(C-11),167.9(C-16),137.2(C-2),134.3(C-1),78.4(C-7),77.2(C-12),64.3 (C-9),63.7(C-15),58.8(C-3),56.0(C-20),53.0(C-5),40.0(N-Me),38.5(C-13),37.1(C-14),35.6(C-6),23.9(C-18),13.5(C-21),12.4(C-19)。以上数据与文献[11]报道基本一致,故鉴定化合物8为奥索千里光碱。
化合物9黄色粉末;1H NMR(DMSO-d6,400 MHz)δ:7.76(1H,d,J= 2.1 Hz,H-2′),7.69(1H,dd,J=8.5,2.1 Hz,H-6′),6.94(1H,d,J=8.5 Hz,H-5′),6.48(1H,d,J=2.0 Hz,H-8),6.20(1H,d,J=2.0 Hz,H-6),3.85(3H,s,3′-OCH3);13C NMR(DMSO-d6,100 MHz)δ:183.4(C-4),164.8(C-7),163.4(C-2),161.5(C-5),157.3(C-9),149.4(C-4′),146.9(C-3′),121.9(C-1′),121.6(C-6′),115.2(C-5′),113.2(C-2′),104.2(C-3),103.6(C-10),99.0(C-6),93.8(C-8),59.8(-OCH3)。以上数据与文献[11]报道基本一致,故鉴定化合物9为异鼠李素。
化合物10淡黄色粉末;1H NMR((CD3)2CO,400 MHz)δ:12.16(1H,s,5-OH),7.83(1H,d,J=2.0 Hz,H-2′),7.70(1H,dd,J=8.4,2.0 Hz,H-6′),7.00(1H,d,J= 8.4 Hz,H-5′),6.53(1H,J=1.6 Hz,H-8),6.27(1H,J=1.6 Hz,H-6);13C NMR((CD3)2CO,100 MHz)δ:175.5(C-4),164.1(C-7),160.2(C-5),156.8(C-9),146.0(C-2),144.9(C-3′),122.8(C-1′),120.5(C-6′),115.2(C-2′),147.3(C-4′),114.8(C-5′),102.4(C-10),98.2(C-6),93.5(C-8),35.7(C-3)。以上波谱数据与文献[11]报道基本一致,故鉴定化合物10为槲皮素。
化合物11无色方晶;1H NMR(DMSO-d6,400 MHz)δ:7.50(1H,d,J= 16.0 Hz,H-7),7.06(1H,d,J=1.6 Hz,H-2),7.00(1H,dd,J=8.0,2.0 Hz,H-6),6.78(1H,d,J=8.0 Hz,H-5),6.30(1H,d,J=16 Hz,H-8),4.17(2H,q,J=7.0 Hz,H-OCH2CH3),1.25(3H,t,J=7.0 Hz,H-OCH2CH3);13C NMR(DMSO-d6,100 MHz)δ:167.0(C-9),148.9(C-3),146.1(C-4),145.5(C-7),126.6(C-6),121.8(C-1),116.2(C-2),115.3(C-5),114.5(C-4),60.2(C-10),14.7(C-11)。以上波谱数据与文献[17]报道基本一致,故鉴定化合物11为咖啡酸乙酯。
2.2 化合物对白色念珠球菌的抑菌活性
结果表明,氟康唑对白色念珠球菌的敏感菌株抑制活性显著,但对耐药菌株无效。菊状千里光中化合物单独使用时,对白色念珠菌敏感株和耐药株均无抑制作用,然而,当与氟康唑联合使用时,化合物7对白色念珠菌敏感株有显著的协同抑菌作用,其联合指数FICI50分别为0.008 6,化合物1和8对白色念珠菌耐药菌株有显著的协同抑菌作用,其联合指数FICI50分别为0.004 4和0.012 4,为极好的协同抑菌作用(见表2)。

表2 菊状千里光中化合物与阳性对照对白色念珠菌的抑制活性表
2.3 菊状千里光中两个生物碱化合物的肝毒性评价
两个生物碱(化合物1和8)对L-02细胞存活率影响的评价结果表明化合物1对细胞生长无明显影响;化合物8有一定的促进细胞生长作用(见表3)。以上结果表明在细胞水平两个生物碱均无肝细胞毒性。

表3 菊状千里光中生物碱对L-02细胞存活率影响
3 讨论与结论
近年来,由于癌症发病率升高,肿瘤患者的增加,放疗、化疗、免疫抑制剂等治疗手段的应用,使得临床上严重真菌感染的病例不断增加,在全球的念珠菌感染病例中,白色念珠菌(Candidaalbicans)是最为主要的感染病原菌之一,氟康唑作为抗真菌的一线药物,对白色念珠球菌的敏感菌治疗效果显著,然而随着真菌耐药性的普遍产生,使得治疗越发困难。因此寻找与现有抗真菌药物联合应用,发挥协同抗真菌作用的药物是对抗耐药真菌感染行之有效的方法之一。我们前期对云南道地药材菊状千里光挥发油进行了抗真菌活性检测和GC-MS化学成分分析,发现菊状千里光挥发油具有极好地协同抑菌活性[18]。进一步对菊状千里光全草的乙醇提取物中得到的部分化合物及其抗真菌活性进行了系统的研究,结果发现其中两个生物碱和两个甾体类化合物与氟康唑联用时表现出极好的协同抑菌作用。
千里光属中草药,我国约有160余种,其中药用品种有10多种,早在一千多年前,《本草拾遗》中就有记载千里光“味苦,平,小毒”[19],迄今为止,国内外的一些文献记载千里光属中草药可能含有不同程度的吡咯里啶生物碱(PAs),这种生物碱被认为对人及动物的器官有一定致损伤的毒性,特别是对肝组织有明显的肝毒性,可能引起肝细胞出血性坏死,肝巨细胞症以及静脉闭塞症等。我们的研究从菊状千里光的全草中分离得到了两个吡咯里啶生物碱,但这两个化合物对正常的肝细胞并未表现出毒性,也未见对这个吡咯里啶生物碱肝毒性的报道,然而作为云南民间常用药材,菊状千里光的用药安全性仍需对其鲜品、干品以及不同药用部位和不同给药方式做进一步的毒性评价。
