分枝杆菌肝素结合血凝素研究进展
2022-01-05陈玉兰刘一朵周向梅
陈玉兰 刘一朵 周向梅
2020年,全球新发结核病患者为987万例,虽然发病数自2000年至今一直在缓慢下降,但仍未达到世界卫生组织设定的目标。耐药菌株的出现、获得性免疫缺陷综合征的流行,尤其是新型冠状病毒肺炎疫情的暴发,更是复杂化了结核病的防治状况[1]。在结核分枝杆菌的致病过程中,细菌能够产生许多黏附素,这些黏附素能够与宿主机体的中性粒细胞、纤粘蛋白、层粘蛋白、上皮细胞,以及其最主要的宿主细胞——巨噬细胞发生相互作用,是细菌致病能力的体现,能够作为诊断标志物[2]。
肝素结合血凝素(heparin-binding adhesins,HBHA)是分枝杆菌属的细菌所表达的一种黏附素,于1996年首次被Menozzi等[3]在卡介苗中发现。该蛋白可以使分枝杆菌黏附到宿主细胞上,这种黏附作用可以被肝素或其他类似的硫酸化多糖所阻断。此外,由于该蛋白可以凝集兔的红细胞,因此被命名为肝素结合血凝素[3]。
在随后的研究中,HBHA的结构、功能及其与免疫系统不同模式的相互作用不断被揭晓。HBHA在致病性分枝杆菌感染机体中发挥着重要作用,同时,它具有很强的免疫原性。这两大特点使得HBHA成为许多研究者感兴趣的研究对象。
HBHA的结构与表达
目前,尚未有研究提供关于HBHA的X射线衍射或核磁共振的结构信息。但根据已有的研究预测,HBHA是一种细长的、平行卷曲螺旋二聚体蛋白,有3个主要的结构域,分别是:(1)N端跨膜结构域,由靠近N端的15~20个氨基酸组成,是较为保守的区域;(2)位于中间的卷曲螺旋结构域,该段通过同源蛋白相互作用介导HBHA的二聚化,因此该段可能与血球凝集效应、聚集菌体的作用、“黏着体”的分布形式有关;(3)C端的肝素结合结构域,该段具有富含赖氨酸(K)和丙氨酸(A)的重复序列(KAAPAK和KAAAK),这些重复序列的数量(尤其是其中的赖氨酸残基的含量)与HBHA对宿主细胞的黏附能力有关[2, 4]。这些序列里的赖氨酸通常含有1~3个甲基组成的侧链[2]。甲基化能够降低HBHA的等电点,提高HBHA在环境中的稳定性,促进HBHA与脂质的结合[5]。见图1。
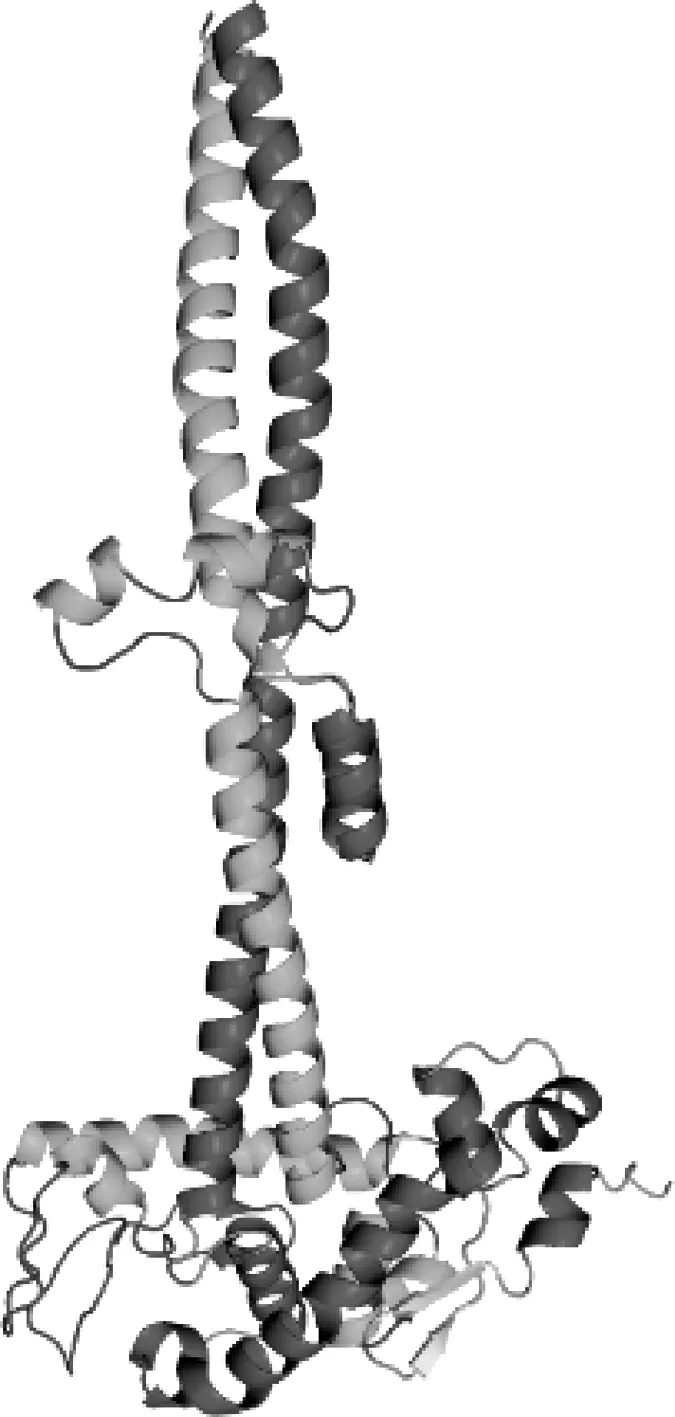
注 HBHA氨基酸序列来自Menozzi等[6]的研究,使用Robetta服务器进行同源建模[7-8],模板为Protein Data Bank中一个基础的卷曲螺旋模型3HNW[9],再使用GalaxyRefineComplex服务器优化[10],最后用开源版pymol 2.5(The PyMOL Molecular Graphics System, Version2.5, Schrödinger公司)进行可视化图1 H37Rv株结核分枝杆菌HBHA二聚体预测模型
HBHA主要存在于细菌表面,与其黏附功能相适应;此外,HBHA也会被分泌到菌体外。但是,HBHA在细菌表面的分布并不是均质性的,HBHA分子聚集成纳米尺度大小的“黏着体”散布在细菌表面。一个推测是,HBHA分子因为拥有卷曲螺旋结构域,所以具有同源蛋白相互作用,这可能是其聚集形成黏着体的原因。还有一种推测是,“黏着体”中可能还存在着除了HBHA以外的蛋白,多种分子的相互结合促使了这一结构的出现[11]。
Delogu等[12]在2006年发现,结核分枝杆菌在感染A549上皮细胞后显著提高了HBHA的表达;而在感染巨噬细胞时,HBHA一直保持较低的表达水平;在经气溶胶接种的小鼠身上,肺部细菌HBHA的表达量比在脾脏高,说明肺上皮细胞内的环境能够促进细菌表达HBHA。这种上调过程可能涉及到Rv0613c假定蛋白,因为Rv0613c与HBHA在细胞膜上的定位相关[13]。在Lanfranconi等[14]的研究中,致病性分枝杆菌的HBHA基因与其上游的转录调节因子调节区存在较长的基因间区,可以容许一些转录调控因子如SigF因子及其他的Sigma因子、HBHR等的识别,而非致病性的分枝杆菌的这一区域不存在或很短。这些转录因子有可能将HBHA的表达水平与细菌面临的环境压力联系起来。
HBHA的功能
一、HBHA可以黏附上皮细胞并扩散感染
许多分枝杆菌,包括致病性(结核分枝杆菌、牛分枝杆菌、副结核分枝杆菌、麻风分枝杆菌等)和非致病性(耻垢分枝杆菌)分枝杆菌都能表达自己的HBHA蛋白,各种细菌的HBHA在氨基酸序列、结构和黏附能力上有所差别[15]。致病性分枝杆菌的HBHA已被证实可黏附多种上皮细胞,包括Hep2人喉上皮细胞[16]、a-549人Ⅱ型肺泡上皮细胞[17-18]、Caco2肠上皮细胞[19]、16 HBE人支气管上皮细胞[20]。这些证据表明HBHA是致病性分枝杆菌重要的毒力因子,在细菌侵袭、感染机体的过程中发挥了重要的黏附作用。HBHA即使不形成黏着体,也可黏附到宿主细胞上[16]。因此,HBHA形成黏着体,可能的作用是增强黏附作用;或者是促进细胞将细菌内化。
在黏附上皮之后,进一步地,HBHA还可以介导细菌穿透上皮屏障,扩散感染范围。Pethe等[20]在2001年发现HBHA对结核分枝杆菌的肺外感染有重要作用:当细菌的HBHA基因被沉默之后,细菌在脾脏的定植数量明显减少,但在肺脏的定植却不受影响。在2016年,Ryndak等[21]制造了“细菌-A549肺泡Ⅱ型细胞层-可渗透膜-HPAE26人肺动脉内皮”的体外模型,发现单独缺失早期分泌抗原靶蛋白6(early secreted antigenic target of 6 kd,EAST-6),或者同时缺失EAST-6和HBHA都可使穿过这层屏障的细菌数量显著下降,缺乏EAST-6和HBHA的双突变菌株的穿透能力要小于单独缺失EAST-6的单突变株。Menozzi等[16]在2006年的研究中,还发现HBHA触发了内皮细胞的转胞吞作用。这些证据说明HBHA是细菌突破气血屏障的重要因素之一,可以与其他致病因子共同发挥作用。
HBHA的黏附作用可以被肝素阻断,这一现象把我们的视线转向宿主机体内的硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)。HSPG是一种广泛分布在机体内部的蛋白质,执行作为细胞黏附受体、内吞信号受体、细胞因子的贮库、调节形态发育等的功能[22]。有研究表明,小鼠体内有一类HSPG被称为Syndecans(Sdcs),敲除小鼠的Sdc-1与Sdc-4基因可以提高小鼠对肺结核的抵抗力;而过度表达Sdc4会加重结核分枝杆菌对Ⅱ型肺泡上皮细胞的黏附现象[23]。但目前,并没有研究确定直接能和HBHA发生作用的具体HSPG,也不能确定HBHA穿透上皮、促使内皮细胞发生转胞吞活动这两个事件与HBHA的肝素结合能力之间的联系。
二、HBHA的其他功能
Raze等[24]发现,结核分枝杆菌的HBHA参与了细菌内部脂质体的形成。有研究发现,结核分枝杆菌的HBHA能够与分枝杆菌膜蛋白14(mycobacterial membrane protein large 14,MmpL14;与细菌的脂质和铁的运输有关)[13]、胆固醇代谢相关蛋白Rv3568c和Rv3515c[25]、血红素降解蛋白Rv3592[25]发生相互作用。Armstrong等[26]也发现,HBHA是耻垢分枝杆菌的脂质体中含量最为丰富的蛋白质。在范琳琳[27]的研究中,HBHA蛋白能与宿主的磷酸肌醇-4-磷酸接头蛋白2在胞外相互作用,而磷酸肌醇-4-磷酸接头蛋白2是动物机体细胞内的一种糖脂转运蛋白。这些结果说明,HBHA可能参与了细菌内部的物质运输和储存,也可能参与了细菌对宿主营养物质的攫取过程,在细菌的生存中发挥作用。
此外,根据最初发现者Menozzi等[3]的研究,HBHA可以介导细菌彼此聚集、黏附形成生物膜,有学者推测这是因为其卷曲螺旋结构域所介导的作用[2]。而生物膜的形成可以增强结核分枝杆菌对体外环境、抗生素、体内免疫防御的抵抗力[28]。
HBHA与宿主免疫系统的相互作用
一、HBHA与先天性免疫
Mueller-Ortiz等[29]证明了结核分枝杆菌、鸟分枝杆菌和耻垢分枝杆菌表面的HBHA可与人类C3补体结合,并且结核分枝杆菌HBHA的这种作用能够提高细菌进入巨噬细胞的效率。结核分枝杆菌HBHA与C3补体的结合作用也依赖于C端富含赖氨酸的重复序列。
在Menozzi等[16]2006年的研究中,还发现HBHA胶体金颗粒被Hep2上皮细胞内吞后,有部分颗粒脱离了内吞泡,进入到了细胞质中,这说明HBHA可能具有介导细菌从吞噬体中逃离,进入细胞质的作用。在2017年Zheng等[30]的研究中,与对照组相比,表达结核分枝杆菌HBHA蛋白的耻垢分枝杆菌能够使A549上皮细胞中的LC3Ⅱ/LC3Ⅰ比值显著下降,且荷菌量显著提高,说明HBHA蛋白能够抑制肺泡Ⅱ型上皮细胞的自噬活动。
HBHA可以使巨噬细胞发生线粒体损伤及内质网应激进而凋亡的进程,但HBHA如何导致线粒体损伤的具体分子活动过程尚不完全明确[31]。范琳琳[27]通过GST pull down技术发现,进化保守的Toll信号通路接头分子(evolutionarily conserved signaling intermediate in Toll pathway,ESCIT;是线粒体呼吸链蛋白Ⅰ的组成成分之一)可以在胞外与HBHA相互作用。但暂无更直接的证据表明ESCIT就是HBHA损伤线粒体的位点。
HBHA除了导致巨噬细胞的凋亡,还刺激巨噬细胞促炎因子的分泌。2011年,Kim等[32]发现HBHA可以使巨噬细胞NF-κB和p38激活,导致巨噬细胞白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α表达量增加;范琳琳[27]也发现HBHA 可以诱导巨噬细胞向M1状态极化,使其分泌IL-6、IL-12和TNF-α。图2总结了HBHA与巨噬细胞的相互作用。
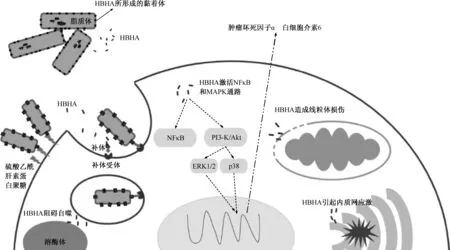
注 肝素结合血凝素通过补体受体进入巨噬细胞后,可以阻碍自噬,造成线粒体损伤和内质网应激,还可以激活NF-κB转录因子及MAPK信号转导通路,后者可以使巨噬细胞释放肿瘤坏死因子α和白细胞介素6;HBHA:肝素结合血凝素图2 HBHA与巨噬细胞的相互作用
二、HBHA与特异性免疫
(一)HBHA特异的细胞免疫
HBHA是一种优良的细胞免疫激活物。经HBHA刺激后,结核分枝杆菌潜伏感染者的外周血单个核细胞(peripheral blood mononuclear cell)分泌的γ-干扰素(IFN-γ)水平远高于无感染者和活动性肺结核患者,类似的结论已经被随后的许多研究所证实[33-37],这提示全身循环中的HBHA 特异性IFN-γ的作用是保护性的,且有可能成为诊断潜伏感染的依据。这些IFN-γ主要来源于外周血CD4+和CD8+T淋巴细胞[38]。Hougardy等[39]发现,结核病患者外周血中HBHA特异的调节性T细胞(CD4+CD25highFOXP3+亚群)显著多于潜伏感染者,这个亚群的T细胞虽然不能抑制感染灶内CD4+和CD8+T淋巴细胞分泌IFN-γ,但是有可能与外周血中IFN-γ水平下降有关[40]。这也提示了全身性的免疫反应在阻止结核病发展的过程中也存在重要作用。
Temmerman等[41]研究证明,分泌HBHA特异性IFN-γ的CD8+T淋巴细胞能够有效促进针对巨噬细胞内的结核分枝杆菌的杀灭作用;这些CD8+T淋巴细胞大多数为记忆性CD8+T淋巴细胞,能发挥颗粒酶依赖的细胞毒作用,杀死负载有HBHA的靶细胞。
在Jung等[42]的研究中,HBHA通过激活Toll样受体4(Toll like receptor 4,TLR4)来促进树突状细胞的成熟,提高了其表面CD40、CD80和CD86、MHC Ⅰ和Ⅱ类分子,以及促炎因子IL-6、IL-12、IL-1β、TNF-α和趋化因子受体7(chemokine receptor 7,CCR7)的表达,增强了树突状细胞在体外和体内的迁移能力,并诱导T细胞向Th1细胞分化和增殖。在Jung等[42]的研究中,还证明了HBHA这种效应在小鼠胸腺瘤治疗中的潜能。
值得注意的是,HBHA介导Th1细胞产生保护作用的部位可能是其具有黏附作用的富含甲基化赖氨酸的C端结构。Temmerman等[43]在2004年证明,原型HBHA(直接从结核分枝杆菌中分离得到的HBHA)与重组HBHA(利用大肠埃希菌表达系统得到的HBHA,没有甲基化修饰)相比,前者使淋巴细胞产生的特异性免疫效果更好,它能使淋巴细胞在面对相应的HBHA刺激时产生更多的IFN-γ和TNF-α,发挥更大的细胞毒效应或杀菌作用。Corbière等[44]在2020年使用肽扫描技术证明,在结核分枝杆菌潜伏感染者中,HBHA的甲基化C端能够刺激其Th1细胞分泌IFN-γ,如果HBHA的C端不是甲基化的,就没有这种刺激效果。
但在Kohama等[45]的试验中,对于Th17细胞来说,非甲基化状态的HBHA配合霍乱毒素佐剂和鼻腔接种,就可以导致IL17的分泌,说明HBHA的刺激活性主要体现在Th1细胞上。
(二)HBHA特异的黏膜免疫
除了细胞免疫,HBHA引起的黏膜免疫也有一定的保护效果。在Pethe等[20]的研究中,使用HBHA特异的抗体孵育后的卡介苗株通过鼻腔接种感染小鼠,可以降低其向肺外传播的能力。Kohama等[45]使用酵母表达的重组HBHA和霍乱毒素(黏膜免疫刺激佐剂)对小鼠进行滴鼻接种,接种后,在免疫组小鼠的血清和鼻腔灌洗液中检测到了显著增多的HBHA特异性IgA抗体;在感染卡介菌后,肺脏荷菌量不受影响,而脾脏荷菌量降低,即黏膜接种HBHA的方法虽然不能抑制结核分枝杆菌在肺内的感染,但是可以抑制其向肺外传播。随后,在该实验室进一步的研究中,将卡介苗与他们制作的这种疫苗使用加强免疫策略接种小鼠,能在小鼠感染结核分枝杆菌的早期降低肺部的荷菌量,但在感染后期却无法提供在肺部的保护效果。他们推测,皮下接种卡介苗可以在全身引发特异性Th1细胞的生成,而鼻腔接种HBHA和霍乱毒素制成的疫苗导致呼吸道产生了Th17反应,表达了趋化因子,进而使全身特异性Th1细胞向肺部趋化,从而提供了抵抗结核分枝杆菌的力量;在感染后期,这种保护效果消失了,他们推测是由于霍乱毒素引起的Th2反应抑制了Th1反应所致[46]。这些研究也说明,免疫策略和佐剂选择对HBHA所引起的免疫反应也有很大的影响。在佐剂方面,Rouanet等[47]使用双十八烷基二甲基溴化铵/单磷酰脂质体A佐剂制作的HBHA疫苗,对BCG初免后的小鼠进行皮下免疫,发现可以有效降低Th2反应。
(三)HBHA特异的体液免疫
但体液免疫对HBHA的反应与细胞免疫和黏膜免疫并不相同,HBHA特异的IgG似乎并不能提供保护力。在Masungi等[38]的研究中,活动性结核病患者的血清抗HBHA抗体水平远高于潜伏感染者,而未感染者和卡介苗接种者血清中都检测不到抗HBHA抗体。Rouanet等[47]使用HBHA疫苗与卡介苗加强免疫小鼠,发现HBHA特异的抗体与这种免疫策略所提供的保护力无统计学关联。在Parra等[48]的研究中,向小鼠体内注射抗结核分枝杆菌HBHA的单克隆抗体以进行被动免疫,再攻菌,发现无论是肺脏、肝脏还是脾脏的荷菌量,被动免疫组都与空白组和对照组没有区别。这说明HBHA的血清IgG抗体并不能给机体带来有效的保护性免疫,但可以作为一个区分潜伏感染者和活动性结核病患者的诊断标志。
然而,在Belay等[49]的一项队列研究中,还发现未经治疗的结核病患者血清中HBHA特异性的IgA比未感染组和潜伏感染组要低,也可作为诊断或治疗监测指标。这可能提示HBHA特异的血清IgA是有保护性的。关于血清IgA在感染免疫中的作用少有研究,在目前的一些研究中,血清IgA可以通过调理作用促进血液中的病原被清除,还可以诱导中性粒细胞发生呼吸爆发[50]。虽然机制不明,但HBHA特异的IgG和IgA具有诊断的应用意义。
(四)小结
HBHA特异的细胞免疫能引发机体对结核病的保护作用,但HBHA特异的体液免疫却没有保护效果。尽管提供的保护效果不尽相同,但和结核分枝杆菌其他免疫原一样,这二者在活动性肺结核患者和结核分枝杆菌潜伏感染者中是不同的,可以开发和研究其作为诊断结核分枝杆菌潜伏感染依据的方法。
HBHA特异的黏膜免疫能够抑制肺外结核的产生,这无疑是非常具有治疗或免疫保护意义的。
总 结
首先,HBHA对上皮的黏附与穿透能力是分枝杆菌对呼吸道造成疾病的重要因素。该过程中的具体HSPG受体有待揭露。Pethe等[20]和Fukui等[46]的研究提示,HBHA特异的黏膜免疫虽然可以较为有效地阻止其向肺外传播,但却并不能阻止细菌在肺内定植,也无法在感染后期提供保护,这可能是因为介导分枝杆菌进入上皮细胞的还有其他毒力因子(如EAST-6)。因此,仅仅针对HBHA的抗黏附疗法(如阻断HBHA与HSPG的结合,或者影响HSPG的下游信号)可能并不足以完全抵抗结核病。同理,如果将HBHA 作为一种对抗结核病的疫苗,仍需要与其他免疫原和佐剂进行搭配,因为仅仅HBHA特异的免疫反应是不足以抵抗结核病的。
由于潜伏感染者与活动性结核病患者的HBHA特异的细胞免疫也存在差异,具体表现为外周血单个核细胞分泌的IFN-γ量不同,Tang等[51]证明了这种不同可以区分潜伏感染和活动性结核病;Chedid等[52]证明了这种特异的IFN-γ的量可以用于区分不同程度的结核病。Dreesman等[53]利用这一点来检测结核病低发病率地区的儿童结核病患者;Benhadou等[54]将其用于对银屑病患者的结核病风险分级。
HBHA的保护作用主要体现在它能够引起机体的细胞免疫。这使得其具有作为免疫佐剂和刺激细胞免疫的潜能,可以在缺乏细胞免疫的生物制品中发挥作用。已经有学者将HBHA作为免疫增强剂应用于口蹄疫疫苗[55]和肿瘤治疗[42]中。通过计算机模拟设计疫苗的方法,Vivekanandam等[56]将HBHA应用到新型冠状病毒肺炎疫苗的设计中;Muhammad等[57]将HBHA应用到2型糖尿病疫苗的设计中。
另外,HBHA具有亲嗜上皮的性质。利用这一点,HBHA 偶联的免疫原或者药物可以被引导到上皮组织。目前,已有一些学者将HBHA与结核分枝杆菌的其他抗原一起制成接种在呼吸道黏膜上的新型疫苗,将其亲嗜肺上皮、促进扩散的能力转为靶向作用,使疫苗靶向肺部,扩散免疫反应的范围,并且产生了一定的保护效果[58-59]。
因此,HBHA对细胞免疫的刺激能力,以及亲噬呼吸道上皮的能力是可以加以利用的;但需要考虑的是,这些应用了HBHA辅助防治非结核病的疫苗,是否会增加那些通过HBHA诊断结核病的试剂或方法的假阳性率。
同结核分枝杆菌许多抗原一样,结核分枝杆菌潜伏感染者、活动性结核病患者、未感染者对HBHA的特异性免疫存在异质性,因此HBHA可以作为诊断抗原帮助控制结核病,也可以借助这种异质性,进一步去探索潜伏感染者与活动性结核病患者之间免疫反应的差异,从而了解更多结核病的发病机制。
