水稻DUF642家族基因的鉴定及在非生物逆境中的表达分析
2022-01-05王晓睿胡琴杜雪竹盛锋
王晓睿,胡琴,杜雪竹,盛锋
(湖北大学生命科学学院, 湖北 武汉 430062)
0 引言
水稻是世界三分之一以上人口的主食,提供的热量占绝大多数人每日摄入热量的80%[1]. 据统计,在种植水稻的过程中,水稻的产量潜力本可达10 t/hm2,但当地农民的平均收获量仅在4~5 t/hm2之间[2]. 水稻产量的巨大差距归因于各种环境胁迫对水稻生长造成的负面影响[3]. 近年来,由于农业生态环境的日益恶劣以及全球极端气候的频繁发生,非生物逆境如干旱、高盐、低温、高温等成为限制水稻产量增长的主要因素. 因此进一步挖掘水稻抗逆相关基因资源,实现抗逆功能基因研究向抗逆育种应用的转化,对保障水稻产业的可持续发展以及国家粮食安全具有重要的意义[4-5]. DUF(domain of unknown function)家族,是指含有未知功能域的蛋白质家族[6],Pfam数据库现包括17 929个蛋白家族,其中近22%属于DUFs蛋白家族[7]. 尽管解析DUFs蛋白的结构和功能是后基因组时代所面临的一大挑战,但近年来迅速发展的基因组学、蛋白组学、生物信息学以及日渐丰富的分子生物学研究方法为此提供了极好的基础[8].
研究表明,大量DUFs基因在植物的生长发育以及对逆境的耐受性中发挥着重要的作用. 拟南芥DUF579家族的所有成员均能够影响植物细胞壁半纤维素主要成分木聚糖的完整性,且DUF579家族成员AGM1和AGM2是高度糖基化的阿拉伯半乳聚糖蛋白(AGPs)的葡萄糖醛酸4-O-甲基化所必需的[9-10]. 与野生型拟南芥植株相比,DUF761-1的过量表达株系表现出叶片变小、根系变短等表型,说明DUF761-1可能参与调控植物的营养器官的生长发育[11]. 在拟南芥中敲除DUF647家族成员RUS4,发现敲除突变体的雄蕊中相对于野生型显著减少,JA途径中与雄蕊和花粉成熟相关转录因子MYB21、MYB24、MYB57和MYB108的表达量显著降低[12],暗示RUS4可能通过影响JA相关基因的表达在协调花药开裂和花粉成熟中发挥作用[13-14]. 在水稻中过表达OsDUF946.4基因,导致LEA蛋白和HKT转运蛋白基因的表达上调,从而增强了水稻对干旱和高盐的耐受性[15]. 以上研究说明,DUF基因家族广泛参与植物的各种生理过程,尤其在植物生长发育以及对非生物逆境响应中发挥重要调控作用.
DUF642 蛋白是一种植物特有的未知功能的细胞壁相关蛋白,属于种子植物特异蛋白,在藻类、苔藓以及蕨类等孢子植物中并未发现[16]. 目前在模式植物拟南芥中共鉴定到10个DUF642基因,其他物种如玉米、水稻、烟草、小麦等陆续也有该基因家族成员的报道[17-18]. 近期有研究对拟南芥10个AtDUF642基因的组织表达模式、亚细胞定位和诱导表达模式进行了系统的研究,结果表明,在不同的发育阶段、组织或逆境刺激下,AtDUF642s表现出明显的时空差异. 如在种子萌发阶段,AtDGR1和At2g34510只能特异地在荫蔽条件下的下胚轴中检测到;在生殖生长阶段,花粉囊中只能检测到AtBDX(At4g32460)的表达;At2g34510和At5g11420在叶片中受干旱胁迫诱导上调表达,但是对脱落酸没有响应;At1g29980和AtBDX受到根结线虫M.incognita诱导上调表达,对不能侵染拟南芥的线虫类型N.aberrans没有响应. 籽粒苋(Amaranthushypochon-driacus)中的AhDGR2基因在干旱和盐胁迫下被显著诱导,在拟南芥中过表达该基因后会导致植物细胞壁变薄以及果胶积累异化,果胶甲酯酶活性显著降低,根系和叶片中的细胞排列异常,根长和叶长也发生明显变化,同时表现出ABA及盐胁迫更加敏感,暗示AhDGR2可能通过调控果胶甲酯酶活性影响细胞壁的结构和完整性,从而调控植物的生长以及对非生物胁迫的耐受性[19].
基于DUF642蛋白家族在植物生命活动中发挥的重要作用,为进一步挖掘和鉴定水稻逆境胁迫响应相关基因,本研究利用生物信息学的方法对水稻全基因组DUF642家族成员进行了鉴定,并对其进化关系、基因结构、蛋白结构、染色体定位、启动子顺式元件进行了系统分析,同时对该家族成员在不同非生物胁迫处理下的表达模式进行了分析,为进一步研究水稻DUF642基因家族的功能提供了参考依据.
1 材料与方法
1.1 材料与试剂粳稻日本晴(OryzaSativaspp.japonica)材料来自本实验室;Eastep® Super Total RNA Extraction试剂盒和GoScriptTMReverse Transcription Kit购自Promega公司;ChamQ Universal SYBR qPCR Master Mix试剂购自Vazyme公司.
1.2 方法
1.2.1 水稻DUF642家族基因的鉴定及理化分析 在国家水稻数据中心(http://www.ricedata.cn/gene/)和RGAP(http://rice.plantbiology.msu.edu)中以“DUF642”为关键词搜索水稻DUF642基因家族成员;同时以拟南芥10个已确定的AtDUF642s基因为诱饵进行blast比对,鉴定获得水稻全基因组中DUF642家族的所有成员及其CDS和氨基酸序列. 利用在线分析软件在线分析工具ExPASyProtParam(https://web.expasy.org/protparam/)对其蛋白质理化信息进行预测. 采用在线分析软件CELLO v.2.5(http://cello.life.nctu.edu.tw/)和PSORT(https://psort.hgc.jp/)进行蛋白亚细胞定位分析. 采用MEGA6.0软件分析水稻DUF642蛋白亚类.
1.2.2 水稻DUF642 家族系统进化树构建 利用Clustal X软件对水稻、拟南芥和玉米的DUF642蛋白进行多重序列比对,将来源于水稻、拟南芥和玉米的DUF642蛋白进行亲缘关系分析并采用MEGA6.0软件中的邻接法(neighbor-joining method, NJ)构建系统进化树,BootStrap 值设定为 1 000.
1.2.3 水稻DUF642家族染色体定位及基因和蛋白质结构分析 利用水稻在线数据库RGAP(http://rice.plantbiology.msu.edu)查询OsDUF642家族成员基因在染色体上的位置坐标进行染色体定位分析. 通过GSDS2.0(http://gsds.cbi.pku.edu.cn/)在线分析软件对水稻DUF642基因结构进行预测分析并绘制基因结构分析图. 利用在线软件Pfam(http://pfam.janelia.org/)对水稻DUF642基因家族的保守基序进行分析.
1.2.4 水稻DUF642启动子顺式元件(cis-element)分析 利用水稻在线数据库RGAP(http://rice.plantbiology.msu.edu)截取6个水稻DUF642基因起始密码子上游1 500 bp的序列,利用在线软件PlantCARE(http://bioinformat-ics.psb.ugent.be/webtools/plantcare/html/)进行启动子预测分析.
1.2.5 水稻DUF642基因响应胁迫诱导的表达模式分析 为明确水稻DUF642基因家族对非生物逆境胁迫的应答机制,采用实时荧光定量 PCR(Real-time PCR)法检测水稻DUF642s响应PEG、低温、高盐和脱水胁迫下的表达模式. 所用材料为粳稻日本晴,用营养液培养至三叶期后进行上述逆境处理. PEG胁迫是将三叶期幼苗放置在含10% PEG6000营养液中;高盐胁迫是将三叶期幼苗放置在含200 mmol/L NaCl营养液中,对照材料放置在正常的营养液中培养,其他培养条件保持一致. 低温胁迫是将三叶期幼苗放置在4 ℃生长箱中,对照材料在正常温度下培养,其他条件保持一致. 分别在处理后0、1、3、6、12和24 h时间点取实验组和对照组叶片样品,液氮速冻后保存在80 ℃冰箱中保存备用. 脱水胁迫是将三叶期幼苗裸露放置在空气中,用吸水纸吸干其根部水分,温度、湿度和光照条件与对照组保持一致,分别在0、0.5、h、3和6 h时间点取样,液氮速冻后保存在-80 ℃超低温冰箱中保存备用;RNA提取与反转录:利用Eastep® Super Total RNA Extraction试剂盒(Promega)对水稻叶片总RNA进行抽提(具体步骤请参照该试剂盒说明书),将RNA保存在-80 ℃超低温冰箱中备用. 利用GoScriptTMReverse Transcription Kit(Promega)进行cDNA合成,将cDNA保存在-20 ℃冰箱中备用. RT-qPCR分析:采用qPrimerDB - qPCR Primer Database(https://biodb.swu.edu.cn/qprimerdb/)设计RT-qPCR引物,以水稻OsActin(LOC_Os03g50885)为内参基因(表1). 利用PowerUp SYBR Green Master Mix (Applied Biosystems) 试剂盒,于CFX ConnectTM Real-Time System(BIO-RAD)进行RT-qPCR扩增,相关反应体系以及参数设置参考试剂盒说明书. 反应结束后分析荧光值变化曲线及熔解曲线, 并采用 2-ΔΔCT计算基因的相对表达量.

表1 水稻OsDUF642s引物
2 结果与分析
2.1 水稻DUF642家族鉴定及基因特征以10个拟南芥DUF642基因为探针,经分析和过滤从水稻基因组中共鉴定得到6个编码包含DUF642结构域的基因,将这些基因分别命名为OsDUF642.01~OsDUF642.06,其编码蛋白质的氨基酸数目介于374~403个,分子量介于在39.85~42.26 kD,等电点介于4.25~9.72. 利用CELLO v.2.5和WoLF PSORT两种软件对OsDUF642s的亚细胞定位进行预测. 结果显示,OsDUF642.02 和 OsDUF642.03 定位于细胞外, OsDUF642.01 定位于细胞核或者细胞外, OsDUF642.04 定位于线粒体或者内质网膜,OsDUF642.05 定位于细胞外或者质膜,OsDUF642.06 定位于线粒体或者细胞外. 利用MEGA6.0 软件分析(neighbor-joining method, NJ)显示,水稻的DUF642蛋白可以分为3个亚类,其中OsDUF642.02、OsDUF642.03和 OsDUF642.06属于亚类I,OsDUF642.01和 OsDUF642.04属于亚类Ⅱ,OsDUF642.05属于亚类Ⅲ,不同成员之间的的同源性极高(表2).
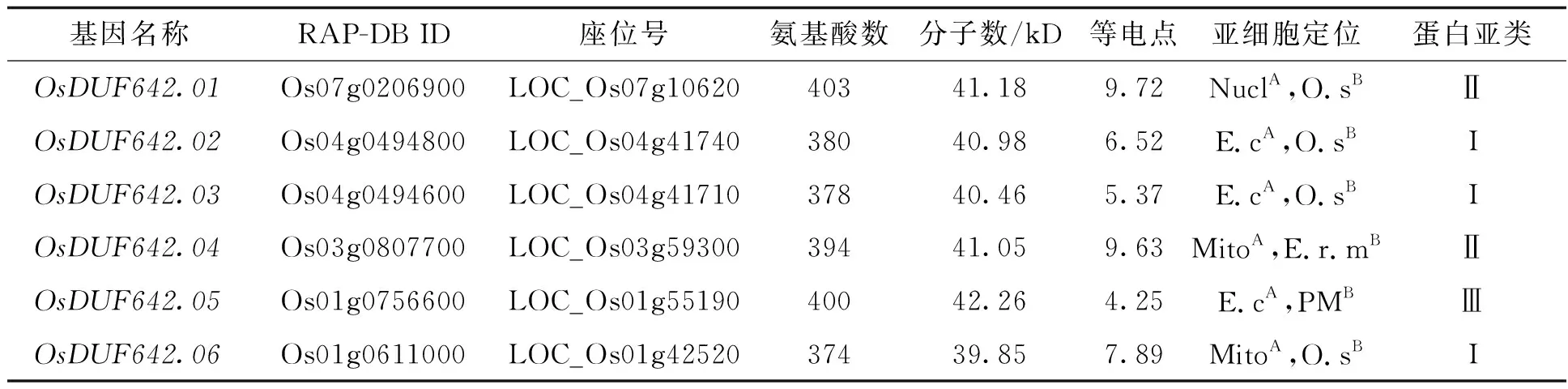
表2 水稻OsDUF642s基因的序列特征
2.2 水稻、拟南芥和玉米DUF642基因家族系统进化树构建将来源于水稻、拟南芥和玉米的DUF642蛋白进行亲缘关系分析并构建系统进化树(图1),发现来源于单子叶植物水稻和玉米的DUF642蛋白亲缘关系更加紧密,与双子叶植物拟南芥DUF642蛋白亲缘关系较远,这可能与单、双子叶植物细胞壁结构以及成分的差异有关. 此外,我们发现OsDUF642.06与拟南芥At4g32460(BIIDXI)同属一个亚类,BIIDXI被报道参与果胶甲酯酶活性调控,从而影响拟南芥的生长以及种子的萌发[20]. OsDUF642.01与拟南芥At3g08030亲缘关系较近,At3g08030被报道能够特异性的与纤维素结合,参与纤维素的结构修饰[21],暗示OsDUF642.06和OsDUF642.01可能具有类似的生物学功能.
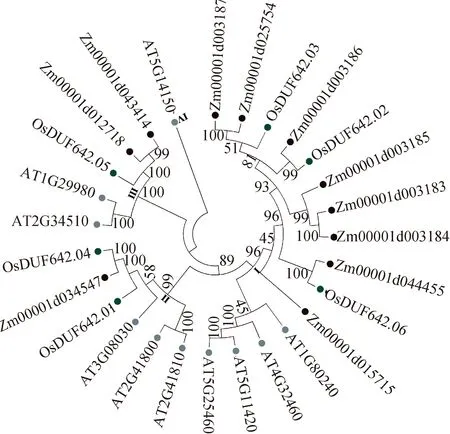
图1 水稻、拟南芥和玉米DUF642蛋白的系统进化树
2.3 水稻DUF642基因的染色体定位在RGAP(http://rice.plantbiology.msu.edu)中查询OsDUF642家族基因在染色体上的位置坐标. 如图2所示,6个OsDUF642基因分布水稻在1号、3号、4号和7号染色体上. 其中,OsDUF642.05和OsDUF642.06位于第1号染色体,OsDUF642.04位于第3号染色体,OsDUF642.02和OsDUF642.03位于第4号染色体,OsDUF642.01位于第7号染色体. 此外,OsDUF642.02和OsDUF642.03在4号染色体上的位置非常接近,且具有紧密的进化关系,因此推测,OsDUF642.02和OsDUF642.03可能为串联复制关系.
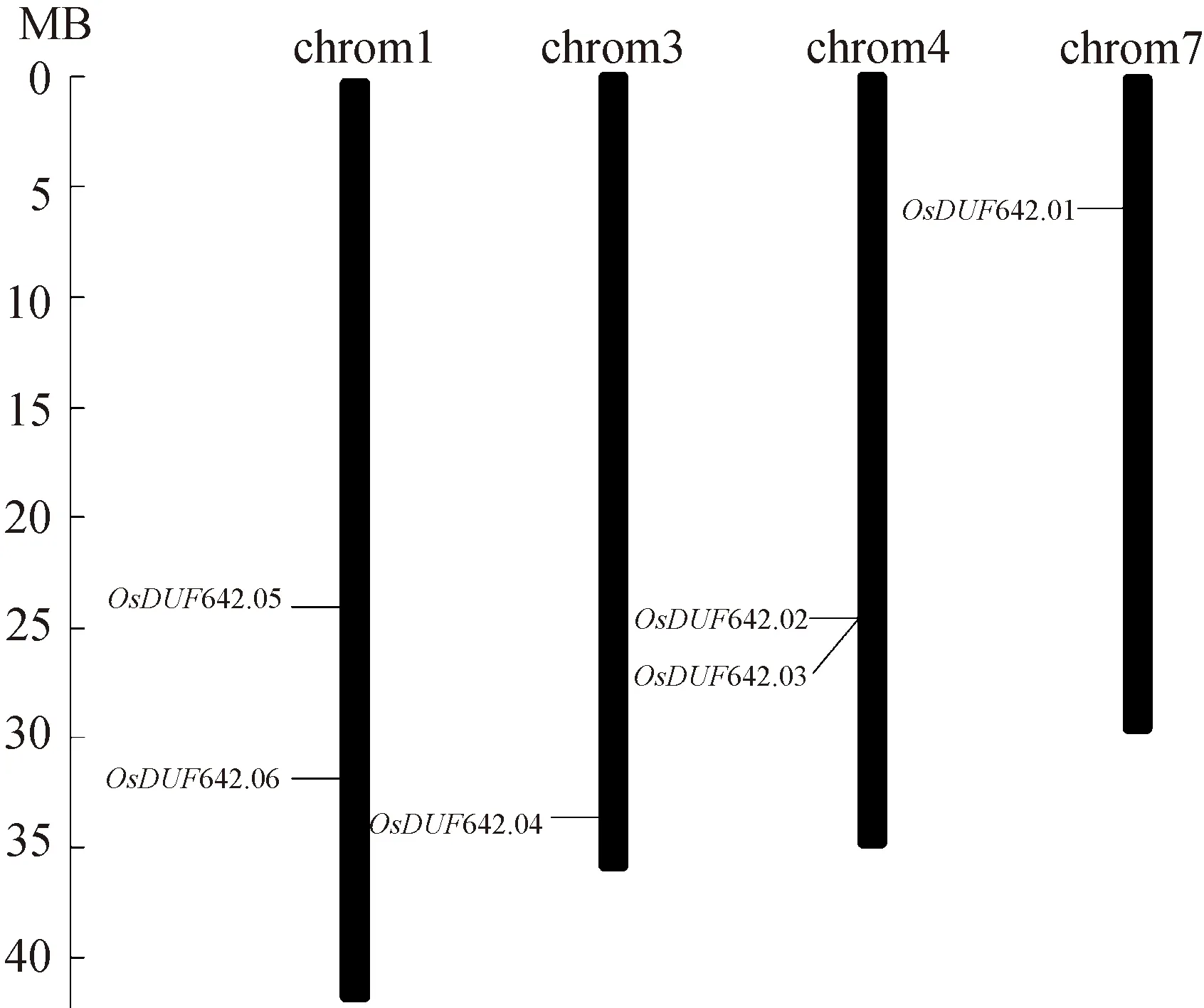
图2 OsDUF642s基因在水稻染色体中定位和分布情况
2.4 水稻DUF642家族基因和蛋白结构分析利用GSDS2.0(http://gsds.cbi.pku.edu.cn/)在线分析软件对水稻DUF642家族基因结构进行分析. 结果显示,大部分OsDUF642s基因结构相似,均有3个外显子和2个内含子(OsDUF642.01~OsDUF642.04). 此外,OsDUF642.05有4个外显子和3个内含子,OsDUF642.06有2个外显子和1个内含子(图3). 使用在线软件Pfam(http://pfam.janelia.org/)对OsDUF642s进行保守结构域预测. 结果显示, OsDUF642s各成员都有2个保守的DUF642结构域(图4). 以上结果说明OsDUF642家族内成员在进化上较为保守.
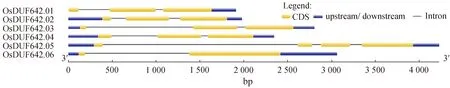
图3 水稻DUF642s基因结构
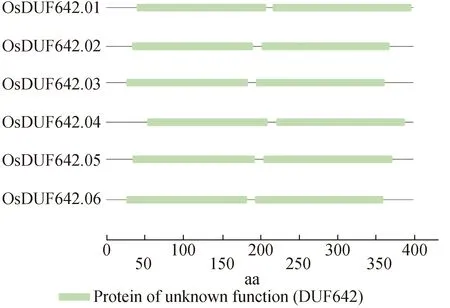
图4 水稻DUF642s蛋白质保守结构域分析
2.5 水稻DUF642家族启动子区域分析在RGAP数据库中下载OsDUF642s基因的上游序列,截取6个OsDUF642基因起始密码子上游1 500 bp的序列作为启动子区段(ProOsDUF642s),利用PlantCARE软进行启动子顺式作用元件预测分析(图5),并从中提取了22类与植物逆境以及激素响应相关的顺式作用元件. 根据功能的差异可以将这22类顺式作用元件分为3类:一类是各种植物激素响应相关元件,包括脱落酸响应元件ABRE(A),生长素响应元件AuxR-core和TGA element(E和T),茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif(G和 U),赤霉素响应元件GARE-motif 和P-box(I和R);第二类是植物逆境尤其是非生物逆境响应相关顺式元件,包括各种类型的光响应元件(B、D、J和M),厌氧诱导元件ARE和GC-motif(C和K),干旱响应元件DRE core(H),低温响应元件LTR(N),干旱诱导MYB转录因子结合元件(O)以及防御和逆境响应元件(S);第三类是各种植物抗逆相关转录因子结合元件,包括HD-ZIP 1转录因子结合元件(L), MYB类转录因子结合元件(P),MYC类转录因子结合元件(Q)以及WRKY类转录因子结合元件 W box(V). 进一步分析发现,这些结果说明了水稻DUF642基因家族可能与水稻生长发育及多种激素和胁迫相关. 在22个顺式元件中,脱落酸响应元件(A)、MYB和MYC类转录因子结合元件(P和Q)为6个ProOsDUF642s基因所共有,暗示OsDUF642s可能参与ABA介导的非生物逆境响应,且MYB和MYC类转录因子在OsDUF642s的转录调控中发挥重要作用. 此外,ProOsDUF642.01和ProOsDUF642.03含有干旱响应元件DRE core(H),ProOsDUF642.01、ProOsDUF642.02、ProOsDUF642.03和ProOsDUF642.06含有低温响应元件LTR(N);ProOsDUF642.03和ProOsDUF642.05含有干旱诱导MYB转录因子结合元件(Q);ProOsDUF642.04含有防御和逆境响应元件(S),ProOsDUF642.01和ProOsDUF642.02含有HD-ZIP 1转录因子结合元件(L),ProOsDUF642.05和ProOsDUF642.06含有WRKY类转录因子结合元件W box(V). 顺式作用元件预测结果表明,OsDUF642基因家族可能在水稻响应非生物逆境中发挥重要作用.

图5 水稻DUF642家族启动子区域分析
2.6 水稻DUF642基因非生物逆境诱导表达模式分析为明确OsDUF642s基因家族在水稻响应非生物逆境中的应答模式,我们对OsDUF642在PEG、低温、高盐以及脱水等胁迫下的诱导表达模式进行了分析. 采用qPrimerDB - qPCR Primer Database设计RT-qPCR引物,以水稻OsActin(LOC_Os03g50885)为内参基因进行RT-qPCR分析. 如图6所示,在PEG处理下,所有的OsDUF642s成员都不同程度受到诱导上调表达,且除OsDUF642.06受PEG诱导先上调表达(1 h)再回到本底水平再上调表达(24 h)外,其余基因均呈现出先上调表达(3 h)再回到本底水平再上调表达(12 h)再回到本底水平的表达模式;其中OsDUF642.01在3 h与Mock相比诱导上调表达倍数最为显著,达29倍;其次是OsDUF642.06在1 h与Mock相比诱导上调表达倍数达12倍,在24 h与Mock相比诱导上调表达倍数达15倍. 在冷处理下,除OsDUF642.06受冷诱导先上调表达,在3 h达到峰值后表达量逐渐下降至本地水平(12 h)然后略微上调表达外,其余OsDUF642s成员均表现出在冷处理下6 h表达量达到峰值,在12 h表达量下降至比Mock更低的水平,然后再上调表达;其中OsDUF642.01在24 h与Mock相比诱导上调表达倍数最为显著,达14倍,其次是OsDUF642.02在24 h与Mock相比诱导上调表达倍数达12倍. 在盐胁迫下,与Mock相比,除OsDUF642.01差异表达不显著外,其余OsDUF642s成员均不同程度受到NaCl诱导差异表达,且均表现出在3 h表达水平达到峰值逐渐下降至本底水平,个别基因在12 h和24 h与Mock相比表达量显著下降;其中OsDUF642.06在3 h与Mock相比诱导上调表达倍数最为显著,达12倍. 在脱水胁迫下,除了OsDUF642.06显著受脱水胁迫诱导下调表达外,其余基因均在6 h显著上调表达,其中OsDUF642.04最为显著,差异表达倍数达8倍(图7). 以上结果说明,OsDUF642基因家族广泛参与水稻对多种非生物逆境的抗性响应中,且同一个基因对不同的非生物逆境响应模式有明显差异.
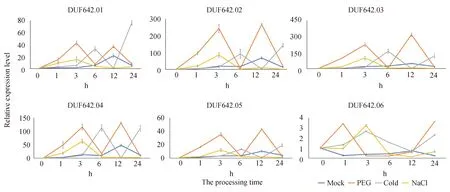
图6 水稻DUF642基因在10% PEG模拟干旱、低温和盐胁迫下的表达模式分析
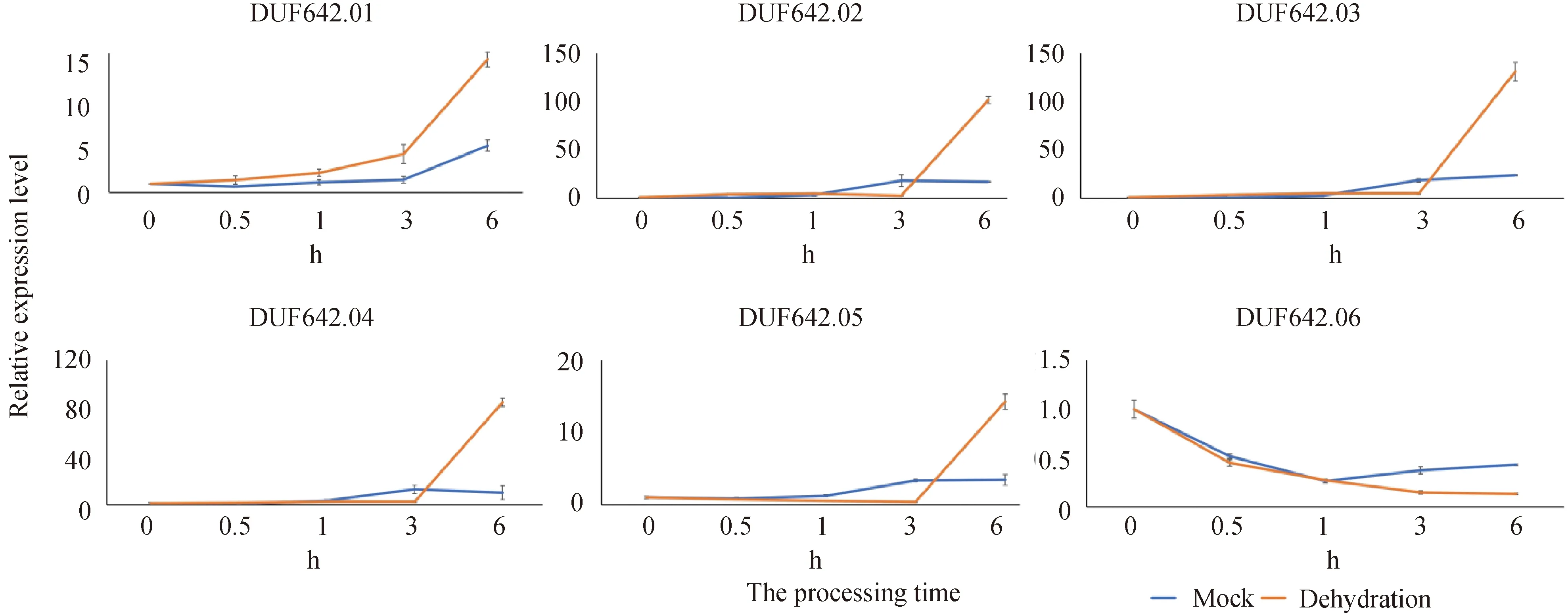
图7 水稻DUF642基因在脱水胁迫下的表达模式分析
3 讨论与结论
近年来,随着基因组测序技术的不断发展,包括水稻在内的多种植物的全基因组序列数据库的信息也不断地完善和更新[22-23]. 与此同时,Pfam数据库中DUF基因家族所占比例在近几年也有所增加. 越来越多的研究表明,DUF基因家族参与植物的各种生命活动,尤其是生长发育以及对各种逆境胁迫因子的响应[24]. 利用生物信息学的方法对DUF基因家族进行成员鉴定、理化性质分析、顺式作用元件预测,同时结合表达谱数据以及逆境胁迫下的表达分析,为了解这些DUF基因家族的起源、多样性和生物学功能提供了参考依据[25-26]. DUF642是一个高度保守的植物特异性的未知功能细胞壁相关蛋白家族,在拟南芥中的研究表明,该基因家族可能与果胶的结构修饰有关[20],并且在植物生长发育和逆境响应中起着重要作用[27].
基于DUF642基因家族在植物生长发育和非生物逆境响应中的重要功能,本研究对水稻DUF642基因家族成员进行了鉴定,并结合生物信息学的研究方法,对其染色体定位、基因结构、编码蛋白的理化性质以及启动子区段顺式作用元件进行了全面分析. 在水稻中共鉴定到6个DUF642家族成员(OsDUF642.01~OsDUF642.06),分布在第1号、3号、4号、7号染色体上,其中OsDUF642.02和OsDUF642.03在4号染色体上的位置非常接近,且进化上联系紧密,因此推测OsDUF642.02和OsDUF642.03可能为串联复制关系. 对来源于拟南芥、玉米和水稻的DUF642s蛋白进行系统进化树分析,发现来源于单子叶植物水稻和玉米的DUF642蛋白亲缘关系更加紧密,与双子叶植物拟南芥DUF642蛋白亲缘关系较远,这可能与单、双子叶植物细胞壁结构以及成分的差异有关. 基因结构和蛋白质保守结构域分析表明,OsDUF642s基因结构类似,大多都含有3个外显子和2个内含子,其编码蛋白均包含2 个保守的 DUF642结构域,进一步说明水稻DUF642成员间在进化上的保守性. 蛋白质正确的亚细胞定位与其功能实施密切相关,利用多种软件对OsDUF64s进行亚细胞定位预测,结果表明大部分OsDUF64蛋白都具有细胞外定位特征,SignalP-5.0 Server软件预测显示6个OsDUF64蛋白均含有胞外分泌信号肽,可能与该蛋白家族参与细胞壁果胶结构修饰相关. 此外,OsDUF642.01还可能定位于细胞核,OsDUF642.04可能定位于线粒体或者内质网膜,OsDUF642.05 可能定位于质膜,OsDUF642.06 可能定位于线粒体. 进一步利用TargetP-2.0 Server(http://www.cbs.dtu.dk/services/TargetP/)对OsDUF642.01、OsDUF642.04、OsDUF642.05和OsDUF642.06的亚细胞分拣信号肽进行预测,并未发现相应的分拣信号,说明了OsDUF642家族蛋白定位的复杂性,其准确的亚细胞定位情况仍需进一步实验验证.
进一步对OsDUF642基因家族成员启动子区段顺式作用元件进行分析后发现,OsDUF642s启动子区段均含有多种植物激素响应相关、非生物逆境响应相关以及逆境相关转录因子结合顺式元件,表明OsDUF642s在水稻响应非生物逆境中的潜在功能. 在上述多种顺式作用元件中,脱落酸响应元件(A)、MYB和MYC类转录因子结合元件(P和Q)为6个ProOsDUF642s基因所共有,暗示OsDUF642s可能参与ABA介导的非生物逆境响应,包括干旱、高温、盐胁迫等[28];且MYB和MYC类转录因子在OsDUF642s的转录调控中发挥重要作用,后续研究可以通过挖掘与ProOsDUF642s直接互作的MYB和MYC类转录因子,解析水稻在非生物逆境刺激下调控OsDUF642s表达的分子机制. 此外,ProOsDUF642.01和ProOsDUF642.03含有干旱响应元件DRE core(H),ProOsDUF642.01、ProOsDUF642.02、ProOsDUF642.03和ProOsDUF642.06含有低温响应元件LTR(N);ProOsDUF642.03和ProOsDUF642.05含有干旱诱导MYB转录因子结合元件(Q);ProOsDUF642.04含有防御和逆境响应元件(S),ProOsDUF642.01和ProOsDUF642.02含有HD-ZIP 1转录因子结合元件(L),ProOsDUF642.05和ProOsDUF642.06含有WRKY类转录因子结合元件 W box(V). 顺式作用元件分析表明OsDUF642s在ABA介导的抗逆响应中可能有着相似的功能,但是其他非生物逆境响应元件的存在可能赋予个别OsDUF642基因在水稻应对其他非生物胁迫如低温、厌氧胁迫等方面的不同功能;另外,个别OsDUF642s所含有的特殊转录因子结合元件如HD-ZIP 1转录因子结合元件(L)、WRKY类转录因子结合元件 W box(V)等,表明其表达水平可能存在特异的调控模式.
对水稻DUF642基因家族在不同类型的非生物胁迫下的表达的分析,进一步验证了启动子顺式作用元件预测的准确性以及OsDUF642s对非生物胁迫的响应模式. 在PEG胁迫下,所有OsDUF642s成员都不同程度地诱导上调表达,可能与其启动子区段均含有ABA响应元件相关,其中OsDUF642.01在3 h与Mock相比诱导上调表达倍数最为显著,可能与其启动子区段还含有干旱响应元件DRE core相关. 在冷胁迫下,所有OsDUF642s成员都不同程度地诱导上调表达,其中上调表达倍数较高的有OsDUF642.01、OsDUF642.02、OsDUF642.03和OsDUF642.06,可能与其启动子区段均含有低温响应元件LTR(N)有关. NaCl胁迫下,除OsDUF642.01差异表达不显著外,其余OsDUF642s成员均不同程度受到NaCl诱导上调表达,其中OsDUF642.06上调最为显著;虽然在OsDUF642s启动子区段并未鉴定到直接与盐胁迫响应相关的顺式作用元件,但是ABA响应元件、HD-ZIP 1转录因子结合元件以及WRKY类转录因子结合元件 W box等均在植物响应盐胁迫中发挥着重要的作用[29-30]. 在脱水胁迫下,除了OsDUF642.06显著受脱水胁迫诱导下调表达外,其余基因均在6 h显著上调表达,其中OsDUF642.04最为显著,可能与OsDUF642.04启动子区段除了含有脱落酸响应元件外还含有防御和逆境响应元件(S)有关. 上述结果表明,启动子所含有的顺式作用元件类型与该基因可能参与的生理过程息息相关,这对探索DUF类基因家族功能具有重要意义. 有趣的是,我们还发现,OsDUF642.06在PEG、冷胁迫和脱水胁迫下的表达模式与其他5个基因明显不同,推测可能与其启动子区段含有WRKY类转录因子结合元件 W box相关,挖掘与OsDUF642.06直接互作的WRKY类转录因子可能对解析其生物学功能及调控路径具有重要意义;OsDUF642.06受PEG渗透诱导显著上调表达,但受脱水胁迫这种极端干旱处理诱导下调表达,说明OsDUF642.06在两种水分胁迫下可能有不同的生物学功能,而水稻中也可能存在某种机制区分两种水分胁迫类型,从而启动不同的OsDUF642.06响应模式. 此外,通过非生物诱导表达模式分析,我们鉴定到OsDUF642.01和OsDUF642.06受PEG胁迫诱导上调表达最为显著,OsDUF642.01和OsDUF642.02受冷胁迫诱导上调表达最为显著,OsDUF642.06受NaCl胁迫诱导上调表达最为显著,OsDUF642.04受脱水胁迫诱导上调表达最为显著,以上基因可以作为候选基因进一步研究其在水稻抵御响应非生物逆境中的生物学功能,并为改良水稻抗逆能力提供基因资源.
