广东省乙型病毒性肝炎疫苗接种指引在社区婴幼儿中的实施效果*
2022-01-04黄杰雷卫凤阮细河
黄杰 雷卫凤 阮细河
慢性乙型肝炎(CHD)是通过体液、母婴、血液等途径传播感染乙型肝炎病毒(HBV)而引起肝脏发生纤维化和/或不同程度的炎症坏死的一类慢性疾病[1]。CHD早期可反复出现乏力、食欲减退等症状,随病情进展,可出现蜘蛛痣、肝脾肿大等临床表现,严重者可出现失代偿肝硬化、肝癌,威胁患者生命安全[2]。数据显示,世界上约有2.57亿慢性HBV感染者,并呈世界性流行发展,不同地区的流行强度存在较大差异,其中携带HBV的孕产妇约有40%以上会传染给婴儿[3-4]。母婴传播方式包括围生期传播、分娩后传播、宫内感染,而相关研究发现采取剖宫产并不能降低新生儿感染率[5]。现阶段,普遍认为预防控制CHD最有效安全的唯一措施为全程接种乙肝疫苗。既往,婴幼儿全程接种5 μg乙肝疫苗预防控制乙肝传播的效果有限。目前,广东省疾病预防中心推荐接种全程0-1-6月三剂次乙肝疫苗10 μg。同时相关研究发现,HBsAg阳性孕产妇所生新生儿采用疫苗联合乙型肝炎免疫球蛋白(HBIG)存在较高的母婴阻断率,有益于预防传播乙肝[6]。本省关于社区婴幼儿应用乙型病毒性肝炎疫苗接种指引的相关报道较少,因此笔者将“指引”应用于本社区,并探讨5 μg和10 μg的乙肝疫苗的效果和安全性,以便“指引”顺利推行应用,现报道如下。
1 资料与方法
1.1 一般资料
选取社区2017年1月-2018年6月乙型肝炎表面抗原(HBsAg)阳性孕产妇所生新生儿360例为研究对象,纳入标准:(1)均为生后12 h内的新生儿,且母亲HBsAg均为阳性;(2)均无发热。排除标准:(1)体重低于2 kg;(2)伴免疫功能缺陷等疾病[7]。按照乙肝疫苗(酵母)接种剂量不同将其分为5 μg组(180例)和10 μg组(180例)。其中5 μg组男108例,女72例。10 μg组男110例,女70例;两组一般资料比较,差异无统计学意义(P>0.05),有可比性。所有婴幼儿家属均对本研究知情同意,并签署接种知情同意书。本研究经笔者所在医院医学伦理委员会批准。
1.2 方法
1.2.1 接种方法 所有婴幼儿均于生后12 h内接种一剂次乙肝免疫球蛋白(HBIG)(剂量≥100 IU),HBIG接种部位为大腿前外侧中部,同时10 μg组和5 μg组均按照全程0-1-6月三剂次重组乙型肝炎疫苗分别应用10 μg和 5 μg(汉逊酵母,S20123008,规格为10 μg)进行接种,均采用肌肉注射,注射部位为右上臂三角肌。第1次乙肝疫苗接种时间为新生儿出生后24 h内进行接种,剩下2剂次分别间隔1、6个月进行第2次和第3次乙肝疫苗接种。
1.2.2 检测方法 所有婴幼儿均于接种后1、3、6个月测定抗-HBs水平,接种后1、2年测定HBsAb水平,检验科医师抽取婴幼儿空腹肘静脉血5 ml置于试管中,静置 30 min,以 3 000 r/min 速度离心 10 min,取上层血清液,采用酶联免疫法、固相放射免疫法分别测定抗-HBs和HBsAb水平,试剂盒均由上海科华生物工程股份有限公司提供,严格按照试剂盒说明书进行操作。其中抗-HBs阳性和阴性分别为吸光度值大于和小于参考值(10 IU/L)。HBsAb阳性、低应答、无应答时应参照其值,分别为≥10 mIU/ml、2.1~9.9 mIU/ml、<2.1 mIU/ml[8-9]。
1.3 观察指标及评价标准
(1)比较两组不同接种阶段的抗-HBs阳转率;(2)比较两组不同接种阶段的HBsAb反应情况;(3)比较两组不良反应发生情况:包括轻微吐奶、红肿、硬结、腹泻等。
1.4 统计学处理
本研究数据采用SPSS 21.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组不同接种阶段抗-HBs阳转率比较
10 μg组接种后1、3、6个月抗-HBs阳转率均明显高于5 μg组,差异有统计学意义(P<0.05),见表1。
2.2 两组不同接种阶段的HBsAb反应情况比较
10 μg组接种乙肝疫苗1、2年后HBsAb阳性率明显高于5 μg组,差异有统计学意义(P<0.05)。接种后2年HBSAb无应答率、接种后1年HBsAb低应答率均低于5 μg组,差异有统计学意义(P<0.05),见表2。
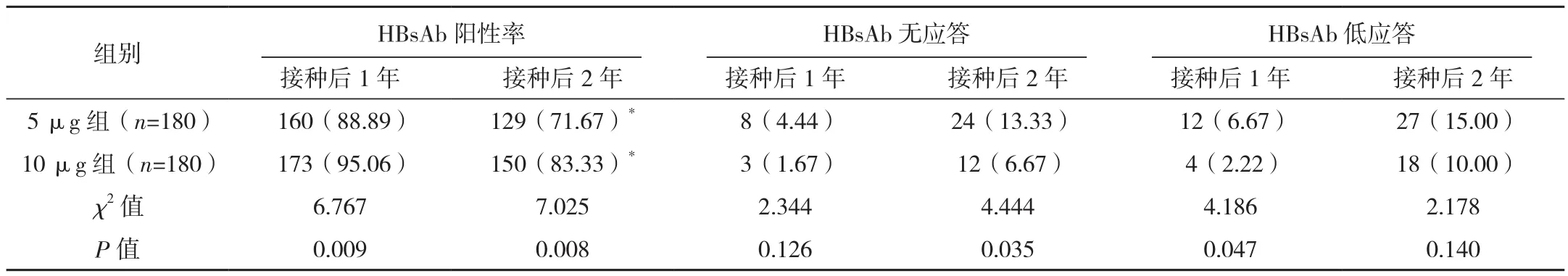
表2 两组不同接种阶段的HBsAb反应情况比较 例(%)
2.3 两组不良反应情况比较
两组不良反应发生率比较,差异无统计学意义(P>0.05),见表 3。

表3 两组不良反应情况比较 例(%)
3 讨论
CHD是全球所面临的公共卫生问题,CHD患者和HBV携带者均是主要的传染源,其中HBV携带者无论处于急性期还是潜伏期、慢性期均存在经血液传播的风险性[10]。母婴垂直传播的血源性是指母体血液内的HBV趁胎盘微血管发生破损时随之进入胎体内,造成胎儿宫内感染;还可于分娩过程中经胎儿的皮损处沾染母亲的血液、羊水等物质导致感染[11-12]。数据显示,母婴传播者约占我国HBV携带者的1/3。因此,降低乙肝传染率至关重要的时阻断母婴传播[13]。目前,全球均未攻克治愈CHD的难关,但可通过注射乙肝疫苗达到预防控制的效果。
我国2002年已将乙肝疫苗归入儿童免疫规划,2013年广东省推荐接种10 μg乙肝疫苗,乙肝疫苗为降低我国儿童感染HBV做出了巨大贡献[14]。本研究结果显示,10 μg组接种后1、3、6个月抗-HBs阳转率均明显高于5 μg组,与文献[14]结果基本相符,提示接种10 μg乙肝疫苗更具优势;10 μg组接种1、2年后HBsAb阳性率明显高于5 μg组,接种后2年HBsAb无应答率、接种后1年HBsAb低应答率低于5 μg组,差异均有统计学意义(P<0.05),说明接种10 μg乙肝疫苗婴幼儿体内抵抗HBV能力较强;两组不良反应发生率比较差异无统计学意义(P>0.05),说明接种10 μg乙肝疫苗不存在增加不良反应的风险性,两者具备相似的安全性。研究证实,接种低剂量的乙肝疫苗不足以让体内产生足量抵抗HBV感染的保护性抗体[15]。体内抗-HBs滴度水平是通过接种乙肝疫苗诱发所产生并用以抵抗HBV侵犯感染,一般滴度随接种乙肝疫苗的针剂次而升高。一旦机体受到HBV的侵犯,体内所产生的保护性抗体会立即将其清除阻碍HBV感染,同时不会增加肝脏负担。婴幼儿接种乙肝疫苗所产生的抗体滴度会随着接种年限的延长而降低,抗体滴度水平减低代表机体抵抗HBV感染的能力随之减弱,因此可根据滴度水平参照“指引”进行增加疫苗接种剂量或次数,以便提高机体抵感染的能力。张丽等[16]研究发现,接种5 μg乙肝疫苗新生儿的抗-HBs阳性率明显低于接种10 μg乙肝疫苗的新生儿。冯梦飞[17]研究发现,婴幼儿应用全程0-1-6月三剂次重组乙型肝炎疫苗10 μg接种,有助于降低HBV感染的风险,同时体内乙肝抗体滴度随接种年限的延长而降低,可适当增加接种剂量或针次。王春清等[18]研究发现,HBsAg阳性孕产妇所生新生儿严格按照“指引”进行规范接种,存在较高的母婴阻断率,降低母婴HBV感染率。
综上所述,广东省乙型病毒性肝炎疫苗接种指引应用于社区有利于规范和加强社区乙肝疫苗接种工作,有效地预防和控制社区乙肝的传播,产生相当的社会效益。
