不同作物根际土壤微生物的群落结构特征分析
2022-01-04陈知青郭安南裘琼芬
唐 杰 陈知青 郭安南 裘琼芬
(1 宁波大学海洋学院,浙江 宁波 315211;2 宁波大学食品与药学学院,浙江 宁波 315211)
根际是土壤和植物相互作用的主要区域。根际微生物是受植物影响最大的土壤微生物群体,也被称为植物的第二基因组,对植物的健康至关重要[1]。植物根系通过向根际释放各种根系分泌物,吸引细菌、真菌、藻类和原生动物[2]等各种微生物在根际的定殖,然后经营养选择与富集作用影响微生物群落的结构和生态功能。微生物通过不同的胞外酶能快速利用可溶性的根系分泌物,获取丰富的有效性碳源及其他营养物质,通过调节土壤有机质分解[3]和提高土壤肥力[4]促进植物生长。此外,根际存在着能防止病原菌定殖的生防细菌,如荧光假单孢菌(FluorescentPseudomonas),该菌部分基因型能生产抗生素氰化氢(hydrogen cyanide,HCN)和2,4-二乙酰基藤黄酚(2,4-diacetylphloroglucinol,Phl)[5],抑制病原菌的生长,增强农作物对生物胁迫的耐受能力[6]。根际微生物在植物养分获取中也发挥着关键作用[7]。土壤-根界面附近可溶性宏观和微量营养素的增加对植物营养吸收有积极的影响。植物根际根瘤菌、促生细菌等通过增加溶解性磷、微量营养素的溶解度等方式提高营养物质的生物利用度[8],直接或间接地向植物提供可利用的氮、磷和其他营养元素[9],促进植物生长发育[10]。根际微生物也可能会提高植物从土壤汲取养料的效率来应对非生物压力,影响植物的根系构型[11],进而调控植物的一系列生理与生态过程。
根际微生物群落组成还受环境条件[12]、土壤理化性质[13]、土壤背景微生物组成[14]和植物发育阶段[15]等多种因素的影响。在对药用植物根际[16]、草原植物根际[17]和荒漠植物根际[18]的土壤微生物群落结构研究中发现,同类型生态环境的不同植物根际土中微生物群落组成、数量和多样性均存在显著差异,植物的不同种类或同种类的基因型对根际微生物群落也有显著影响[1]。然而,植物的种类特征对根际微生物群落影响的潜在机制尚不清楚,识别植物种类变化对土壤微生物群的影响,将有助于了解和控制土壤微生物群落变化,构建有益于植物的健康根际环境。
基于此,本研究通过Illumina MiSeq测序技术和磷脂脂肪酸(phospholipid fatty acid,PLFA)分析在同一农田种植的不同作物根际微生物群落的结构和多样性,探究不同作物的根际土壤敏感微生物,旨在为全面了解植物根系对微生物群落选择和活动的调控机制提供基础,为提高作物产量提供新的技术依据。
1 材料与方法
1.1 试验材料与试验地概况
本试验所选农田位于浙江省宁波市镇海区(121°63′E,29°90′N),该农田土壤类型为黄棕壤,年均气温16.4℃,年均降水量1 488 mm。土壤基础肥力为:有机质38.82 g·kg-1、全氮1.68 g·kg-1、全磷1.12 g·kg-1、速效磷6.27 mg·kg-1、速效钾271.36 mg·kg-1。试验品种:大豆[Glycinemax(L.)Merr.]为浙农8号(浙江勿忘农种业股份有限公司),玉米(Zeamays)为浙甜11号(浙江科诚种业股份有限公司),四季豆(PhaseolusvulgarisL.)为龙丰2号(杭州科丰种子有限公司),豇豆[Vignaunguiculata(L.)Walp]为华赣高产80(江西华农种业有限公司),芋艿[Colocasiaesculenta(L.)Schoot]为奉化大芋艿(浙江宁波奉化芋艿基地),番薯[Ipomoeabatatas(L.)Lam.]和花生(ArachishypogaeaL.)为当地农民主栽品种,由上一年种植留种。
1.2 试验设计
将大豆、玉米、花生、四季豆、豇豆、番薯和芋艿共7种作物种植在农田的不同区域,每块区域面积16 m2,并设置4个采样点作为平行。作物根际土样品采集于2017年7月,大豆、花生、四季豆和豇豆已处于成熟期,玉米处于花粒期,番薯处于盛叶期,芋艿处于结芋期。将作物从土壤中拔出,抖掉大块土壤后,用药勺刮取作物根表土壤作为根际土。2 h内将样品带回实验室,每个样品分成3份,分别用于土壤基因组DNA的提取、PLFA的提取和理化性质的测定。DNA提取、PLFA提取土壤样品冷冻保存于-80℃冰箱,理化性质测定的土壤样品保存于-20℃冰箱。
1.3 测定项目与方法
1.3.1 土壤理化分析 土壤pH值用AZ8601 pH计(台湾衡欣)和溶解法测定,每个土壤样品取5 g,溶解于25 mL蒸馏水中,然后用校准后的pH计测定土壤浸出液的pH值。土壤氨态氮含量采用2 mol·L-1KCl浸提-靛酚蓝比色法测定,硝态氮含量采用酚二磺酸比色法测定[19]。
1.3.2 磷脂脂肪酸(PLFA)测定 根际土壤样品PLFA的提取[20]:称取4 g鲜土放入试管,加入3.2 mL柠檬酸缓冲液、8 mL甲醇和4 mL氯仿进行2次抽提,然后过SPE柱洗掉中性酯和糖酯,用8 mL甲醇洗脱磷脂。加入十九烷基甲酯作为内标甲基化后氮气吹干,加正己烷溶解转移至GC瓶中,定容至60 μL后用气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS)进行测定。
依据生物表征对测定的PLFA进行分类[21-23]:脂肪酸18:0 10-methyl表征厌氧细菌(Anaerobic bacteria);脂肪酸18:2ω6c和18:1ω9c表征真菌(Fungi);脂肪酸14:0 iso、15:0 iso、15:0 anteiso、16:0 iso、17:0 iso和17:0 anteiso用来表征革兰氏阳性菌(gram-positive bacteria,G+);脂肪酸16:1ω7c和16:1ω5c表征Ⅰ型甲烷氧化菌(type Ⅰ methanotroph,Meth Ⅰ);脂肪酸18:1ω7c表征Ⅱ型甲烷氧化菌(type Ⅱ methanotroph,Meth Ⅱ);脂肪酸16:0 10-methyl表征放线菌(Actinomycetes);脂肪酸16:1ω9c、cy17:0ω7c、cy19:0ω7c、18:1ω7c 10-methyl和17:1ω8c用来表征除甲烷氧化菌外的革兰氏阴性菌(gram-negative bacteria,G-);脂肪酸14:0、15:0、16:0、17:0和18:0用来表征其他通用的细菌(other bacteria);脂肪酸20:4ω6c、20:5ω3c和22:6ω3c表征原生动物。
1.3.3 DNA的提取 用FastDNA SPIN Kit for Soil 试剂盒(MP Biomedicals,美国)提取根际土壤的总DNA,NanoDrop 2000超微量分光光度计(Thermo,美国)测定DNA的浓度和纯度。DNA样品保存于-80℃冰箱。
1.3.4 细菌16S rRNA基因扩增及Illumina Miseq测序 采用带标签的细菌通用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-G G A C T A C N N G G G T A T C T A AT-3′)扩增细菌16S rRNA基因的V3~V4可变区。测定凝胶回收纯化(TaKaRa Biotech,日本)后的PCR产物浓度,等量混合不同样品的PCR产物,用MiSeq双末端测序平台(Illumina,美国)进行测序。
1.4 数据分析
测序数据用FLASH软件完成二端序列的拼接[24],用Qiime程序进行后续的分析,剔除嵌合体和质控。步骤主要为剪接掉3个以上质控分小于20 bp且连续的碱基,长度大于300 bp的长序列保留,利用usearch算法剔除嵌合体,用UCLUST将高于97%相似性的序列聚类为分类操作单元(operational taxonomic units,OTUs)[25]。以每个OTU里丰度最高的序列作为代表序列,与Greengenes数据库进行比对,获得OTUs的分类信息。删除古菌、叶绿体、未知序列和在所有样品中只检测到一次的序列。随机选取每个样品37 500条序列进行后续分析。使用软件SPSS 17.0对数据进行单因素方差分析(ANOVA);使用R包vegan进行群落Alpha多样性分析;采用基于Bray-Curtis距离的非度量多维尺度分析和群落相似性分析比较不同作物根际土壤细菌群落组成结构的差异以及显著性检测。利用PLFA数据分析根际土壤真菌与细菌比值以比较不同作物土壤环境变化。使用指示值法筛选根际土壤敏感细菌,利用R软件中的labdsv软件包筛选指示不同作物根际土壤中的敏感生物纲,选取相关性高于0.90且具有显著差异性(P<0.05)的数据。采用Origin 2018制图。
2 结果与分析
2.1 土壤理化性质
不同作物根际土壤理化性质见表1。试验农田土壤为酸性土壤,不同作物根际土壤pH值变化较大。统计分析表明,不同作物根际土壤的pH值、铵态氮和硝态氮的理化性质存在差异,番薯根际土壤的pH值最高,而玉米、四季豆和花生根际土壤的pH值显著低于大豆、番薯和芋艿。芋艿根际土中的铵态氮含量为32.83 mg·kg-1,显著高于其他作物。几种作物的根际土壤中硝态氮含量在1.41~1.59 mg·kg-1之间,花生和四季豆根际土中的硝态氮含量显著高于大豆、豇豆、番薯、芋艿。

表1 不同作物根际土壤理化参数的差异Table 1 Difference in physical and chemical parameters of different crop rhizosphere soils
2.2 根际土壤PLFA组成
由表2可知,筛选除去丰度低于1%且只存在于个别样品中的PLFAs后,剩下的25种PLFAs在不同作物根际土中均有一定含量。不同作物根际土中含有PLFAs的总量存在差异,花生根际土中总PLFAs含量最高,达到30.24 ng·g-1,约为四季豆根际土中总PLFAs含量的2倍,显著高于其他作物。大豆、玉米、豇豆、番薯和芋艿根际土中的总PLFAs含量则无显著差异。对不同PLFAs归类[20]后发现,花生根际土中表征放线菌、Ⅰ型甲烷氧化菌、Ⅱ型甲烷氧化菌和革兰氏阴性菌的PLFAs含量均显著高于其他作物。不同作物根际土中表征革兰氏阳性菌和革兰氏阴性菌的PLFAs含量较高;其次是表征真菌的PLFAs;而表征原生动物和厌氧细菌的PLFAs含量较低。
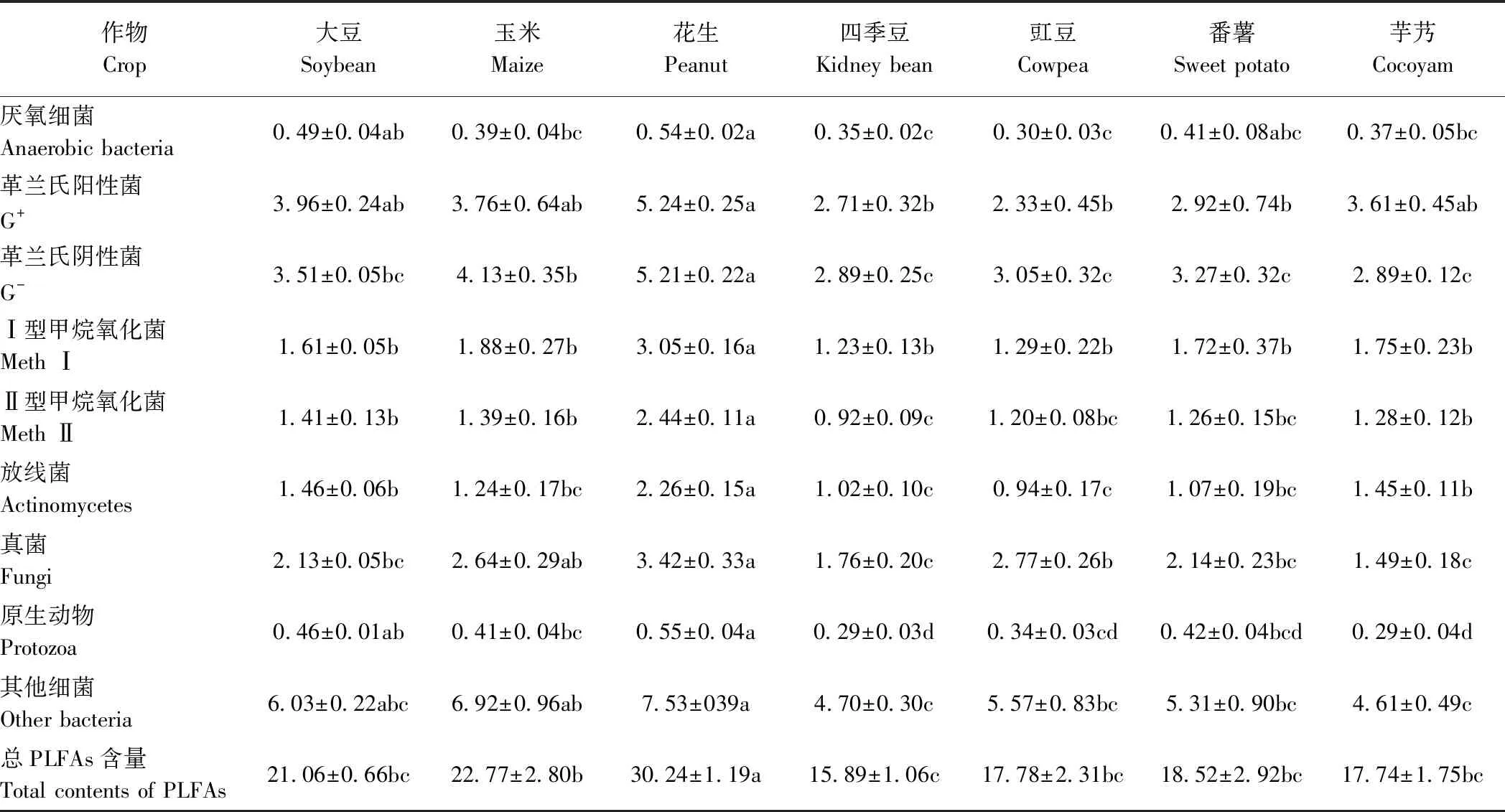
表2 不同作物根际土中PLFAs含量及各类微生物的组成 Table 2 Total phospholipid fatty acids (PLFAs)and microbial compositions of rhizosphere soils across different crops /(ng·g-1)
将表征革兰氏阳性菌、革兰氏阴性菌、Ⅰ型甲烷氧化细菌、Ⅱ型甲烷氧化细菌、放线菌、厌氧细菌和其他通用细菌的PLFAs含量相加作为细菌生物量(B),以表征真菌的PLFAs(18:2ω6c和18:1ω9c)作为真菌生物量(F),计算不同作物根际土中真菌细菌比(ratio of fungi and bacterial,F/B)和革兰氏阳性菌与革兰氏阴性菌比(ratio of gram positive bacteria and gram negative bacteria,G+/G-),结果如图1所示。根际土中的F/B值在不同作物间存在差异,其中豇豆根际的F/B值显著高于其他作物,芋艿根际的F/B值显著低于除大豆外其他作物,大豆、玉米、花生、四季豆和番薯根际微生物的F/B值无显著差异。根际土中的G+/G-值在不同作物间存在差异,其中芋艿根际土中的G+/G-值显著高于玉米、番薯和豇豆,豇豆根际土中的G+/G-值显著低于大豆。
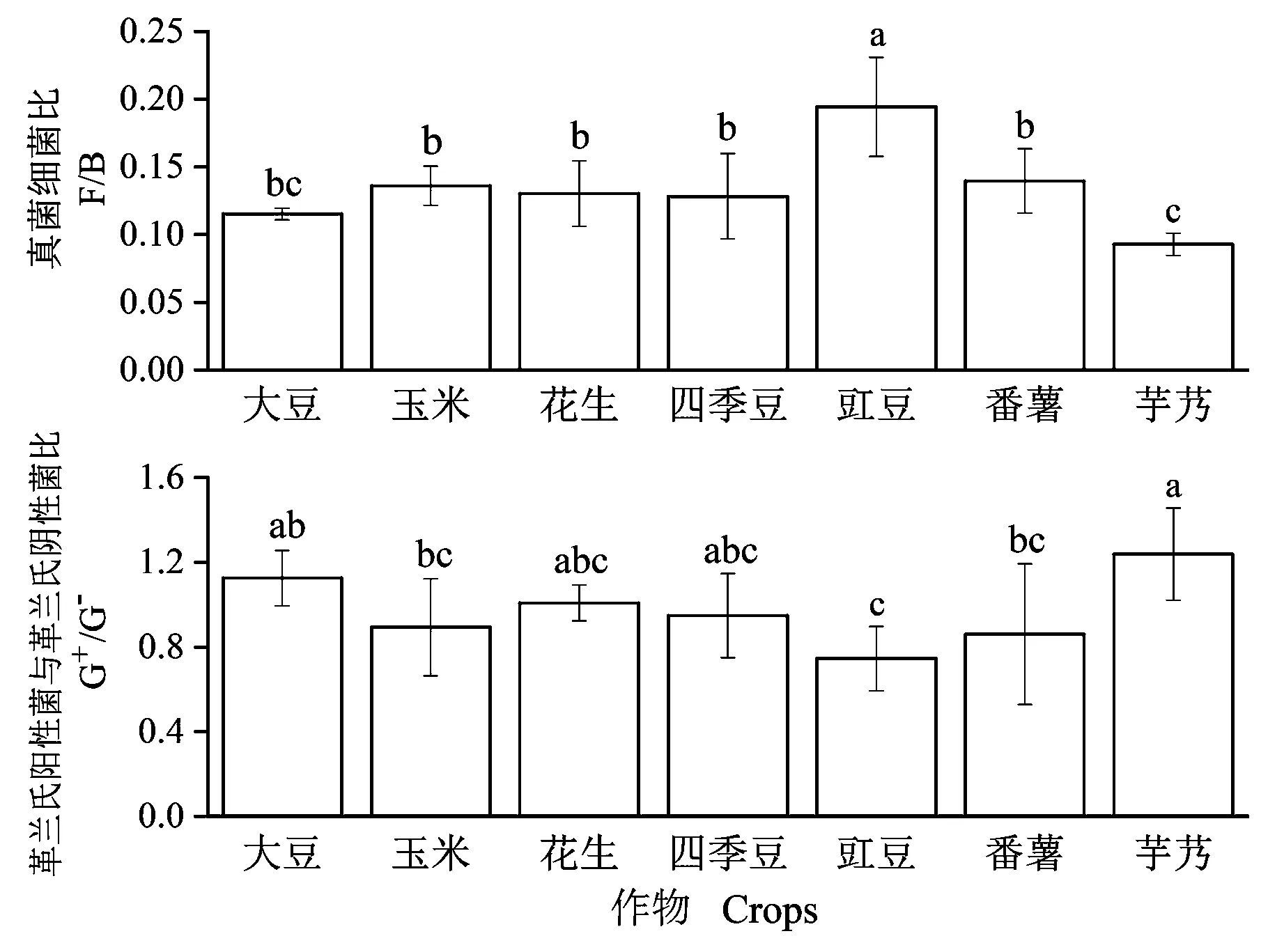
注:不同小写字母表示差异显著(P<0.05)。下同。Note:Different lowercase letters in the same column mean significant difference at 0.05 level.The same as following.图1 不同作物根际土中真菌细菌比和革兰氏阳性菌与革兰氏阴性菌比Fig.1 The ratios of fungi to bacteria and G+ to G-PLFAs under rhizosphere soils of different crops
2.3 根际细菌群落结构与组成
采集的28个样品在97%相似性水平上共获得32 994 个OTUs(均一化每个样品37 500条序列)。将每个OTU中的代表性序列与SILVA数据库进行比较,以确定植物根际细菌群落的结构和组成。由图2-A可知,根际微生物群落以变形菌门(Proteobacteria)为主,7种作物平均相对丰度为46.46%。此外含有放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)和疣微菌门(Verrucomicrobia),合计约占总细菌量的51%。在门水平下,不同作物之间根际土的细菌群落多样性和组成无显著差异。在纲水平(图2-B)和目水平(图2-C)对优势细菌群落的组成和结构进一步分析显示,在纲水平下,变形菌门下的α-变形菌纲是大豆、玉米和花生中的最优势菌,在目水平下放线菌门的放线菌目是大豆、玉米和花生中的最优势菌。α-变形菌纲主要包括根瘤菌目(Rhizobiales)、红螺菌目(Rhodospirillales)、鞘脂单胞菌目(Sphingomonadales)、柄杆菌目(Caulobacterales)和Ellin329,其中根瘤菌目(Rhizobiales)是相对丰度最高的优势菌,在番薯根际土细菌中占10.65%,在四季豆根际土中占9.32%。β-变形菌纲(Betaproteobacteria)主要是伯克氏菌目(Burkholderiales)和SC-Ⅰ-84。γ-变形菌纲(Gammaproteobacteria)中绝大多数菌属于黄单胞菌目(Xanthomonadales)。δ-变形菌纲(Deltaproteobacteria)则主要为粘球菌目(Myxococcales)。除此以外,放线菌门中以放线菌目(Actinomycetales)、盖勒氏菌目(Gaiellales)和酸微菌目(Acidimicrobiales)为主,其中放线菌目是仅次于根瘤菌目第二主要菌,虽然在番薯根际细菌中的相对丰度不高(6.61%),但在大豆根际土细菌中的相对丰度高达9.61%。酸杆菌门中含有酸杆菌目(Acidobacteriales)、索利氏菌目(Solibacterales)、Ellin6513和iii1-15。厚壁菌门中以芽孢杆菌目(Bacillales)和梭菌目(Clostridiales)为主。

注:A、B和C分别代表门水平、纲水平和目水平。Note:Phyla(A),class(B)and order (C).图2 不同作物根际土壤主要细菌类群的组成和相对丰度Fig.2 The composition and relative abundance of major bacterial taxa in rhizosphere soils
2.4 根际细菌群落的多样性和物种丰富度
对Alpha多样性的分析揭示了不同作物之间群落多样性的差异,所有样本的Alpha多样性如表3所示。ANOVA方差分析显示代表细菌群落丰富度的Chao1指数、ACE指数和代表细菌群落多样性的Shannon指数在不同作物根际土中存在差异,7种作物中大豆的Shannon指数、Chao1指数和ACE指数均最高,芋艿最低,大豆的Coverage指数在7种作物中最低,芋艿最高。其中Chao1指数和ACE指数丰富度估计量度量了样本中的菌群丰度,Shannon指数度量了样本中菌群的多样性,Coverage指数反映样本微生物测序结果的真实情况,其数值越高表示样本中序列被测出的概率越高。芋艿根际土中细菌群落的Coverage指数虽然显著高于其他作物,但Chao1指数和ACE指数均为最低,表明其细菌群落丰度最低;花生、豇豆和芋艿根际细菌群落中Shannon指数显著低于其他作物,表明三者的根际细菌多样性较低。大豆根际细菌群落的Shannon指数、Chao1指数和ACE指数在7种作物中最高,表明其根际菌群的丰富度和多样性最高。

表3 样本Alpha多样性指数统计Table 3 Statistics of microbial Alpha diversity index in the soil samples.
2.5 根际微生物群落的差异性和相似性
基于样本间Bray-curtis距离,在OTUs和PLFAs水平下采用非度量多维尺度分析(non-metric multidimensional scaling analysis,NMDS)对不同作物根际细菌群落结构差异进行分析,结果如图3所示,不同作物微生物群落分布在非度量多维尺度上形成显著聚类。在OTUs和PLFAs水平下群落相似性检验分析(analysis of similarities,ANOSIM)均显示不同作物根际细菌群落组成存在显著差异(P<0.001),表明不同物种的样本在分类差异的基础上显著地聚集到不同的类群中。

图3 基于细菌OTUs丰度(A)和PLFAs(B)的非度量多维尺度分析(NMDS)不同作物根际微生物群落分布Fig.3 Non-metric multidimensional scaling analysis(NMDS)of microorganism community composition based on the relative abundance of bacterial OTUs (A)and PLFAs (B)data
将根际土的理化性质、PLFAs组成、微生物的相对丰度和多样性进行Pearson相关性分析,如图4所示。结果表明,土壤pH值与γ-变形菌纲、嗜酸杆菌纲(Acidobacteriia)、索利氏菌纲(Solibacteres)及DA052的相对丰度呈负相关,与氯酸杆菌纲(Chloracidobacteria)和酸性细菌-6纲(Acidobacteria-6)的相对丰度呈正相关。硝态氮含量与α-变形菌纲相对丰度呈负相关,与γ-变形菌纲、嗜酸杆菌纲、索利氏菌纲及DA052相对丰度呈正相关。铵态氮含量也与索利氏菌纲相对丰度呈负相关,同时与ACE指数也呈负相关,与嗜热油菌纲(Thermoleophilia)相对丰度则呈正相关。

图4 土壤理化因子与微生物指标之间的相关性分析Fig.4 Correlationships between microbial index and soil physicochemical variables
2.6 根际土壤敏感微生物差异
通过指示值法筛选不同作物根际土壤的敏感细菌,分析土壤微生物对不同作物根系活动的响应情况。为了提高结果的可靠性,选取指示值大于0.90的种群,共筛选出4个敏感目,8个敏感科,如图5所示。这些指示物种主要属于变形菌门(克斯体科、根瘤菌科、黄单胞菌科和肠杆菌种)、芽单胞菌门(N1423WL目)、酸杆菌门(Ellin 6513)、拟杆菌门(噬纤维菌科)、放线菌门(诺卡氏菌科)、绿弯菌门(嗜热菌科和JG30-KF-AS9目)和疣微菌门(疣微菌科)。利用热图显示指示物种在样本中的分布特征,各样本能够按照作物种类聚类,说明不同作物根际土壤敏感微生物存在明显的差异。其中指示大豆的物种最多,包括4个细菌科和1个细菌目,分别为疣微菌科(Verrucomicrobiales)、嗜纤维菌科(Cytophagaceae)、黄单胞菌科(Xanthomonadaceae)、诺卡氏菌科(Nocardioidaceae)和根瘤菌目;指示玉米的细菌科1个,即肠杆菌科(Enterobacteriaceae);指示花生的细菌目和细菌科各1个,分别为JG30-KF-AS9和嗜热菌科(Thermogemmatisporaceae);指示四季豆的细菌科1个,即克斯体科(Coxiellaceae);指示豇豆的细菌目1个,即Ellin6513;指示番薯的细菌科1个,即根瘤菌科(Rhizobiaceae);指示芋艿的细菌目1个,即N1423WL。
3 讨论
作物通过根际从土壤中吸收水分和养分,同时又将部分代谢产物分泌到土壤中。微生物在根际环境中起着物质传递和转化的重要作用。本研究分析了在夏季生长旺盛或成熟的4种豆科作物(花生、大豆、豇豆和四季豆)、1种禾本科作物(玉米)、1种旋花科作物(番薯)及1种天南星科作物(芋艿)的根际微生物群落结构和组成,发现不同植物物种在同一土壤上生长时,具有特定的微生物群落。变形菌门、放线菌门、酸杆菌门和厚壁菌门是不同作物根际的优势细菌门,这与以往在大豆[26]、花生[27]、玉米[28]和四季豆[29]根际土壤等的研究结果相类似。变形菌门的相对丰度占根际细菌的40%以上(图2-A),这可能与其生长速度较快有关,营养丰富的环境适合变形菌门或该门中某类菌群的生长[30]。变形菌在土壤的碳、硫、氮循环中起着关键作用[31],不同变形菌纲与土壤氮含量或pH值呈现一定的相关性(图4)。α-变形菌纲中的根瘤菌目对植物的生长非常有益,在不同作物根际均有较高丰度(图2-C),同时也是大豆根际土中的指示物种(图5)。根瘤菌目产生的铁载运体剥夺了病原体从环境中获取铁的能力,从而影响了病原体的存在,最终会提高植物的生长和生产力,同时根瘤菌目还是一种能将不溶性无机磷转化成可溶性有机磷的有益菌[32]。除根瘤菌外,放线菌目、伯克氏菌目和芽孢杆菌目是农田土壤中的典型有益微生物种群,含有大量植物促生功能菌、病原拮抗菌等,可提高植物获取营养物质的效率,促进植物生长,同时抑制土传病原微生物侵染[33]。放线菌能提高土壤抑病能力,是大豆、玉米和花生土壤中目水平下的最优势菌(图2-C),这在前人的研究中也有发现[34-36]。伯克氏菌能促进植物生长[37],是本研究7种不同作物的根际土中的优势目(图2-C)。芽孢杆菌目作为厚壁菌门中的优势菌,对外界有害条件的抵抗力强,能产生抗菌物质防止多种作物病害[38]。本研究发现,芽孢杆菌目在不同作物根际的相对丰度存在显著差异(P<0.05),其中在花生根际土中最高,达4.8%。黄文茂等[39]发现用芽孢杆菌对花生幼苗进行灌根处理,可促进花生幼苗茎部的伸长及鲜重的增加,根际土壤碱解氮含量、有效磷和速效钾含量均有不同程度增加。与益生菌相反,黄单胞菌则是常见的植物病原菌,常见于水稻白叶枯病[40]、黄瓜细菌性斑点病[41]等。本研究中黄单胞菌目在不同作物根际土中相对丰度差异显著(P<0.05),番薯根际显著低于其他作物,仅为3.7%,而在豇豆根际则高达10.7%。有研究发现,豇豆对黄单胞杆菌致病菌株的抗性比较差,容易发生细菌性斑点病[42]。本研究中,酸杆菌门在不同作物根际土中的相对丰度均在10%以上,花生根际土中最高,达16%(图2-A),这与土壤的pH值呈酸性有关(表1,图4)。酸杆菌在土壤细菌群落中普遍存在,但丰度在不同土壤中变化较大,pH值对土壤中酸杆菌丰度有较强的调节作用,在广泛的土壤和生态系统类型中,土壤pH值是预测土壤酸杆菌群落组成变化的良好指标[43];此外,土壤微生物组成结构受多种环境因子的共同制约[44],酸杆菌的丰度还与土壤氮含量有关,铵态氮含量对酸杆菌的分布有负向影响[45],在一定范围内土壤中酸杆菌的丰度会随铵态氮含量的增加而降低。在本研究中,芋艿根际有较高的pH值,且铵态氮含量(32.83 mg·kg-1)远高于其他作物,酸杆菌门在芋艿根际土中的相对丰度最低(10.7%)。
本研究中,不同作物对土壤微生物群落的细菌多样性(P<0.001)和丰富度(P<0.001)均有显著影响,花生根际每克土中的PLFAs总量显著高于其他作物,但是花生土壤的Shannon指数较低,说明花生根际土中的微生物数量最多,但多样性较低。基于OUTs和PLFAs结果的非度量多维尺度分析均表明不同作物根际微生物结构存在明显聚类倾向(图3)。可知根际微生物群落的形成是植物和环境因素共同选择的结果[34],表明作物种类对根际微生物群落的组成具有重要影响。

注:SO、MA、PE、KB、CP、SP和CO分别代表大豆、玉米、花生、四季豆、豇豆、番薯和芋艿样本组。Note:Abbreviation in figure as:SO as Soybean,MA as Maize,PE as Peanut,KB as Kidney bean,CP as Cowpea,SP as Sweet potato,CO as Cocoyam.图5 不同作物根际土壤的12种指示物种相对丰度热图Fig.5 Heat map of the relative abundances of the 12 screened indicator taxa for rhizosphere soil samples collected from different crops.
对作物根际土壤敏感微生物的分析进一步显示了不同作物根际微生物之间的差异。本研究中门水平下不同作物根际土的细菌群落多样性和组成无显著差异(图2-A),但进一步分析发现不同作物中均有不同的敏感微生物(图5),且敏感微生物物种在目水平和科水平已达到很高的指示值。这是由于作物对微生物群落存在选择作用,如玉米幼苗通过选择有限的菌属来建立栖息于根的细菌群落[46],而有些微生物对某些植物基因型有特殊的亲和力[47-48],但这些微生物对根际微生物的组成影响较小。此外,本研究发现敏感微生物的分类和作物的分类也无关,如变形菌门中的肠杆菌科、克斯体科、根瘤菌科和根瘤菌目分别为玉米、四季豆、芋艿和大豆的根际敏感微生物。Grayston等[49]研究了同属于禾本科的小麦、黑麦草和匍匐翦股颖在2种不同类型土壤中生长时的根际微生物群落,发现2种不同类型土壤的微生物群落差异不明显,但来自不同植物物种的微生物群落显著聚类。由于不同植物在化合物分泌方面存在差异,释放的根系分泌物不同导致其具有不同的根际微生物组成[50],这种差异也存在于同一科的植物根际。
一般认为,微生物对有机碳和有机氮的利用和转化主要包括真菌和细菌的优势途径[51],真菌生物量(F)、细菌生物量(B)以及F/B值可以作为土壤微生物群落结构的指标。本研究中7种作物的F/B值均低于0.2,表明其根际土中的细菌含量远大于真菌含量。与真菌相比,细菌更喜欢有营养的环境[52]。可见本研究农田土壤营养较为丰富,属于高效性的“细菌型”土壤。本研究中,豇豆根际菌群的F/B值显著高于其他作物,G+/G-值则明显低于其他作物。F/B值的增加在一定程度上表明土壤碳吸收能力和生态系统稳定性的改善[53],G+/G-值高表明土壤中细菌群落碳的有效性低,革兰氏阳性菌倾向于利用土壤有机质作为碳源,而革兰氏阴性菌倾向于将植物凋落物作为碳源[54]。因此,相比于豇豆,其他作物凋落物分解更快,碳的有效性逐渐降低,由于养分的限制,土壤有机质作为碳源的比例增加,革兰氏阳性菌的比例也随之升高。芋艿根际土中菌群的F/B值显著低于其他作物(除与大豆无显著差异),但其总PLFAs含量与豇豆无显著差异。这可能与芋艿根际土中铵态氮含量显著高于其他作物有关,土壤中有丰富的无机氮源,使细菌生物量相对增加[55]。此外,根际微生物的分布与植物生长时期相关[56],有研究表明,植物会在不同生长阶段通过调整其根系分泌物渗出模式,帮助适应特定微生物生长,从而改变微生物群落组成[57];在甜椒根际土壤中,假单胞菌、芽孢杆菌和伯克霍尔德菌在开花期和结果期比幼年期增加了数倍[58]。大豆生长发育过程中根际土壤变形菌门增加,但酸杆菌门和厚壁菌门呈减少趋势[59]。因此,本研究中不同作物根际微生物存在差异还与作物所处的生育期有关。
4 结论
本研究发现,同一农田种植不同作物会形成显著不同的根际微生物区系,表现在微生物含量、真菌细菌比(F/B)、革兰氏阳性菌与革兰氏阴性菌比(G+/G-)、以及细菌的群落结构和多样性等多个方面。花生根际土中表征放线菌、革兰氏阳性菌、革兰氏阴性菌和真菌的PLFAs含量均显著高于其他作物。芋艿根际土中的G+/G-值在7种作物中最高,且显著高于玉米、番薯和豇豆。不同作物根际微生物组成在纲水平和目水平存在差异,在门水平差异不显著,均以变形菌门、放线菌门、酸杆菌门和厚壁菌门为主。Alpha多样性和非度量多维尺度分析(NMDS)分析说明不同作物之间群落多样性及组成存在差异,7种作物中大豆根际菌群的丰富度和多样性最高。每种作物在科或者目水平均有特有的敏感指示微生物,进一步表明根际微生物群落与作物种类存在密切关系,为根际微生物生态功能的研究提供了理论基础。但关于根际微生物群落和活性随作物生长的变化规律以及其在各生长期的主要生态功能等仍需要进一步研究。
