基于高通量测序分析番茄自然发酵过程中的真菌多样性
2022-01-04秦宇蒙周笑犁管庆林刘云寒吴承木
秦宇蒙,周笑犁 ,管庆林,刘云寒,吴承木
(1. 贵阳学院食品与制药工程学院,贵州 贵阳 550005;2. 贵州省普通高等学校功能食品重点实验室,贵州 贵阳 550005)
0 引言
【研究意义】番茄(Lycopersicon esculentumM iller)为管状花目(Tubiflorae)、茄科(Solanaceae)、番茄属(Lycopersicon)的一种一年生或多年生草本植物,色泽鲜艳,生熟皆宜食用。它含有丰富的番茄红素、维生素E、维生素C、类胡萝卜素、类黄酮和酚类等多种活性物质[1],对人体健康起着非常重要的作用。尤其是其富含的番茄红素具有抗氧化、降血脂、抗癌、提高机体免疫力等功效[2]。而近些年我国逐渐出现了番茄的滞销现象,这不仅给果农的收益带来影响,还造成营养物质的大量浪费,从而困扰了番茄产业的发展,因此加强番茄深加工力度和开辟新的利用途径对其产业的发展具有一定的现实意义。酵素是以植物、动物、菌类等为原料,由微生物发酵后制得的含有特定生物活性成分的产品[3],其不仅含有乳酸菌、酵母菌等多种微生物,还有着丰富的生物活性物质,具有抗菌、抗氧化、提高免疫力、保护心血管以及抑制肥胖等作用[4]。目前,大多数酵素产品多以自然发酵为主,但是这种发酵方式易受环境气候等条件影响,且质量较难控制。因此,解析酵素自然发酵过程中的微生物群落变化规律,可以为筛选发酵优势菌株奠定理论基础。【前人研究进展】目前,人们对于酵素的研究大多集中在功效酶活性、代谢产物、抗氧化活性等方面[5−7]以及发酵过程中酵母菌、乳酸杆菌的分离鉴定[3,4,8]。但是基于传统培养方法分离得到的微生物十分有限,而且耗时耗力,因此为了更加高效、准确地解析发酵过程中微生物的组成及其多样性变化规律,越来越多的免培养技术被广泛应用。高通量测序技术因其具有快捷、准确、高效的特点,近年来逐渐成为国内外研究菌群多样性特征的新手段。丁建才等[9]使用高通量测序分析了河北昌黎产区干红葡萄酒发酵过程中真菌群落, 共鉴定出128个属,分布在汉逊酵母属、酿酒酵母属、未被鉴定的属、短梗霉属、被孢霉属等。康晓乐等[10]采用宏基因组技术分析得出,苹果自然发酵过程中优势细菌属为乳杆菌属和葡萄糖酸杆菌属,优势真菌属为接合酵母属和汉逊酵母属。张琪等[11]利用高通量测序分析沙棘酵素自然发酵过程中的细菌多样性,发现蓝藻细菌门为发酵过程中的绝对优势菌门。【本研究切入点】笔者前期研究发现,天然发酵的成熟红番茄具有良好的抗氧化活性,随着发酵时间的延长,总酚等生物活性物质在发酵过程中也有所增加[12],并从发酵液中分离得到了3株毕赤酵母菌[13],而对自然发酵过程中真菌群落多样性方面的研究还有待进一步探索。【拟解决的关键问题】通过高通量测序技术,进一步分析番茄自然发酵不同时期中真菌的多样性及其群落动态变化规律,同时对其发酵过程中理化指标进行测定,为后续深入研究番茄酵素中菌落结构及其在自然发酵中的作用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜小番茄、白砂糖购自沃尔玛超市;E.Z.N.A.®soil试 剂 盒,美 国Omega Bio-tek公 司;AxyPrep DNA凝胶回收试剂盒,美国Axygen公司;Tris-HCl缓冲液,上海阿拉丁生化科技股份有限公司;硫酸(分析纯),太仓沪试剂有限公司;无水乙醇(分析纯),天津市富宇精细化工有限公司;苏丹I色素(分析纯),天津市科密欧化学试剂有限公司;甲苯(分析纯),重庆川东化工有限公司;重铬酸钾(分析纯),金山化学试剂有限公司。
1.2 仪器与设备
T100PCR扩增仪,美国BIO-RAD公司;YXQLS-50SII立式高压灭菌锅,上海博讯实业有限公司医疗设备厂;SW-CJ-1G单人超净工作台,上海力辰邦西仪器科技有限公司;高速冷冻离心机,德国艾本德;AUW 120D电子分析天平,日本岛津公司;PHS-3C pH计,仪电科学仪器(上海)有限公司;移液枪,兴创实验仪器(北京)有限公司;BSM 120.4分析天平,卓精电子科技(上海)有限公司;JYL-Y5九阳高速破壁调理机,九阳股份有限公司;PAL-BX手持型糖酸一体机,日本Atago公司;UV-2550紫外可见光分光光度计,济南海能仪器股份有限公司。
1.3 试验方法
1.3.1 样品的制备 选取大小相近,无病虫害,外表光泽无破损,颜色鲜红的新鲜小番茄,去蒂、自来水清洗2次、无菌水清洗3次、无菌风干并切分。将番茄与白砂糖以质量比3∶1的比例放入灭菌发酵瓶中室温避光发酵90 d,发酵前期每天上下翻转摇晃玻璃瓶使白砂糖均匀融化,定期排气防止胀罐,设置两个批次进行发酵。
1.3.2 样品采集 于第0、10、20、30、60、90 d从两批次的番茄发酵瓶中3个位点(底部、中部和上层)取样50 m L放入灭菌的离心管中,依次编号为G1、G2、G3、G4、G5和G6,置于−80 ℃超低温冰箱保存,用于后续分析。
1.3.3 理化指标分析检测
(1) pH:用pH计测定不同时期的番茄发酵液,待数据稳定后记录数据。
(2) 可溶性固形物:使用手持糖量计测定不同时期的番茄发酵液,读数并记录。
(3) 酒精度:参考李岭卓等[14]的方法稍加改变,取5 m L样品液依次加入10 m L重铬酸钾、5 m L H2SO4混匀并用锡纸封口,使其充分反应10 m in,在波长610 nm下测吸光度。以乙醇标准曲线方程y=1.034 3x+0.008,R2=0.999 7得出酒精度。
(4) 番茄红素:采用分光光度法[15]检测不同时期发酵液中番茄红素的含量,取5 g去除黄色素的番茄发酵渣,向渣中加入少许甲苯,搅拌、过滤,重复多次至滤液无色为止,用25 m L棕色容量瓶收集滤液并用甲苯定容,于485 nm下测吸光度值。番茄红素含量以苏丹I色素为标准物,按标准曲线方程y=1.0657x+0.0028,R2=0.9981得出番茄红素含量。
1.3.4 DNA提 取、PCR扩 增 和 高 通 量 测 序 利用DNA提取试剂盒提取番茄发酵液中微生物基因组DNA,提取步骤根据说明书进行;以基因组DNA为模板,根据真菌ITS区通用引物进行PCR扩增;利用Illum ina M iSeq对扩增成功的产物进行高通量测序和分析。
1.3.5 数据分析 高通量测序数据通过上海生物工程股份有限公司多样性测序及分析平台完成。通过barcode区分样品序列,并对各样本序列进行质控和过滤;将多条序列根据其序列之间的距离来进行聚类,再通过相似性在97%以上的序列进行OTU聚类和物种分类分析。通过绘制Shannon-W iener曲线、多样性指数、分类学信息等进行番茄自然发酵液中真菌群落结构分析统计。
理化指标均重复测定3次,数据用平均数值±标准差值表示,采用单因素方差分析(ANOVA)和SPSS 25.0软件进行单次实验统计检验数据性状分析,采用Duncan's多重极差法进行统计检验,确定各试验数据性状的显著性(P<0.05)。
2 结果与分析
2.1 番茄自然发酵过程中理化指标分析
番茄自然发酵过程中理化指标变化见图1。由图1可知,随着发酵的进行,pH值和可溶性固形物均呈现逐渐下降的趋势(P<0.05),说明随着发酵的进行,发酵体系中的碳源逐步被微生物菌群利用产生有机酸等代谢产物,从而使得体系的酸度增大,以致pH逐渐减小,形成良好的相互佐证。而酒精度与番茄红素呈现的变化趋势相近,在发酵初期显著下降(P<0.05),这可能是由于一般果蔬原料中均带有大量微生物,包括有害菌等作为初始时的优势菌群利用了这些物质,且初期产酒精的菌群还未生长等。随后酒精度和番茄红素迅速增加后又下降,这可能是由于随着发酵时间的延长,发酵中期乳杆菌占主导地位,利用蔗糖、葡萄糖、果糖等可发酵糖进行异型发酵,酵母菌也逐步成为优势真菌,可将番茄中的糖类转化成乙醇和二氧化碳,以及一些次级代谢产物,如短链的醇、脂肪酸和酯类等,使得微生物处于缺氧的环境,同时微生物代谢产生的有机酸使pH逐渐下降,酒精度逐渐上升,在这种不适宜微生物生长的条件下,会抑制绝大部分微生物尤其是初期有害菌的生长繁殖,这也与后续真菌多样性的测序结果一致。并且,酵母菌代谢产生的醇类与乳酸菌代谢产生的有机酸可反应生成酯类,这可能与发酵果蔬的风味相关。
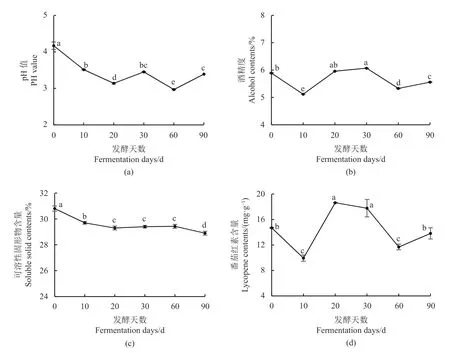
图1 发酵过程中理化指标的变化情况Fig. 1 Changes in physiochem ical properties of broth during ferm entation
2.2 番茄自然发酵过程中真菌丰富性和多样性分析
2.2.1 A lpha多样性分析 稀释曲线趋于平坦时,说明测序数据量合理,更多的数据量只会产生少量的OTU,反之则表明继续测序还可能产生较多新的OTU[16]。从6组番茄发酵液样品中共获得705 309条有效序列,再依据97%相似性水平下的OTU信息进行聚类分析,共获得4 499个OTU。从图2-a、b可以看出,随着测序量的增大,香农曲线趋于平缓,说明尽管增加测序量样品微生物的多样性已经不再随之发生变化;各个样品的稀释曲线接近平台期达到饱和,说明主要真菌基本能覆盖,各组样品中的物种多样性丰富程度高。
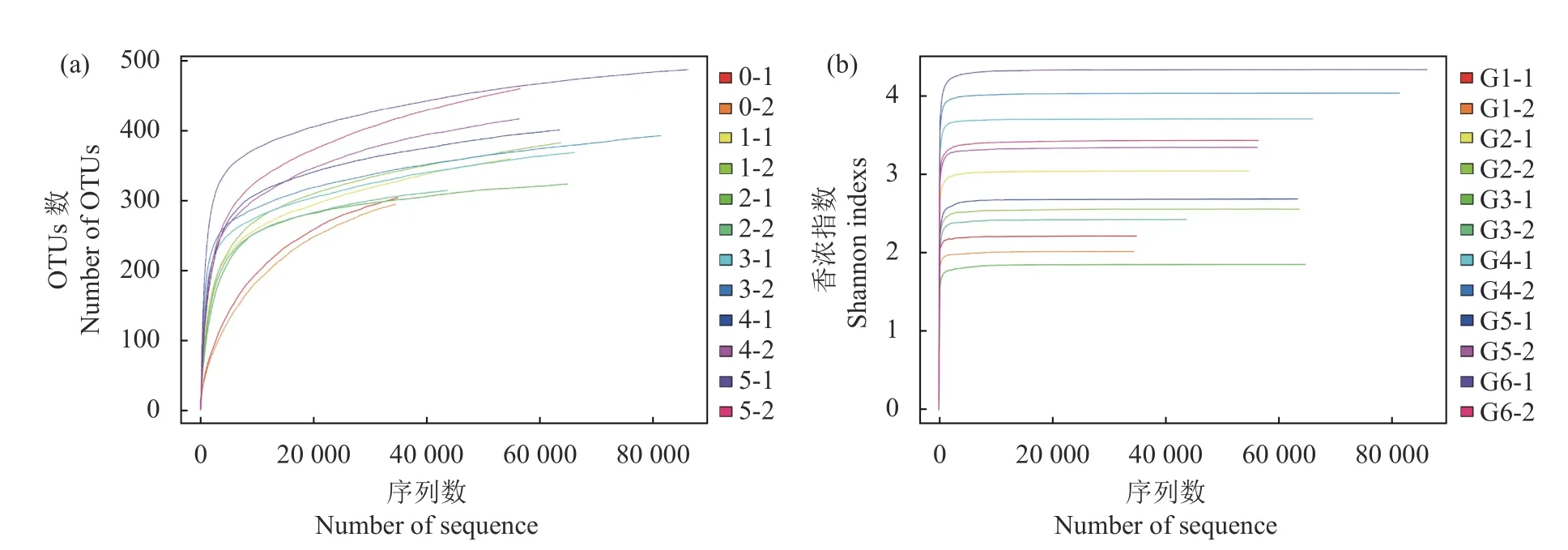
图2 真菌群落OTU稀疏曲线(a)和Shannon指数稀疏曲线(b)Fig. 2 Rarefaction curves on OTU (a) and Shannon index (b) of fungal community
基于在97%相似度水平的OTU数,各样品A lpha多样性指数值如表1所示。Coverage指数表明各样品文库的覆盖率,其数值越高,则样本中序列没有被测出的概率越低,反映了测序结果是否代表样本的真实情况[17]。由表1可知,番茄不同发酵时期每组的Coverage值均在0.998以上,表明测序深度良好,覆盖率高,可以真实展示样品中真菌的多样性。Chao1和Ace指数在生态学中常用来估计物种总数,其数值越大则表明菌群丰富度越高[18]。如表1所示,发酵初始时(0 d)样品具有较低的真菌丰富度和多样性;随着发酵周期的延长,真菌的丰富度呈先上升后下降再上升的趋势,说明丰富的真菌不仅来自番茄样品本身,还与发酵环境有着很大的联系,良好的发酵环境有利于微生物的生长;G3时期的丰富度显著下降可能是由于此时酒精度迅速升高。如,在大头菜发酵过程中,随着食盐量的逐渐增加,导致不耐盐真菌逐渐消失,真菌群落的丰富度和多样性下降[19]。Simpson指数和Shannon指数常用来估算样品中微生物的多样性。Shannon指数值越大,说明群落多样性越高,而Simpson指数值越大,说明群落多样性越低[20]。由表1可知,番茄自然发酵过程中真菌多样性呈动态变化,且各组样品的Shannon指数与Simpson指数变化趋势呈反比关系,所反映的发酵过程中真菌群落多样性变化与Chao1及Ace指数呈现的变化规律基本一致。G4组的Shannon指数最大且Simpson指数最低,说明该组的菌群多样性最高,而G3时期却最低;说明在番茄的天然发酵过程中,真菌群落结构发生了较大的波动。本课题组在此之前对番茄自然发酵过程中细菌多样性的分析发现,其物种数呈现逐渐下降的趋势,可能是由于优势发酵菌群的形成、营养物质的消耗、代谢产物的积累,从而抑制其他菌群的生长[21]。
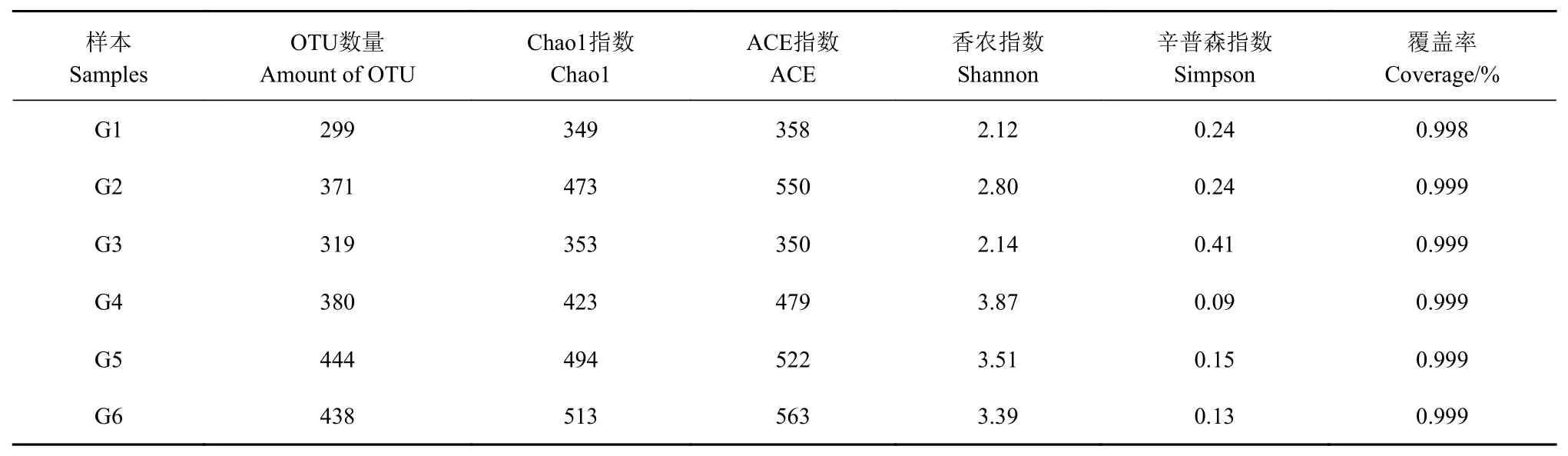
表1 样本信息和多样性指数Table 1 In form ation and diversity index on sam p les
2.2.2 Beta多样性分析 Beta多样性用于比较不同样本微生物群落构成的差异。样本聚类树图可以通过树枝结构直观反映多个样品间的相似性和差异关系。如图3所示,各组番茄发酵液样品分为两大支,分别代表发酵前和发酵后,发酵初始聚集在下方,开始发酵后的样品分为三大组聚集在上方,其中又可分为三大类,其中G2和G3、G4和G5,以及G6样品组分别聚为一类。由此可以将自然发酵过程大致分为发酵初期、发酵中期和发酵后期3个时期。说明在发酵的相同阶段,真菌群落组成结构相似;发酵时期不同,真菌的菌群结构存在一定差异。
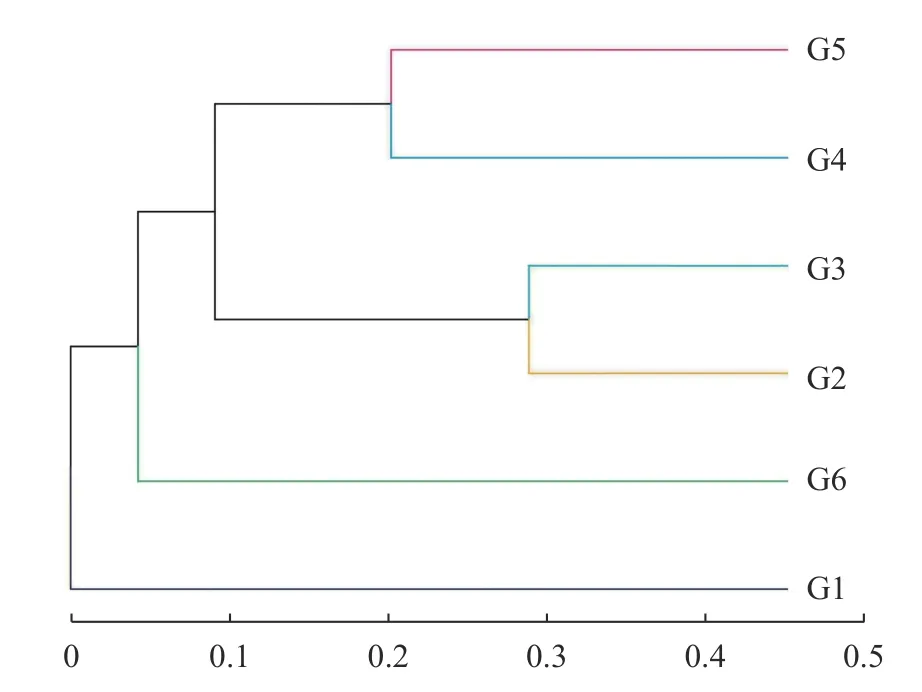
图3 OTU水平上样本真菌群落聚类分析Fig. 3 Cluster analysis on fungal comm unities of sam p les atOTU level
2.3 番茄自然发酵过程中真菌群落组成分析
2.3.1 Venn 图 分 析 Venn图 直观展 现 出 样 品OTU数目的组成相似性及重叠情况,前述6组样品共产生了4 499条OTU,从图4中可以看出各组样品共同拥有的OTU数量为87,约占各组样品OTU数量的19.6%~29.1%,说明各组样品间均有一定数量的相似真菌。各个组间未重叠的OTU数分别为104、150、138、192、272和283,说明各组样品含有不同于其他组样品特有的OTU。随着发酵周期的延长,各组独有OTU数量的增加说明自然发酵的环境有利于真菌的增殖,而相似种类较少,这说明番茄自然发酵的不同时期既有相同又存在一定的差异。
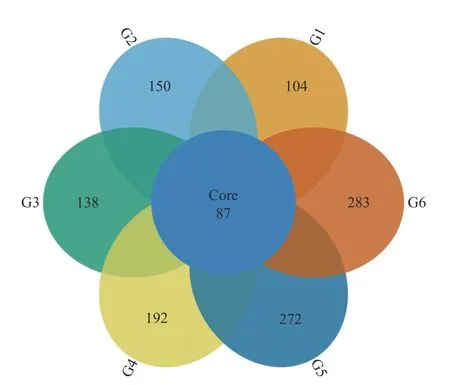
图4 OTU韦恩图Fig. 4 Venn diagram of OTUs
2.3.2 真菌在门类水平上的分类和比较 番茄自然发酵过程中各组样品的微生物群落在门分类水平上具有较高的多样性,由图5可知,分析番茄发酵液各时期样品在门水平上的真菌群落组成,去除未分类的真菌后,样品中真菌群落包含11个门,主要有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、隐真菌门(Rozellomycota)、壶 菌 门(Chytridiomycota)等。其中,子囊菌门始终在整个发酵过程中占绝对的主导地位,其次为担子菌门,它们在不同发酵时期的相对丰度差异较大,占比分别为22.43%~75.27%和0.48%~7.10%;子囊菌门在G1-G3时期呈下降趋势,而此时担子菌门逐渐上升,直至G4时期开始,子囊菌门逐渐上升,在发酵后期占绝对优势,担子菌门的相对丰度迅速减少,到后期时更低,二者呈现交替消长的现象。研究表明,子囊菌门和担子菌门中的微生物均为土壤中的优势菌种,能够分解大多数有机物质和植物残骸[22],这与本研究结果一致;它们中有着多种发酵菌种属,如酵母菌属、毕赤酵母菌属、汉逊酵母属等,这与属水平相对含量图分析相似。说明果蔬原料中带着大量微生物,包括乳酸菌、酵母菌等,且通过这些真菌和细菌共同参与发酵。这同黑果枸杞发酵液[23]、四川泡菜母水[24]及酸汤[25]等发酵制品中在门水平上发现的优势菌群相似,说明不同时期的番茄发酵液样品在门分类水平上群落结构多样性相近,且分布广泛,对发酵食品起着极大的作用[26],代谢产物还能够起到抗菌、抗肿瘤的作用[27]。而泡菜母水[24]中却还含有接合菌门(Zygomycota)、黑果枸杞酵素[23]中还有被孢霉菌门(Mortierellomycota)等优势菌,这说明不同发酵制品中有相同的真菌,也有其特有的菌,不同菌在发酵中的作用还有待深入研究。
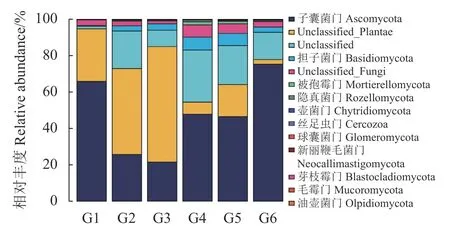
图5 门水平上真菌群落组成分析Fig. 5 Com position of fungal community at phylum level
2.3.3 真菌属类水平比较 由图6可知,番茄自然发酵过程中不同时期真菌群落在属分类水平上共检测出31种已知的真菌属。真菌的菌群结构简单可能由多方面因素造成,如酵母菌发酵产生的酒精会对自身和其他真菌有毒害作用,优势乳酸菌、酵母菌属等微生物代谢产生的有机酸也会使真菌的生长环境发生改变,使其不宜生长繁殖。在G1时期样品中主要优势真菌为青霉属(Penicillium),相对丰度为37.51%,其次为双足囊菌属(Dipodascus)、镰刀菌属(Fusarium)、轮枝菌属(Verticillium);随后,青霉属的相对丰度迅速减少,在G2-G5时期,真菌的种类较复杂,轮枝菌属占据了优势,相对丰度为6.67%~22.92%,其次为威克汉姆酵母属(Wickerhamomyces)、念珠菌属(Candida)、镰刀菌属和曲霉菌属(Aspergillus);在G6时期,样品中汉逊酵母属(Hanseniaspora)丰度大大提高,其占比为33.55%,成为该时期的优势菌属,其次为接合酵母属(Zygosaccharomyces)。表明在番茄发酵过程中,其表面附着的微生物参与发酵,随着发酵时间延长,微生态环境变化使得部分真菌的繁殖受到抑制,降低了物种的多样性,如发酵初期的诸多优势菌属不能在高酸度,高乙醇浓度及厌氧环境下生存而逐渐消亡。而后期酵母属等会消耗体系中的营养物质,产酯、产醇、产有机酸等风味物质,主要起生香作用,并且汉逊酵母属还会利用部分酒精,这也同前述酒精度在G4期后显著下降这一结果一致。结合在前期对番茄自然发酵过程中细菌多样性的分析,由此推断番茄自然发酵过程存在酵母菌和乳酸菌两类发酵,它们分别利用发酵环境中的糖产生酒精和有机酸,以及其他风味物质等,并抑制不耐酸菌或杂菌生长。果蔬自然发酵过程中微生物的种类十分丰富,苹果自然发酵过程中的优势菌属有接合酵母属和汉逊酵母属[10];桑葚酵素发酵过程中的优势真菌为未分类酵母属(Saccharomycetales)、汉逊酵母属[28];这均与本试验番茄自然发酵末期的优势真菌属相似。而高庆超[23]发现黑果枸杞酵素的优势真菌属有链格孢属(Alternaria)、球腔菌属(Mycosphaerella)、黑粉菌属(Filobasidium)、酵母属(Saccharomy)和锁瑚菌属(Membranomyces);红树莓发酵液中前期优势菌种属为酿酒酵母属(Saccharomyces),中后期优势菌种属为汉逊酵母属、Kazachstania[29]。这说明发酵不同时期以及不同果蔬发酵过程中的优势真菌存在差异,体现出微生物群落对不同果实营养成分具有一定的偏好,由于不同果实生长环境和气候不同,导致其原生的真菌群落不尽相同。
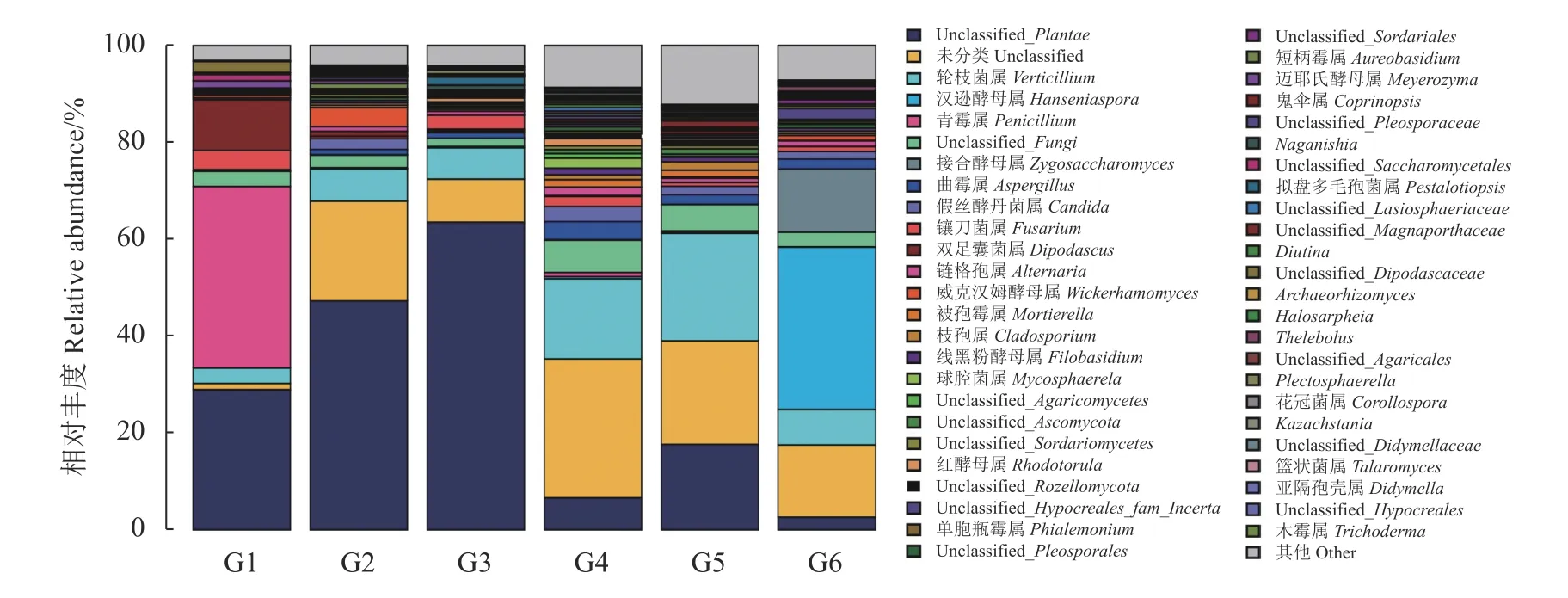
图6 属水平上真菌群落组成分析Fig. 6 Com position of fungal community at genus level
2.3.4 物种丰度热图 Heatmap可以用颜色变化来反映群落分布的丰度信息,可以直观地将群落分布丰度值用定义的颜色深浅表示。图中每一列代表一组样本,行代表群落结构,颜色块代表相对物种丰度值,颜色越红表示相对丰度越高,颜色越蓝反之[30]。由图7可见,番茄自然发酵液在不同分类水平上均表现出一定的多样性,不同时期的发酵液中优势菌群和相对丰度也各不相同;其中G1与其他组样品差距较大,G2和G3相似,G4-G6基本接近,说明随着发酵番茄的成熟,各组样品之间的微生物差异性减少,物种丰度越来越相似。由于番茄原料原始附着的微生物在发酵初期占据主导地位参与自然发酵,但其中青霉属等在发酵过程中容易引起腐败变质,不利于发酵产品的品质;随着发酵的持续发生,底物中的糖类等营养物质逐步被微生物利用,发酵产生乙醇、二氧化碳及一些次级代谢产物,轮枝菌属在发酵中期显示较高的丰度;汉逊酵母属和接合酵母属在发酵末期占主导地位,它在发酵过程中能够利用糖类进行生长代谢,产生或者催化产生酒石酸、氨基酸等[29],以及代谢产生的醇类与乳酸菌代谢产生的有机酸可反应生成酯类,这与风味物质的形成可能存在一定的关联。但各菌株之间的相互作用机理及其在不同时期发挥的作用还有待进一步探究。

图7 属水平上真菌群落组成热图Fig. 7 Heatm ap of fungal comm unities at genus level
3 讨论与结论
本研究采用高通量测序技术对番茄自然发酵过程中真菌多样性和群落结构进行分析,从不同发酵时期的样品中共获得705 309条有效序列,再依据97%相似性水平下的OTU信息进行聚类分析,共获得4 499个OTU。经样本聚类分析可以将整个发酵过程大致分为发酵初始(0 d)、发酵初期(10~20 d)、发酵中期(30~60 d)和发酵后期(90 d)。随着发酵时间的延长,真菌群落结构发生了较大的变化,去除未分类的真菌后,各组样品中真菌群落包含11个门,其优势真菌门类为子囊菌门(Ascomycota)和担子菌门(Basidiomycota);属分类水平上,共检测出31个属,青霉属(Penicillium)为发酵初期的优势真菌属,随后演替为轮枝菌属(Verticillium),最后汉逊酵母属(Hanseniaspora)和接合酵母属(Zygosaccharomyces)占据了优势。随着发酵时间的延长,酵母菌属逐步成为优势真菌,可将番茄中的糖类转化成乙醇以及一些次级代谢产物,使得微生物处于缺氧的环境,同时发酵体系的可溶性固形物逐渐减少,微生物代谢产生的有机酸使pH逐渐下降,酒精度和番茄红素含量逐渐上升,在这种不适宜微生物生长的条件下,抑制了绝大部分微生物尤其是初期有害菌的生长繁殖。本研究尝试系统地揭示自然发酵番茄的真菌多样性和群落组成,为番茄酵素发酵过程中菌群的调控提供方向,也为评价果蔬发酵制品对机体健康的影响奠定基础,以期开发出高附加值的番茄产品及其发酵制品。
