番茄细菌性髓部坏死病病原细菌的鉴定
2022-01-04陈梅春肖荣凤陈燕萍郑雪芳朱育菁王阶平
陈梅春,肖荣凤,陈燕萍,郑雪芳,朱育菁,王阶平,刘 波
(福建省农业科学院农业生物资源研究所,福建 福州350003)
0 引言
【研究意义】番茄是世界主要经济作物之一,但其极易受到病害威胁,而且番茄病害种类多、为害严重,极大地制约了番茄产业的发展。开展番茄病害病原分离鉴定研究,可为番茄病害发生规律探究和病害防治提供参考。【前人研究进展】目前已发现的番茄病害包括真菌病害、细菌病害、病毒病、线虫病害和生理病害等,其中细菌性病害主要危害植株的叶片和茎[1−3]。细菌病害发生后,一般减产10%~30%,严重时甚至造成绝收。番茄细菌性病害主要包括青枯病[4]、溃疡病[5]、髓部坏死病[6]、疮痂病[7]、叶斑病[8],这些病害的病原菌都可以通过伤口入侵和雨水传播,尤其在田间或棚内湿度大时极易扩展蔓延。其中,引起番茄髓部坏死病的病原菌包括假单胞菌属和果胶杆菌属的8种病菌,如菊苣假单胞菌(Pseudomonas cichorii)[9]、皱纹假单胞菌(P. corrugata)[10]、荧光假单胞菌(P. fluorescens)[11]、果胶杆菌(Pectobacterium atrosepticum)[12]等。番茄细菌性髓部坏死呈现症状包括植物茎表面出现黄色、棕色或黑色的病斑,茎髓部出现水浸状、褪色、空心或软腐,维管束组织呈黄化或褐变[13]。目前已报道的番茄髓部坏死病主要发生在我国山东、浙江、湖北、内蒙古、广东、江苏及河北等地[6]。2017–2019年,福建泉州、浙江瑞安等地大棚番茄出现一种病害,该病发生于花期和果期,大棚内湿度高,打杈抹枝后容易发病,且发病速度很快,从发病到整株死亡大概20 d,发病率达15%~30%,给种植户带来严重的经济损失。【本研究切入点】发病的番茄植株茎部表面病斑为褐色长条形水渍状;横剖发现病茎维管束褐变,茎杆髓部坏死;因维管束受阻,叶片失水后萎蔫,但仍保持绿色;地上部症状与青枯病类似,但地下根部无症状。上述症状显示该病可能为番茄上的一种新病害,病原种类未知,亟待探明。【拟解决的关键问题】通过病原菌分离、致病性测定、形态学、16S rDNA测序、生理生化及质谱等方法以期对上述病害病原类型进行鉴定,为该病害的防治奠定基础。
1 材料与方法
1.1 病样采集
番茄发病植株于2017–2019年采集于福建泉州、浙江瑞安等地番茄大棚的发病田块。
1.2 病原菌的分离与培养
番茄发病植株茎部用自来水清洗后,用75%的酒精表面消毒,剥去外层表皮,切取茎杆病健交界处的病组织,大小约3mm3,不同样品各切取10片,置于75%酒精中浸泡2~5 s,再放入1%次氯酸钠溶液中消毒5 m in,取出用无菌蒸馏水冲洗3次,置于3m L无菌蒸馏水浸泡1 h以上。取0.1μL浸泡液涂布于NA固体培养基(3 g·L−1牛肉膏、5 g·L−1蛋白胨、17 g·L−1琼脂)上,30℃培养48 h后,挑选单菌落,连续纯化2次后,用20%甘油于−80℃冻存备用。
1.3 病原菌的致病力测定
采用1月龄(20~30 cm高)番茄盆栽苗检测病原菌致病力。接种病原菌于LB液体培养基(牛肉膏5 g·L−1、蛋白胨5 g·L−1)中,30℃摇瓶培养48 h后,用无菌水稀释为1×107CFU·m L−1的菌体悬浮液。处理组1:将番茄的第4个分叉枝切除,于伤口处注射接种10 m L的病原菌悬浮液,用无菌水润湿的纱布覆盖伤口保湿,并用封口膜包裹,2 d后拆除。每个处理均以接种LB液体培养基为对照,每个处理组共30株苗。处理组2:将番茄植株根部浸泡于病原菌悬浮液中1 h后,取出种于栽培基质中;将盆栽苗置于光照培养箱中(温度:25~30℃;湿度:70%~80%;光照:16 h·d−1),每天观察植株发病情况。番茄植株发病后,取病变植株重新分离病原菌,并与接种菌株进行比较。
1.4 病原菌的鉴定
1.4.1 形态学鉴定利用普通光学显微镜和透射电镜观察菌落/体形态,并测量菌体大小。1.4.2 Biolog分析采用Gen IIIM icrostation微生物鉴定进行Biolog分析,病原菌接种于Biolog专用BUG+B培养基培养48 h后,稀释菌悬液至OD600值为0.2~0.3,于BiologGN微孔板上加入150μL菌悬液,置于30℃培养48 h后,观察菌液利用96种碳源的颜色反应。根据Biolog M icrologi数据库比对确定病原菌种属。1.4.3 16S rDNA基因序列测定利用W izard基因组DNA纯化试剂盒(Promega,Madison,W I)提取病原菌DNA。16SrDNA基因引物为FD1(AGAGTTT GATCCTGGCTCAG)和RD1(AAGGAGGTGATCCA GCC)。利用引物进行PCR扩增,反应体系为50 μL(10×PCR buffer 5μL、dNTP 1μL、FD1 2μL、FD2 2 μL、Tag酶 1 μL、模板DNA 2 μL、dd H2O 37 μL),扩增条件为:94℃5 m in;94℃30 s,55℃1m in,72℃90 s,29个循环;72℃1min;10℃20m in。
将菌株的16S rDNA基因测序结果于NCBI网站上用BLAST软件进行同源性比对,初步判断病原菌的种属归类,利用MEGA 6.0的邻接法(Neighborjoining,NJ)分别构建系统发育树,并将菌株FJAT-46819和FJAT-47134的16S rDNA基 因 序 列 上 传至NCBI,NCBI号分别为MW 512876和MW 512877。1.4.4 MALDI-TOF-MS测定病原菌于LB培养基上生长48 h后,挑选单个菌落并将其重悬于无菌水中,加入乙醇后,通过乙腈/甲酸法提取蛋白质。利用Bruker Daltonik UltrafleXtreme MALDITOF系统 采集蛋白质质谱数据。取1μL蛋白质提取物点到钢靶板上,放干后点上1μL的α-氰基-4-羟基肉桂酸基质溶液。利用FlexControl软件(版本3.4)以自动模式以随机采样模式采集光谱数据:采集模式,线性正离子;质量范围,2~20 kDa;氮激光波长,335 nm;激光频率,2000 Hz;加速电压,25 kV。应用BioTyper分析软件对所获取的质谱图进行分析,通过匹配值的大小对细菌种类鉴定结果进行判定。
2 结果与分析
2.1 番茄细菌性病害的田间症状
植株发病初期萎蔫,似青枯病症状,后期叶片枯死(图1-a),茎部表面初期黄褐色,后期颜色加深,从发病部位向四周扩散,茎部剖面可见维管束褐变,髓部组织腐烂、空心(图1-b、c)。根据发病症状初步诊断为番茄细菌性病害。

图1 田间番茄细菌病害症状Fig.1 Sym p tom s of tomato bacterial pith necrosisdiseases in the field
2.2 病原菌分离与培养特性
从不同病组织上分离纯化出菌落形态一致的菌落,选择2株代表性菌株FJAT-46819和FJAT-47134进行后续研究。菌落呈椭圆形、平滑均匀,乳白色(图2)。革兰氏染色观察表明2株菌株均呈革兰氏阴性,菌体在透射电镜中呈椭圆形至短杆状,大小为1.42(1.02~1.58)μm×0.81(0.74~0.88)μm,无芽孢。
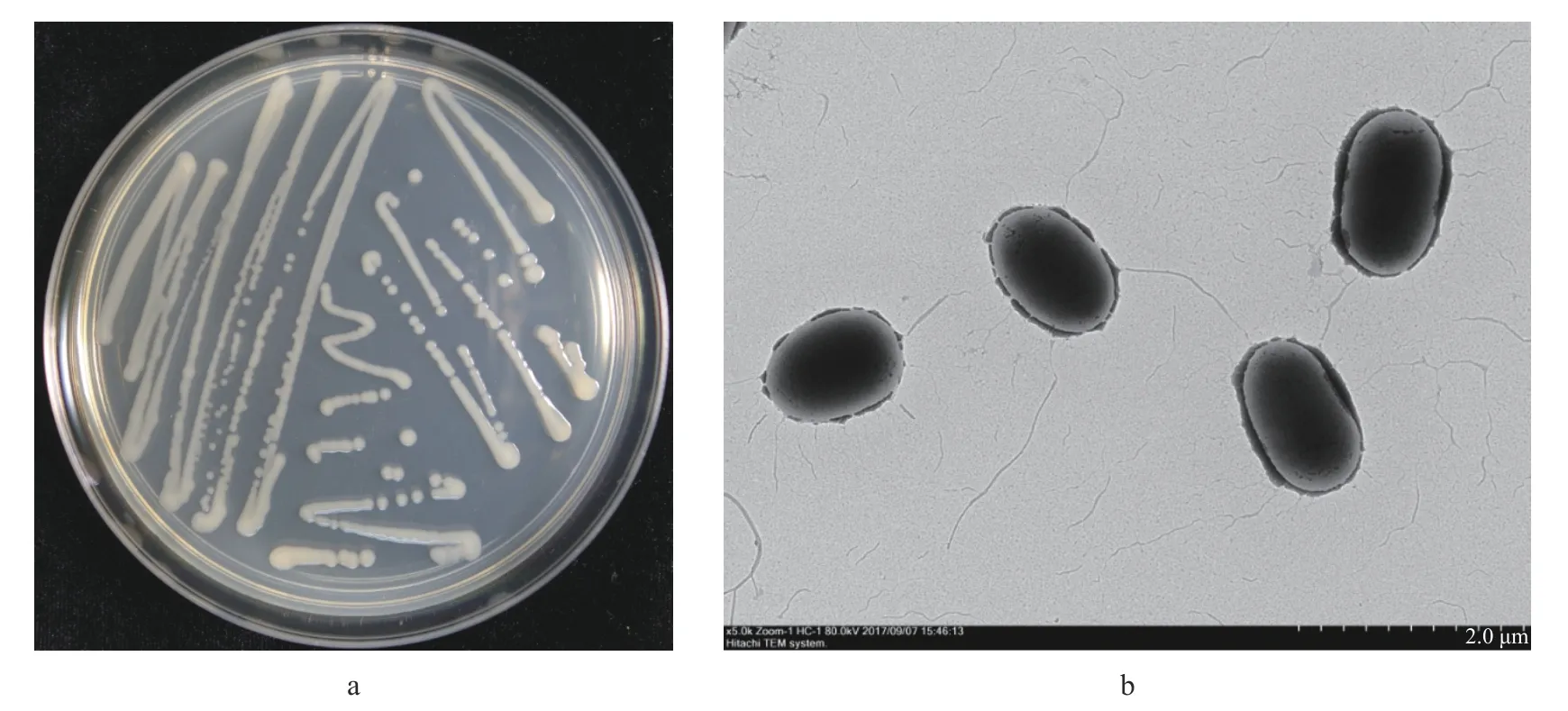
图2 病菌形态Fig.2 M orphological characteristics of bacterial isolates
2.3 病原菌致病力测定
将代表性菌株FJAT-46819和FJAT-47134回接到健康番茄盆栽苗上,结果表明:空白对照组番茄植株无发病症状;处理组1(采用分叉枝切除伤口接种)番茄植株,接种7 d后接种口周围组织褐变(图3-a),接种17~20 d时整株萎蔫枯死,与田间番茄髓部坏死病病症一致(图3-b)。处理组2(采用浸根接种病原菌)番茄植株无发病症状;从发病植株重新分离病原菌,其形态特征和培养性状与接种菌株一致。根据柯赫氏法则,初步判断接种上述2株病原菌对番茄具有较强的致病性,侵染番茄植株后都能引发番茄髓部坏死病。

图3 室内病菌回接番茄植株的髓坏死病症状Fig.3 Sym ptom sof bacterial pith necrosison inocu lated tom ato p lants in greenhouse
2.4 病原菌的Biolog分析
病原菌FJAT-46819和FJAT-47134的biolog鉴定结果和系统参数如表1所示。根据Biolog系统规定[14],当SIM值>0.75时,鉴定的种名结果可靠;当SIM值小于0.75或0.5时,鉴定的属名可靠。本研究中2个菌株FJAT-46819和FJAT-47134的SIM均小于0.75,因此2个菌株FJAT-46819和FJAT-47134均鉴定为肠杆菌属(Enterobacterspp.)菌株。
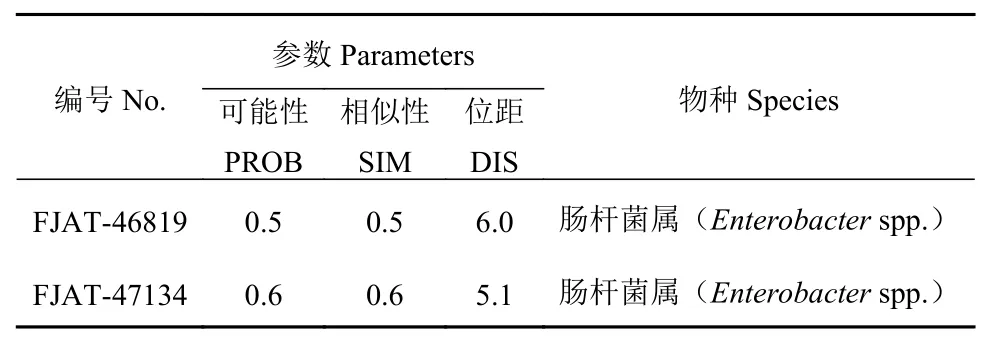
表1 Biolog分析结果Table 1 Results of biology analysis
2.5 病原菌的分子鉴定
菌 株FJAT-46819(MW 512876)和FJAT-47134(MW 512877)的16SrDNA序 列 分 别 为1403 bp和1407 bp。经BLAST分析,这2株菌的16S rDNA序列与肠杆菌属(Enterobacter)的序列同源性较高。图4为利用MEGA 6.0软件的NJ法建立的肠杆菌属系统发育树,结果显示,菌株FJAT-46819和FJAT-47134与 阿 氏 肠 杆 菌(Enterobacter asburiaeATCC 35953T)16S rDNA序列聚在一起,它们的同源性最高。
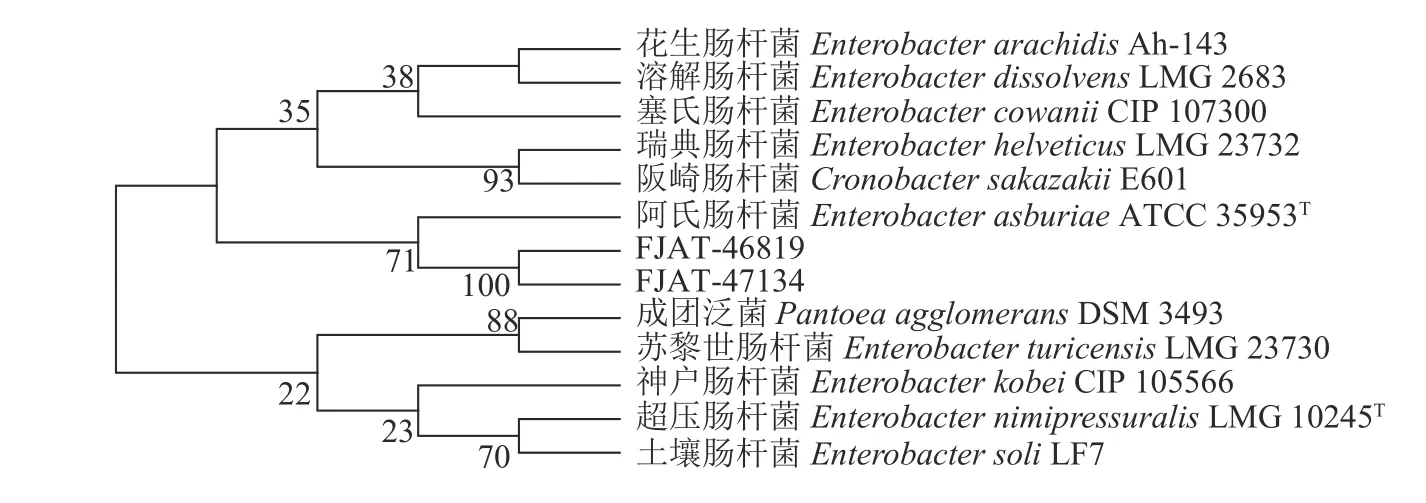
图4 菌株FJAT-46819和FJAT-47134的16 S rDNA基因进化树分析Fig.4 Phylogenetic tree based on partial 16S rDNA gene sequencesof FJAT-46819 and FJAT-47134
2.6 病原菌的质谱鉴定
利 用MALDI-TOF-MS采 集 菌 株FJAT-46819和FJAT-47134的质谱数据,生成肽指纹图谱,与数据库中微生物进行检索匹配,结果如表2所示,菌株FJAT-46819和FJAT-47134与数据库中的阿氏肠杆菌匹配值分布于2.3~3.0。因此,将这2株菌鉴定为阿氏肠杆菌,该鉴定结果与分子鉴定结果一致,且2株菌的可信度分值差异小于0.1,说明它们的相似度极高。

表2菌株FJAT-46819和FJAT-47134的MALDI-TOF-MS鉴定结果Table 2 Results of MALDI-TOF-MS analysis on FJAT-46819 and FJAT-47134
3 讨论与结论
番茄细菌性髓部坏死病是2017–2019年发生于福建和浙江种植的大棚番茄上的病害。通过对发生该病的病株茎部病健交接处病菌分离、16S rDNA分子鉴定、系统发育分析及MALDI-TOF-MS质谱鉴定、致病性测定等系列试验,确定引起福建和浙江大棚番茄髓部坏死病的病原菌为肠杆菌属的阿氏肠杆菌(E.asburiae)。这是在番茄上发现的一种新病害,还未见国内外相关报道。
肠杆菌属包括21个种与2个亚种,广泛存在于自然界中,在婴幼儿配方奶、临床标本、植物等材料中均可检出。与植物有关的肠杆菌包括阿氏肠杆菌、生癌肠杆菌(E.cancerogenus)、阴沟肠杆菌(E.cloacae)、阴沟肠杆菌溶解亚种(E.cloacae subsp.dissolvens)、溶解肠杆菌(E.dissolvens)、中间 肠 杆 菌(E.intermedius)、超 压 肠 杆 菌(E.nimipressuralis)、水稻肠杆菌(E.oryzae)、梨形肠杆菌(E. pyrinus)、桑肠杆菌(E.mori)、阪崎肠杆菌(E. sakazakii)、E.radicincitans、E.ludwigii等[15−17]。一些肠杆菌属菌株则会侵染植物引起寄主发病,但宿主范围很狭窄,倾向于侵染木本植物。研究报道,可引起植物致病的肠杆菌属菌株主要有以下8个种:引起白杨树溃疡病的生癌肠杆菌,导致玉米秆腐败病的溶解肠杆菌,引起榆树湿心病的超压肠杆菌,引起梨树叶片褐斑病的梨形肠杆菌,引起木瓜果实黄化病的阪崎肠杆菌,引起多种作物(椰子萎蔫病、榆树湿心病、番木瓜果肉黄化病、洋葱腐烂病、生姜茎腐病、夏威夷果灰果仁病、桑树和辣椒枯萎落叶性病)病害的阴沟肠杆菌,桑树枯萎落叶性病害的阿氏肠杆菌和桑肠杆菌等[16,18−25]。肠杆菌属通过分泌一些化学物质使宿主植物发病,但不同的菌株其致病机理不一样[26]。
阿氏肠杆菌是一类革兰氏阴性、周生鞭毛、厌氧发酵型杆状细菌,具有肠杆菌的普遍特征。肠杆菌属菌株具有丰富的种群和基因遗传多态性,菌株的多态性与菌株来源有关,但是菌株的遗传结构和致病力与多态性不存在相关性[25]。目前,由阿氏肠杆菌引起的植物细菌性病害仅在桑树上被发现[25,27],该病原菌引起桑树叶片黄化、枯萎、落叶和枝条顶端坏死,使植株产生枯萎和维管束褐变症状。本研究在番茄上发现阿氏肠杆菌会引起番茄细菌性髓部坏死病,其引发番茄发病的机理还不清楚,有待于进一步研究。目前该病只在福建和浙江有发现,其他省区是否发生尚不清楚。因此,应严格监控阿氏肠杆菌的动态,控制病害的传播蔓延,对保证我国番茄安全生产具有重要现实意义。
