李果斑病病原菌生物学特性及室内毒力测定
2022-01-04龙海江龙友华顾桂飞杨敬之尹显慧
舒 然,龙海江,龙友华,顾桂飞,3,杨敬之,尹显慧*
(1.贵州大学猕猴桃工程技术研究中心,贵州 贵阳50025;2.贵州大学作物保护研究所,贵州 贵阳550025;3.毕节市周驿茶场,贵州 毕节551700)
0 引言
【研究意义】李(Prunus salicinaLindl.)是蔷薇科(Roaceae)李属(Prunus)植物,原产于我国,经济价值高[1]。李是我国分布最广的果树之一,几乎各省区均有野生种或栽培种[2]。在我国保存、栽培的品种主要有中国李(P. salicina)、杏李(P. simonii)、樱桃李(P.cerasifera)和欧洲李(P.domestica)等[3],在贵州省栽培的主要地方品种为蜂糖李、脆红李和酥李等。李子具有丰富的营养,富含多种氨基酸和维生素[4],广受人们喜爱。近年来,贵州省李种植面积的不断扩大,各种病虫害发生日益严重,严重影响李产业发展[5]。【前人研究进展】李树主要病害有李红点病[6]、细菌性穿孔病[7]和褐腐病[8]等。笔者团队于2020年调查发现贵州安顺市李种植基地受果斑病危害严重,果实发病后向内凹陷,呈不规则的灰白色病斑,通过形态观察结合ITS、EF-1α和RPB2序列分析明确其致病菌为藤仓镰刀菌(Fusarium fujikuroi)。研究表明,藤仓镰刀菌可引起水稻恶苗病[9]、玉米茎腐病[10]、小麦赤霉病[11]等多种病害,对我国农业生产造成严重经济损失。此外,镰刀菌属真菌还会产生多种高毒性、低分子量的代谢产物,如玉米赤霉烯酮[12]、呕吐毒素[13]、T-2毒素等多种次级代谢物,食用被其污染的食品会引发严重的食品安全问题[14]。【本研究切入点】李果斑病为李树上新报道的病害,主要危害果实,其病原菌生物学特性及室内毒力研究尚待深入探讨。【拟解决的关键问题】本研究旨在明确李果斑病病原菌生物学特性,筛选有效控制该病害的杀菌剂,为探明该病害的发生发展规律及防控该病害奠定基础。
1 材料与方法
1.1 供试材料
供试菌株及培养基:李果斑病病原菌藤仓镰刀菌(F. fujikuroi,菌株编号HJGF1),由贵州大学作物保护研究所提供。马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基、牛肉膏蛋白胨(Beef extract peptone,BEP)培养基、马铃薯蔗糖琼脂(Potato sucrose agar,PSA)培养基、察氏(Czapek)培养基、胡萝卜(Carrot agar,CA)培养基和燕麦琼脂(Oatmeal agar,OA)培养基,各培养基参考宋莉莎等[15]的配方进行配制。
供试药剂:0.3%丁子香酚SL,南通神雨绿色药业有限公司;20%吡噻菌胺SC,日本三井化学AGRO株式会社;30%丙硫菌唑OD,安徽久易农业股份有限公司;45%苯菌酮SC,巴斯夫(中国)有限公司;25%嘧菌酯SC,先正达南通作物保护有限公司;50%嘧菌环胺WDG,江西正邦作物保护有限公司。
1.2 李果斑病病原菌生物学特性测定
1.2.1 培养基对病原菌菌丝生长的影响 将直径5.0 mm
菌饼接于上述6种培养基(PDA、BEP、PSA、Czapek、CA和OA)平板中央,28℃恒温培养,每个处理3次重复。7 d后采用十字交叉法测量菌落直径,下同。
1.2.2 李果斑病病原菌对碳、氮源的利用参照高晋等[16]的方法测定病原菌对不同碳、氮源的利用特性,以Czapek为基础培养基,分别用含有等量的不同碳源、氮源置换Czapek培养基中的蔗糖、硝酸钠,随后采用5.0 mm无菌打孔器打取HJGF1病原菌边缘菌饼,接种至含有不同碳氮源的培养基正中央,于28℃恒温培养箱中暗培养7 d后,观察病原菌生长状况,测量菌落直径,每个处理3次重复。
1.2.3 不同温度对李果斑病病原菌菌丝生长的影响
将培养5 d的HJGF1菌饼接种至PDA培养基平板中央,分别置于5℃、10℃、15℃、20℃、25℃、28℃、30℃、35℃和40℃恒温培养箱中暗培养7 d后,观察病原菌生长状况并测量菌落直径,每个处理3次重复。
1.2.4 不同pH值对李果斑病病原菌菌丝生长的影响采用1 mol·L−1HCl和1mol·L−1NaOH分别将PDA
培养基pH调至4、5、6、7、8、9、10共7个处理,将培养5 d的HJGF1菌饼接种至PDA培养基平板中央,于28℃下恒温培养箱暗培养7 d后,观察病原菌生长状况并测量菌落直径,每个处理3次重复。
1.2.5 光照对李果斑病病原菌菌丝生长的影响取菌饼移至灭菌处理后的PDA培养基平板上,分别于24 h黑暗、12 h明暗交替和24 h光照下28℃恒温培养,每个处理3次重复。
1.3 李果斑病病原菌室内药剂筛选
药剂筛选采用生长速率法[17]。依据初筛试验结果,各药剂分别设置5个质量浓度梯度(表1),PDA培养基中加入一定剂量的供试药剂,制成不同质量浓度梯度的含药平板,以加入等量无菌水的PDA平板为对照。将菌饼接种至不同质量浓度梯度含药PDA平板中央,置于28℃培养7 d,每个处理3次重复。测定方法同1.2.1,计算抑制率。
1.4 数据分析
采用Excel 2010软件统计数据并绘制图表,运用DPS7.05软件并采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 培养基对李果斑病病原菌菌丝生长的影响
如图1所示,不同培养基对李果斑病病原菌生长速度的影响存在显著差异。其中,病原菌在Czapek培养基上菌丝生长最快,培养7 d时,菌落直径 为54.17 mm,生 长 速 率达7.74 mm·d−1;在PDA培养基上次之,生长速率为7.45mm·d−1,与Czapek培养基处理无显著差异。致病菌在BEP、PSA、CA和OA培养基上也能生长,但速率较慢且菌丝较稀疏,在CA培养基上最慢,生长速率仅为5.40mm·d−1。

图1 不同培养基对李果斑病菌菌丝生长的影响Fig.1 Effect of culture m edia onm ycelial grow th of F. fujikuroi

表1供试药剂Table1 Fungicides evaluated
2.2 碳源对李果斑病病原菌菌丝生长的影响
如图2所示,李果斑病病原菌在不同碳源培养基上生长速率存在显著差异,在以可溶性淀粉为碳源时最快,培养7 d菌落直径为68.67mm,生长速率达9.81 mm·d−1;在以麦芽糖和葡萄糖为碳源的培养基上次之,生长速率分别为8.76 mm·d−1、8.26 mm·d−1,在以蔗糖为碳源时,其菌丝生长量相对较少;以乳糖为碳源时菌丝生长缓慢,生长速率仅为6.14mm·d−1。

图2 不同碳源对李果斑病病原菌菌丝生长的影响Fig.2 Effect of nitrogen sources on m ycelial grow th of F.fujikuroi
2.3 氮源对李果斑病病原菌菌丝生长的影响
如图3所示,李果斑病病原菌在不同氮源培养基上均能生长。其中在以硝酸钠为氮源时,其菌丝生长最快,菌落直径为50.83 mm,生长速率为7.26 mm·d−1;以蛋白胨为氮源时次之,生长速率为7.14 mm·d−1;在尿素培养基上最慢,生长速率仅为6.10 mm·d−1,致病菌在不同氮源培养基上菌丝丰度差异不大,而在不含氮源培养基(CK)上菌丝稀疏,生长缓慢。
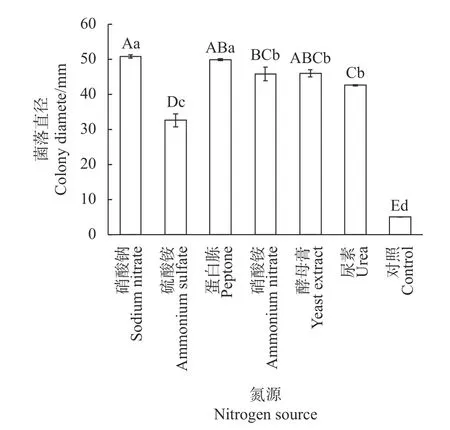
图3 不同氮源对李果斑病菌病原菌丝生长的影响Fig.3 Effect of carbon sources on mycelial grow th of F.fujikuroi
2.4 不同温度对李果斑病病原菌菌丝生长的影响
如图4所示,不同温度对李果斑病病原菌菌丝生长具有显著影响,该病菌在15~35℃内均可生长,培养7 d时菌落直径为15.33~53.67mm,其中最适生长温度为25℃,菌落直径为53.67mm,生长速率为7.67mm·d−1;培养温度在15℃以下或35℃以上时菌丝生长受到明显抑制。
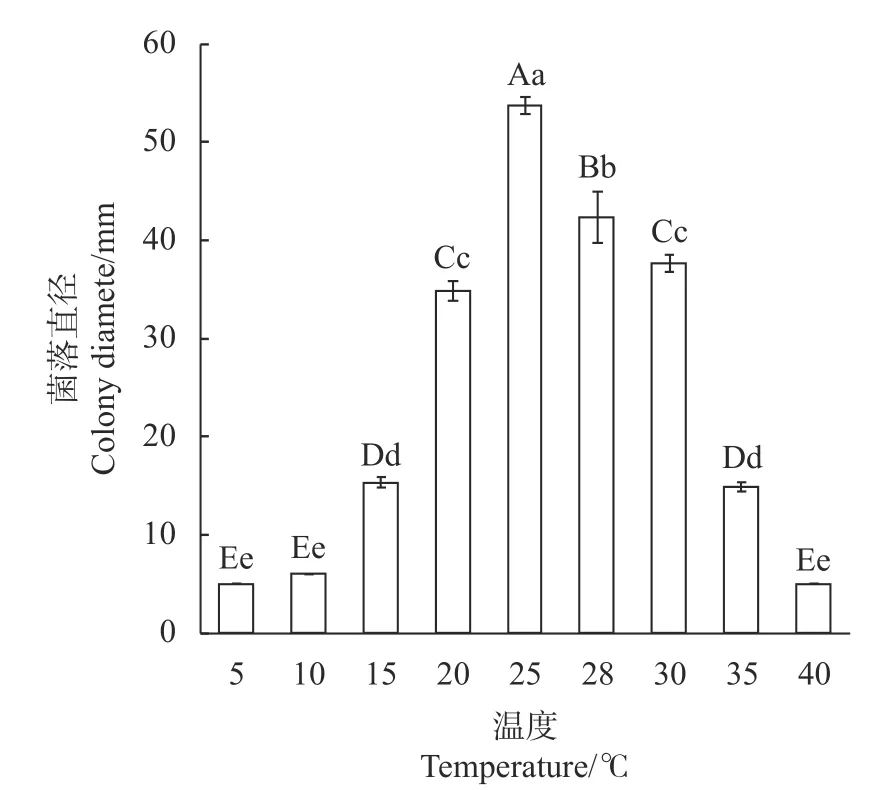
图4 不同温度对李果斑病菌菌丝生长的影响Fig.4 Effect of culture tem perature on m ycelial grow th of F.fujikuroi
2.5 不同pH对李果斑病病原菌菌丝生长的影响
如图5所示,李果斑病病原菌在pH 4~10范围内均可生长,且病原菌菌丝生长速度随pH值升高呈先增加后降低趋势。适宜病原菌生长的pH为7~8,菌丝生长速率为5.83~6.33mm·d−1,说明该致病菌对碱性环境具有一定耐受力,在酸性环境中生长速度相对较慢。
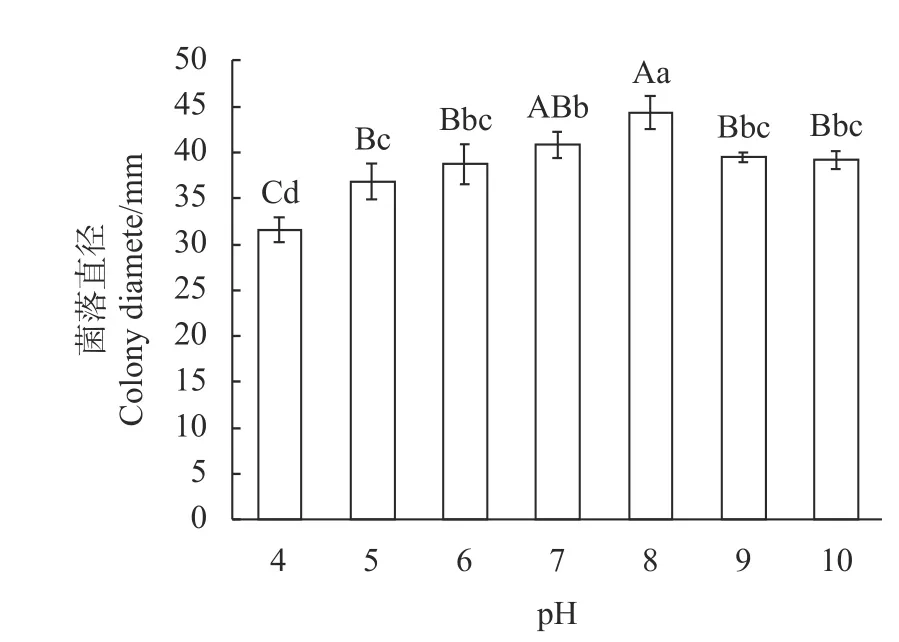
图5 不同pH对李果斑病病原菌菌丝生长的影响Fig.5 Effect of pH on mycelial grow th of F. fujikuroi
2.6 不同光照对李果斑病病原菌菌丝生长的影响
由图6可知,病原菌在24 h持续黑暗、24 h持续光照和12 h光暗交替条件下均能生长。培养7 d时,菌落生长速率分别为7.55mm·d−1、7.45 mm·d−1、7.40mm·d−1,处理间差异不显著(P>0.05)。

图6 不同光照条件对李果斑病病原菌菌丝生长的影响Fig.6 Effect of light exposure on m ycelial grow th of F. fujikuroi
2.7 不同杀菌剂对李果斑病病原菌室内毒力
如表2所示,不同杀菌剂对李果斑病病原菌的室内毒力存在显著差异。其中,45%咪鲜胺EW对李果斑病病原菌抑制效果最佳,EC50为0.891 4μg·m L−1;其次分别为20%吡噻菌胺SC和30%丙硫菌唑OD,EC50分别为0.943 6μg·m L−1和1.022 0μg·m L−1;45%苯菌酮SC对该病菌的抑制效果最差,其EC50值为19.640 3μg·m L−1。
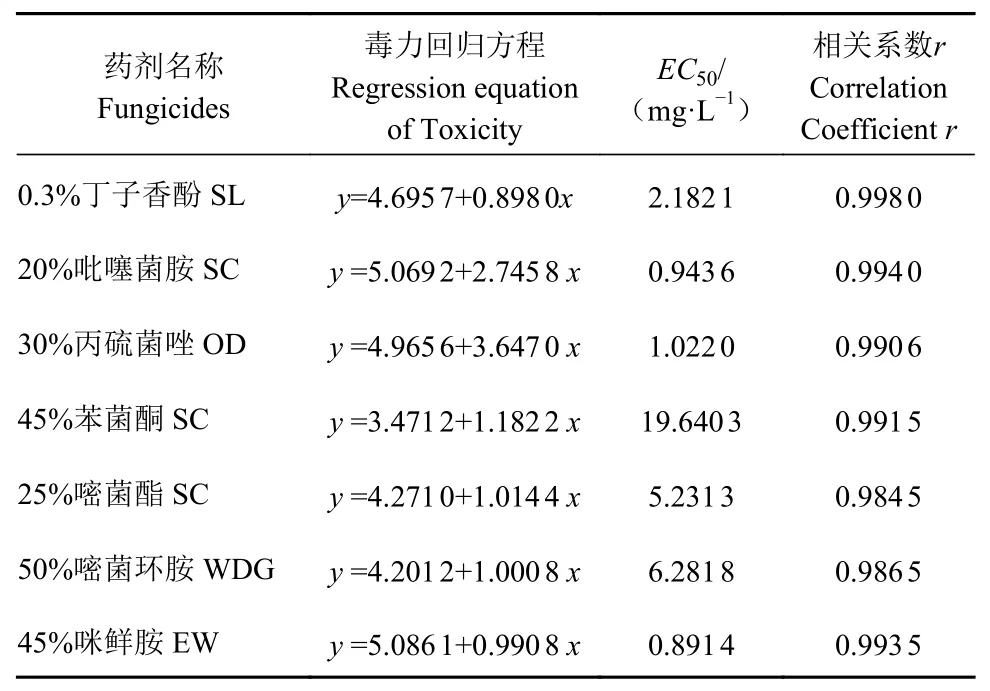
表2 7种杀菌剂对李果斑病病原菌的室内毒力测定Table 2 Indoor toxicity test results of 7 fungicides on F.fujikuroi
3 讨论
镰刀菌属(Fusariumspp.)分布广泛,种类繁多,可致多种植物病害从而造成作物大量减产,已有研究发现,镰刀菌属能引起蔬菜[18,19]、中药材[20]、果树[21]和绿肥[22]等作物根腐病及薯类[23]和油料作物干腐病等[24],给我国农业生产带来巨大经济损失。藤仓镰刀菌(Fusarium fujikuroi)是引起水稻恶苗病的重要致病菌[25],该致病菌还可引起百香果叶部病害[26]、大豆种腐病[27]、玉米茎腐病[28]等多种病害。目前,关于李果实致病菌藤仓镰刀菌生物学特性及其防治药剂的筛选鲜有报道,本研究初步明确李果斑病致病菌生物学特性,并筛选有效防治该病害的药剂,可为生产上防控李果实病害奠定基础。试验结果表明,藤仓镰刀菌在Czapek和PDA培养基上生长状况最好,菌丝量大,这与前人[27]研究结果不同,可能与种间差异及寄主不同有关;藤仓镰刀菌适宜生长温度范围为20~35℃,最适生长温度为25℃,这与王燕等[29]报道的镰刀菌属的甜瓜果腐病菌最适生长温度相符;病原菌能有效利用供试6种碳源及5种碳源,其中最佳氮源为硝酸钠和蛋白胨,最佳碳源为可溶性淀粉,与侯恩庆[30]结果基本一致。不同光照条件对该病原菌菌丝生长速度无显著影响,与姜苏月等[31]研究结果一致。李果斑病病原菌在pH为4~10均可生长,最适生长pH为8,在弱碱性或中性条件下生长力较强,与侯恩庆[30]报道的相一致。
化学药剂是防治植物病害最主要的手段,李果斑病为在李树上新报道的病害,其防治药剂有待深入研究。陈宏州等[25]研究表明,95.2%咪鲜胺原药能有效抑制藤仓镰刀菌的生长,EC50为0.01μg·m L−1;朱广啟等[32]试验表明,5%嘧菌酯SC能抑制引起黄芩根腐病的茄病镰刀菌生长;周鑫钰[33]研究发现,40%咪鲜胺EW和50%多菌灵WP对蓝莓根腐病菌毒力 较 强,其EC50分 别 为0.071 59 mg·L−1和2.832 9 mg·L−1。彭昀等[34]研究几种杀菌剂对橡胶树枯萎病菌尖孢镰刀菌的室内毒力,结果发现,97.3%咪鲜胺、96%吡唑醚菌酯和97.2%多菌灵原药对尖孢镰刀菌的毒力较好,EC50值分别为0.73、1.71、1.01 mg·L−1。本试验测定7种杀菌剂对藤仓镰刀菌的室内毒力,结果表明,45%咪鲜胺EW、20%吡噻菌胺SC和30%丙硫菌唑OD对该致病菌室内毒力较强,其EC50值 分 别 为0.8914、0.9436、1.0220μg·m L−1。在农业生产过程中,化学药剂对病害的实际防治效果易受多种因素影响,因此还需进一步开展田间试验以明确本试验中化学药剂的实际防效。
4 结论
李果斑病病原菌适宜在Czapek和PDA培养基上生长,最适pH值为7~8,最适生长温度为25℃,以淀粉和葡糖糖为碳源、蛋白胨和硝酸钠为氮源时生长较好;室内毒力测定结果显示,45%咪鲜胺WDG和20%吡噻菌胺SC对李果斑病病原菌抑制作用最强。
