胃息肉患者胃液微生态分析与功能预测
2022-01-03张冉李兰夏华向谢文瑞何兴祥
张冉 李兰,2 夏华向,2 谢文瑞,2 何兴祥,2
1广东药科大学附属第一医院消化内科(广州510000);2广东省微生态治疗工程技术研究中心(广州510000)
胃息肉是胃黏膜上皮细胞增生并凸入胃内形成的隆起性病变,近年来胃息肉发病率有上升趋势[1]。胃息肉被认为有一定的癌变风险,但具体病因尚未明确。既往认为胃内是无菌状态,近年来的国内外大量研究表明,胃有独立的微生态体系[2]。正常人群胃内有多种微生物定植,幽门螺杆菌(Helicobacter pylori,Hp)阴性人群胃内细菌总量可达(1.38±0.72)×103CFU/g[3],正常胃肠道菌群包括了厌氧菌、需氧菌、兼性厌氧菌,它们通过稳定菌群结构及多种调控系统去维护胃肠微环境的相对稳定和平衡,抑制致病菌的生长[4]。胃微生态的改变可能是胃息肉发生的一个潜在致病因素。
既往对胃微生态的研究大多停留在分析生物多样性、物种组成等方面,无法从微生物互作网络的角度解析菌群-菌群之间的关系[5]。而且多数研究针对胃癌、胃溃疡或者肠上皮化生等人群,对胃息肉患者菌群的研究较少,不同地区人群的胃微生态亦存在差异。此外,胃液具有独特的菌群结构,与唾液菌群、胃黏膜菌群不同。
本研究通过观察胃息肉患者胃液微生物多样性、物种组成、门、属水平差异分析、菌群分子生态网络结构,探讨Hp 感染对胃息肉患者微生态的影响,以及菌群关系和功能基因之间的差异。
1 资料与方法
1.1 一般资料连续纳入2019年4月1日至2020年9月30日于广东药科大学附属第一医院内镜中心接受胃镜检查并诊断为胃息肉患者,根据Hp 感染情况分为息肉Hp(+)组与息肉Hp(-)组。胃镜下胃黏膜未见异常且Hp 阴性者为健康组。纳入标准:(1)年龄20 ~80岁,性别不限;(2)1个月内未使用抗生素且未进行过Hp根除治疗的患者;(3)自愿签署知情同意的受检者。排除标准:(1)明确胃癌、胃溃疡、既往有胃切除手术史的患者;(2)6 个月内服用大剂量益生菌者。胃息肉诊断标准:胃镜下诊断为胃息肉并经病理活检证实为非癌性息肉。
1.2 组织病理检查及Hp感染情况判断病理诊断由我院病理科完成。通过快速尿素酶试验、硼酸美蓝组织染色、C13 呼气试验判断Hp 感染情况,三种检查方式有一种为阳性则定义为Hp感染阳性。
1.3 胃液样本收集及处理胃镜消毒灭菌干燥后进入胃底部黏液湖,通过一次性医用20 mL 注射器连接活检孔道,抽取5 mL 胃液于15 mL 无菌离心管中,以6 000 RCF/min 离心10 min,分装后冻存于-80 ℃冰箱。提取DNA 后,使用通用引物341F(5′-CCTACGGGNGGCWGCAG-3′)和806R(5′-GACTACHVGGGTATCTAATCC-3′)及高保真DNA 聚合酶对选定的V3-V4 可变区进行PCR 扩增。使用KAPA Illumina Library Quantification Kit 建库试剂盒进行文库构建,文库质检合格后使用Illumina NovaSeq System 上机测序。
1.4 生物信息学分析基于R4.0.3、Rstudio 1.3.1093、Vsearch v2.15.1、Usearch v10.0.240 搭建测序平台。测序得到的PE reads,对经过Vsearch 拼接、Deblur 去噪、Usearch 聚类后形成扩增序列变异体(amplicon sequence variant,ASV)进行物种注释,得到对应的物种信息和物种的丰度分布情况。通过R 包、STAMP2.1.3 进行α、β 多样性,物种组成差异分析;Co-currence 网络关系分析;BUGBASE 进行表型预测、PICRUSt 功能预测,分析健康组、息肉Hp(-)组、息肉Hp(+)组功能差异。
1.5 统计学方法运用SPSS 23.0 和R 包,STAMP进行数据统计分析。采用描述性分析研究对象资料。通过vegan 包进行α 多样性分析;β 多样性基于Jaccard 距离通过限制性主坐标轴分析;通过Welch′sttest 评估不同分组间物种门、属水平的差异。BUGBASE 表型组间差异通过Mann-Whitney 检验。基于OUT与物种信息,通过igraph、WGCNA包,获得基础网络参数,计算网络相关性质。PICRUSt功能预测,利用STAMP 进行KEGGL3 级别的组间Kruskal-WallisH检验,并通过Story FDR 校正,进行差异分析比较。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象资料成功收集81 例胃液标本,健康组28 例、息肉HP(-)组40 例和息肉HP(+)组13 例,年龄20 ~80 岁,见表1。

表1 研究对象资料Tab.1 Clinical characteristic of the study cohort
2.2 胃液α、β 多样性分析如图1A 所示,健康组、息肉Hp(+)组、息肉Hp(-)组的共有ASV 数为90 个,特异性ASV 数为分别为33、32、27 个。Richness、shannon 指数可分别反映微生物群落组成的丰富度和均匀度,而由图1B、1C 可知三者α 多样性差异无统计学意义(P>0.05)。β 多样性可以描述不同样品微生物群落构成差异。通过CPCoA 显示空间水平上三组间最大差异。β 多样性差异有统计学意义(P=0.045,图1D)。
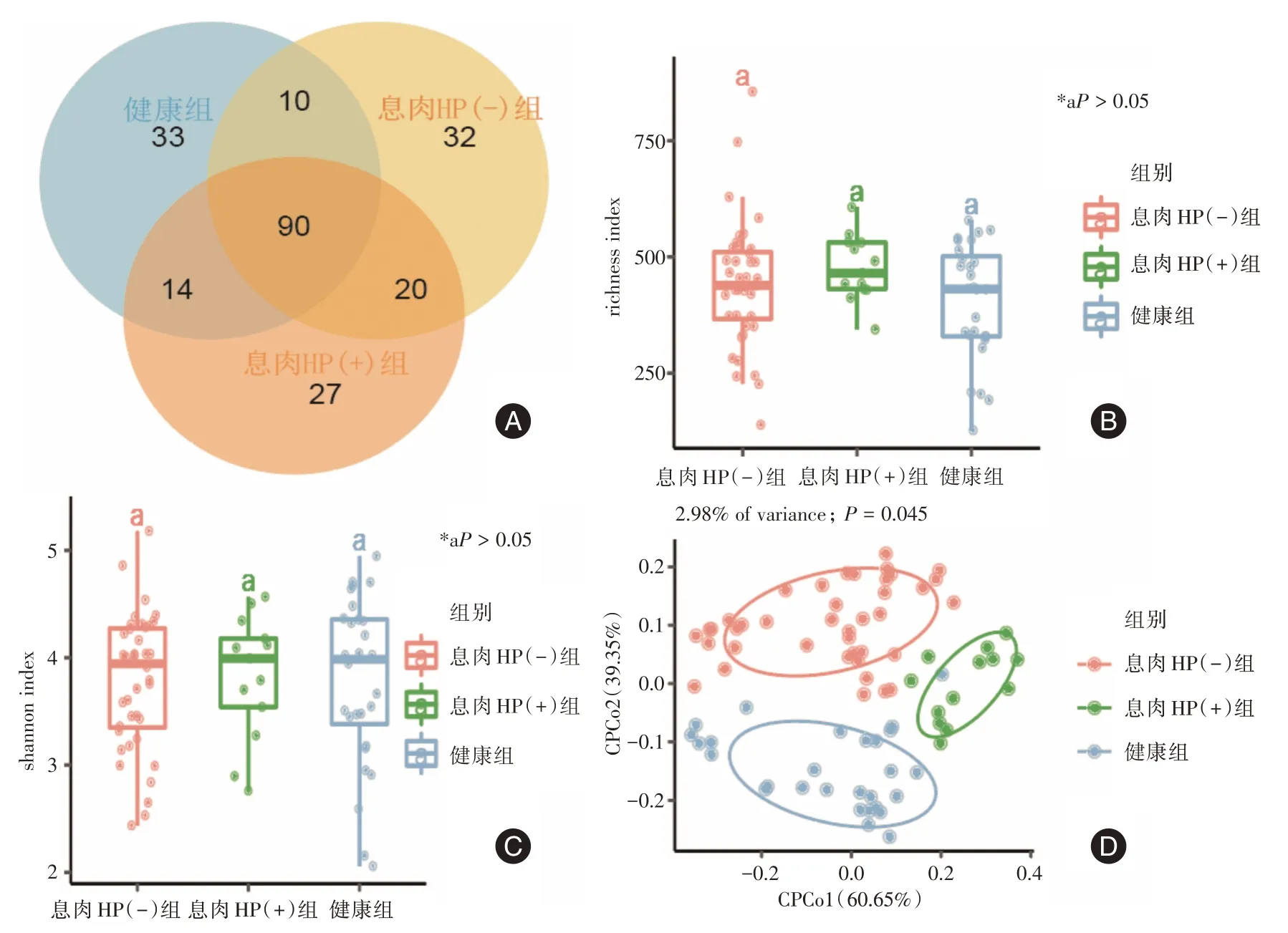
图1 胃液菌群生物多样性分析Fig.1 Analysis of the bacterial diversity in gastric juice
2.3 胃液菌群的组成通过ASV 特征表与物种注释,进行树图maptree分析,筛选丰度前100的ASV,用以表达多层物种关系(图2A);同时用柱状图表示各组门属水平优势菌。胃液中有六种高丰度菌门汇聚,依次为厚壁菌门、变形菌门、拟杆菌门、放线菌门、梭杆菌门、Candidatus_Saccharibacteria(图2B)。胃液中优势菌属为链球菌、普雷沃氏菌、嗜盐单胞菌、罗斯氏菌、韦荣球菌、奈瑟氏球菌、梭杆菌、放线菌、牙龈卟啉单胞、嗜血杆菌(图2C)。
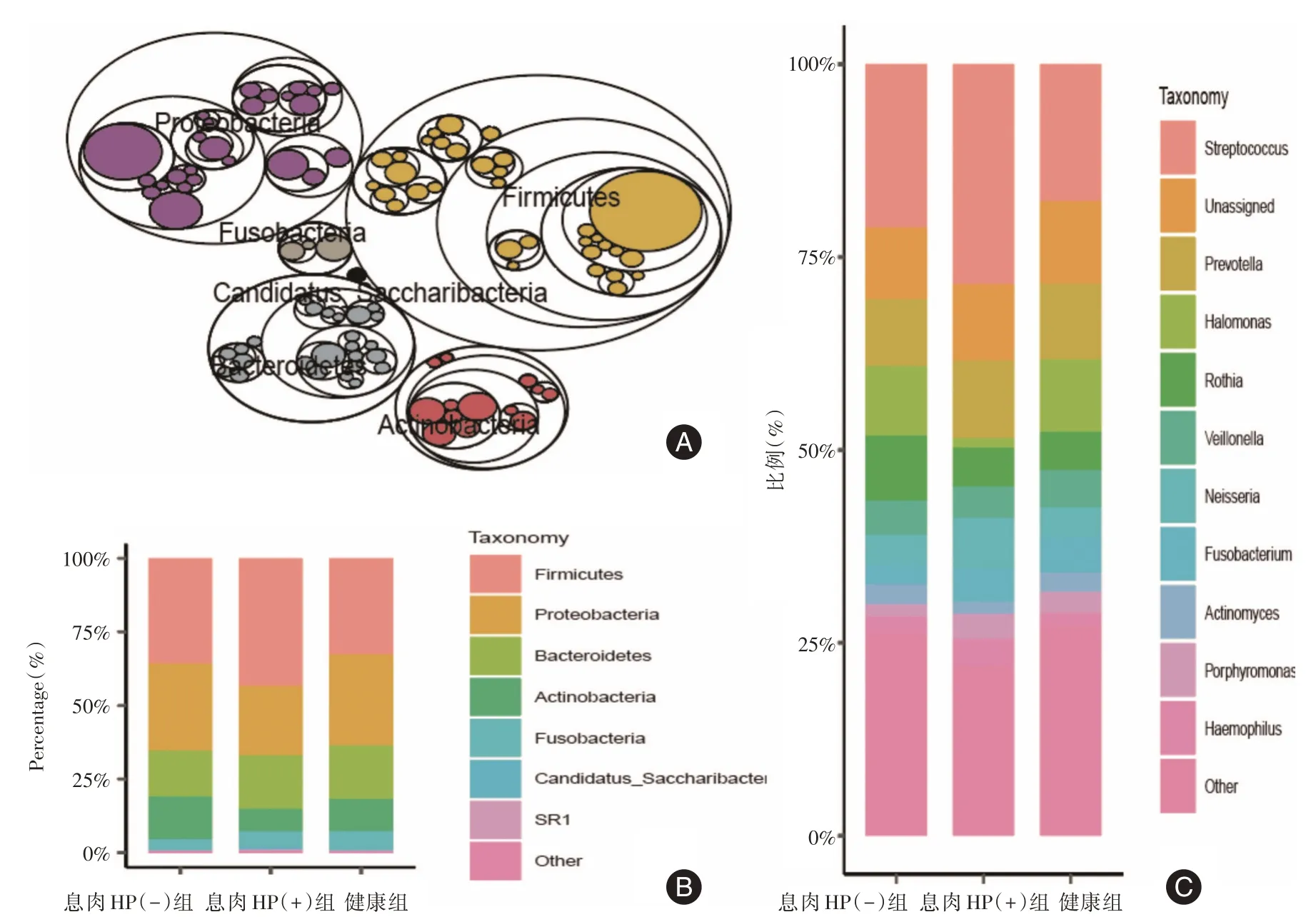
图2 胃液菌群门、属水平优势菌群构成Fig.2 Composition of dominant microflora at phylum and genus level in gastric juice
2.4 STAMP 差异物种分析
2.4.1 门水平差异分析在门水平上,息肉Hp(-)组较健康组梭杆菌门丰度下降(P= 0.045);息肉Hp(+)组较息肉Hp(-)组放线菌门丰度下降(P=0.003)。
2.4.2 属水平差异分析在属水平上,息肉Hp(-)组较健康组Catonella、Granulicatella 丰度降低,Novosphingobium、Caulobacter、Dietzia、Bradyrhizobium 丰度升高(P<0.005);息肉Hp(+)组较健康组Lachnoanaerobaculum 丰度升高,Achromobacter、Curvibacter、Glycocaulis、Sphingomonas、Nesterenkonia、Mesorhizobium、Halomonas丰度下降(P<0.005);息肉Hp(+)组较息肉Hp(-)组Lachnoanaerobaculum、Oribacterium 丰度升高(P<0.005)。
2.5 Bugbase 表型分析对需氧菌、厌氧菌、革兰氏阳性菌、革兰氏阴性菌、生物膜形成、致病潜力、移动元件含量、氧的利用、氧化胁迫耐受九种表型进行分析。息肉Hp(-)组与息肉Hp(+)组在需氧菌上存在差异(P= 0.03),息肉Hp(-)组的物种丰度高于息肉Hp(+)组(40>28),而在其他表型上未见显著差异。利用OTUs 分析了需氧菌占主要贡献的菌门,息肉Hp(-)组较息肉Hp(+)组Proteobacteria、Firmicutes 均升高。
2.6 胃液菌群Co-occurrence 网络图基于ASV和物种注释,用R 包进行网络拓扑结构基本参数分析,见表2。健康组的边数为314,正向关系边数为223,负向关系边数为91,健康组与息肉Hp(-)组的网络拓扑基本参数均大于息肉Hp(+)组。而健康组的负向边数、节点数、紧密中心性、介数中心性大于息肉Hp(-)组。同时分别绘制三组Co-occurrence 网络图,反应主要网络菌属关系。通过属水平的物种分类为节点配色,着色点大小反应物种在整个网络关系的作用,不同颜色表示不同的物种;连线的颜色表示正负相关性,红色表示正相关,蓝色表示负相关;线的粗细表示相关性系数的大小,线越粗,表示物种之间的相关性越高;线越多,表示该物种与其他物种之间的联系越密切,A 为健康组、B 为息肉Hp(+)组、C 为息肉Hp(-)组,见图3。
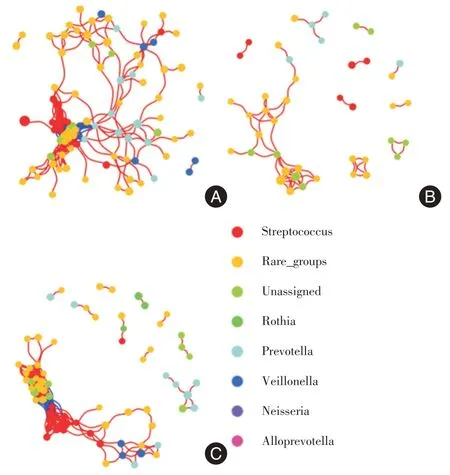
图3 三组菌群Co-occurrence 网络关系Fig.3 Co-occurrence network of three groups of bacteria
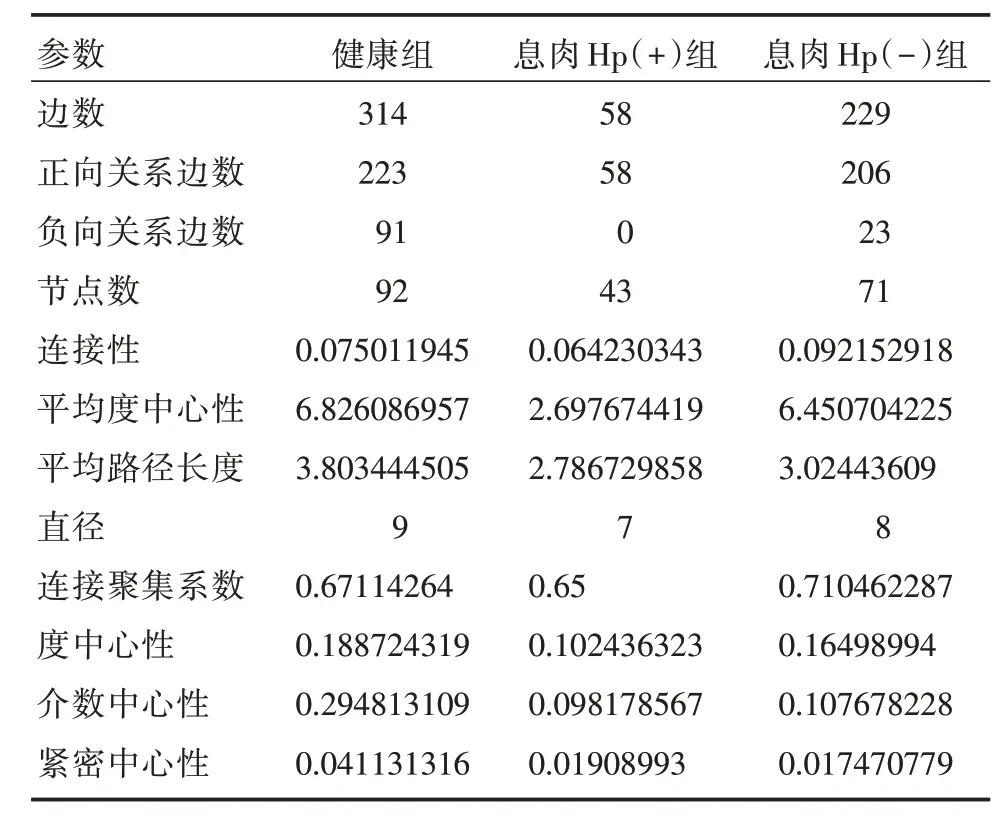
表2 三组菌属网络拓扑结构基本参数Tab.2 Basic parameters of topological structure of three groups of bacteria
健康组的胃液菌群之间的菌属关系更为复杂,Streptococcus、Prevotella、Rare_groups、Unassigned、Veillonella 存在正相关关系,同时Prevotella、Streptococcus、Unassigned 之间存在负相关关系;息肉Hp(+)组Unassigned、Rare_groups、Prevotella 存在正相关关系;息肉Hp(-)组中Streptococcus、Unassigned、Prevotella、Rare_groups 呈正相关与负相关关系,同时Streptococcus、Rare_groups、Rothia 呈正相关关系,见图2。
2.7 PICRUSt 功能预测与差异分析息肉Hp(+)组较息肉Hp(-)组在糖基转移酶、维生素B6 代谢、幽门螺杆菌感染中的上皮细胞信号转导、核糖体合成等代谢通路上调(P<0.05)。
3 讨论
胃肠道内栖息的微生物之间保持互生或拮抗关系,与人类的健康及疾病密切相关[6]。而胃微生态学的研究仍处于起步阶段,虽然研究者对Hp感染如何影响胃微生态较为重视,但结论尚不明确。有研究表明Hp 感染可以显著影响胃部菌群[7],也有研究报道Hp 阴性、阳性患者之间的微生物组成无显著差异[8]。既往的动物实验发现急性、慢性感染Hp 均不会显著改变鼠胃微生物的生态系统[9],而HEIMESAAT 等[10]的研究表明感染了Hp 的小鼠盲肠中大肠杆菌丰度上升,说明Hp 阴性和阳性个体的细菌群落分布仍高度复杂,不同疾病状态下的菌群关系有差异性。
本研究引入微生物分子生态网络体系,描述生物群落结构,通过比较三者间的网络拓扑结构参数可知,三组间生物多样性不同。相较于息肉Hp(-)组及健康组,息肉Hp(+)组胃微生态网络间的连线减少,分子生态网络平均连接度与平均聚集系数下降,微生物群落结构趋向多样化且联系程度减弱,从而导致物种间的信息、能量和物质的传递效率下降。
微生物通过建立更多的相互作用关系以抵抗不良环境所带来的压力,健康人群的上消化道主要菌为需氧菌,息肉Hp(-)组需氧菌的物种丰度高于息肉Hp(+)组,说明需氧菌在维持胃微生态稳态中起到重要作用[11]。正常人体的需氧菌如葡萄球菌、链球菌和乳酸杆菌,可以合成维生素、泛酸等营养素,参与糖类和蛋白质代谢,促进铁、镁、锌等矿物质的吸收。同时保持相对稳定比例状态,有利于及时清除胃内的致病菌及其产生的毒性物质,充分发挥生物拮抗和生物屏障功能。因此胃息肉者感染Hp 后需要注意需氧菌含量,及时调整胃微生态。
本次研究中,息肉Hp(+)组致病菌丰度上升,非致病菌丰度下降,与息肉Hp(-)组相比,息肉Hp(+)组Oribacterium、Lachnoanaerobaculum 丰度上升,其与早期大肠癌、反流性食管炎等消化系统疾病密切相关[12-14]。与健康组相比,息肉Hp(+)组非致病菌丰度下降,如Achromobacter、Glycocaulis、Nesterenkoni 等丰度下降,其常在健康者体内作为常驻菌被检出。通过PICRUST 功能预测可知息肉Hp(+)组与息肉Hp(-)组菌群代谢通路差异明显。主要表现在息肉Hp(+)组与幽门螺杆菌相关的致病代谢与炎症通路明显上调,如非同源端接上调,该机制受感染调节,幽门螺杆菌感染引起过多的DNA 损伤,为了维持基因组完整性,胃上皮细胞通过该通路进行完整的DNA 损伤修复(DDR)[15];同时,维生素B6 生物合成酶被认为是细菌中的新型毒力因子,维生素B6 代谢上调加速幽门螺杆菌的糖基化鞭毛合成和鞭毛运动[16]。综上可知,幽门螺杆菌感染使胃息肉患者致病菌丰度上升,常驻菌丰度下降,同时影响胃息肉患者胃部菌群的代谢,加剧了炎症反应,因此胃息肉患者需进行Hp 检测,若为阳性,需要积极治疗。
与息肉Hp(-)组相比,健康组菌群之间存在更多的正向边与负向边关系,菌群之间的相关性节点更多,说明菌群之间的竞争与协作的关系更加复杂,微生态稳定性更高。而胃息肉者的菌群之间的相关性节点变少,菌群作用关系减弱。在感染幽门螺旋杆菌后,菌群群落之间的联系进一步下降,竞争关系减少,复杂程度降低。组间进行差异结果表明:息肉Hp(-)组Catonella、Granulicatella 属丰度下降,他们通常在人体口腔、胃肠道黏膜上共生[17];而Novosphingobium、Caulobacter、Dietzia、Bradyrhizobium 等与疾病相关的优势菌属升高,如Novosphingobium 与胃肠道疾病有关[18],Dietzia 牙髓感染密切相关[4]。本研究表明胃息肉患者微生态紊乱后,致病菌丰度升高,常驻菌丰度下降。
本次研究发现,Lachnoanaerobaculum 在健康组、息肉Hp(-)组、息肉Hp(+)组相对丰度依次升高。而检测到的优势菌门、菌属与既往的研究中的优势菌并不相同,如嗜盐单胞菌属既往的研究少有报道。从胃液菌群门水平的研究表明,胃息肉患者的菌群丰度发生改变,与既往的门水平无变化的结果不同[19],原因可能与本次研究主要针对南方人群有关,与先前针对的北方人群不同[20],提示在研究胃微生态时主要注意地域差异。
本研究通过生物信息学分析,表明胃息肉患者胃液微生态发生了紊乱,生物多样性受到影响,菌-菌的作用关系趋向简单,抵御致病菌群的能力下降,同时幽门螺杆菌作为一个致病因素会进一步加重胃息肉患者的微生态紊乱。
本研究有以下局限性:本研究样本量有限,分配给亚组的样本数量相对较少,研究结论有待更大样本量的研究进一步验证;此外,本研究只分析了胃细菌,真菌或病毒及其变化的影响需要进一步研究。
