慢性阻塞性肺疾病急性加重期住院患者痰细胞学和预后的相关性
2022-01-03谭燕彭玉兰张云辉王盛兰
谭燕 彭玉兰 张云辉 王盛兰
云南省第一人民医院,昆明理工大学附属医院呼吸与危重症医学科(昆明650032)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以不完全可逆的小气道气流受限为特征的疾病。近年来,越来越多的证据[1-3]显示COPD是一种异质性疾病,不同的炎症表型其临床表现、严重程度不同,疾病进展速度和预后也不尽相同。因此,针对不同炎症表型的诊疗显得尤为重要。诱导痰细胞学检查和血常规是两种临床常用的、安全、经济和高效的研究COPD气道炎症的有用工具[4],也是COPD 的炎症表型之一。COPD患者的预后是否跟炎性表型相关目前尚未完全明确[5-7]。据此,本研究探讨COPD急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者的痰细胞学和预后的关系,为针对COPD 不同炎症表型进行精准诊疗提供理论依据。
1 对象与方法
1.1 研究对象此研究选取2016年2月至2018年7月,我院呼吸与危重症医学科住院部新收入院的确诊AECOPD 患者302 例,随访过程中失访11 例,最终纳入291 例。其中男241 例,女50 例,平均年龄(66.7±10.6)岁,平均身高(164.5±7.4)cm,平均体重(59.7 ± 11.6)kg,平均BMI(21.9 ± 4.4)。其诊断符合慢性阻塞性肺疾病全球倡议(the Global Initiative for Chronic Obstructive Lung Disease,GOLD)指南2016 版的AECOPD 诊断标准[8],无合并其他呼吸系统疾病(包括支气管哮喘)。所有入选者均签署知情同意书。本研究经云南省第一人民医院医学伦理委员会批准。所有患者在入院当天均采集诱导痰进行痰细胞计数、血常规检查。入院病情稳定后行肺功能检查。
1.2 研究方法
1.2.1 诱导痰及痰液处理方法采用广州呼吸疾病研究所实验室建立的诱导痰处理方法[9]:患者吸入喘乐灵10 min 后,用清水漱口、擤鼻,然后用力深咳,不能咳出者采用高渗盐水超声雾化吸入。咳痰至已消毒的培养皿,在收集到的痰中挑取密度大、黏稠度高的分泌物,称重,加入二硫苏糖醇(dithiothreitol,DTT)裂解,过滤杂质,离心,沉淀用磷酸盐缓冲液(phosphate buffer solution,PBS)悬浮,台盼兰鉴定细胞活力。制作细胞涂片,风干后多聚甲醛固定,染色,烘干后中性树胶封片,光学显微镜下进行细胞分类。计数400 个白细胞,进行细胞分类,包括嗜酸粒细胞、中性粒细胞、巨噬细胞和淋巴细胞。
1.2.2 采集血常规所有入组AECOPD 患者入院当日抽取静脉血,血液分析仪测定白细胞总数、中性粒细胞数、淋巴细胞数,嗜酸粒细胞数并计算血中性粒细胞与淋巴细胞比例(neutrophil-to-lymphocyte ratio,NLR)。
1.2.3 肺功能测定采用标准统一的JAEGER肺功能仪(德国carefusion 公司)进行检测。检测所有受试者坐位舒张后第1秒用力呼气容积(FEV1)、第1 秒用力呼气容积占预计值百分比(FEV1%pred)、1秒率(FEV1/FVC)。支气管舒张剂为沙丁胺醇(万托林),经储雾罐给予400 μg,间隔15 min 后检测。肺功能检测质量控制参考文献[10]的方法。
1.2.4 随访通过住院病历及电话在每位入组患者出院3 个月、1年及2年时进行随访,记录了解患者出院后病情、治疗、复查情况、死亡时间等。
1.3 统计学方法使用K-S 法检验指标的正态性,对于非正态分布的数据以中位数(四分位数)表示,三组以上的组间差异使用K-W-H 秩和检验进行比较;使用Bonferroni 法进行两两比较。对于两组的数据,采用Whitney-U 检验进行比较。受试者工作曲线绘制(receiver operating characteristic curve,ROC)评估最大曲线下的面积(the area under the ROC curve,AUC),通过最大化约登指数选取最佳截断值。使用Spearman 秩相关计算相关性。数据分析使用统计软件SPSS 22.0,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料和炎性因子比较按照GOLD 分级[8](使用支气管扩张剂后的FEV1占预计值[11]百分 比)分 组,GOLD1 级47 例,GOLD2 级76 例,GOLD3 级91 例,GOLD4 级77 例。痰中性粒细胞、痰巨噬细胞百分数在GOLD1 级、2 级和GOLD3 级、4 级之间差异有统计学意义[12](P<0.05),痰淋巴细胞百分数在GOLD2 级和GLOD4 级之间差异有统计学意义(P<0.05)。NLR、血淋巴细胞数在GOLD1 级、2 级和GOLD3 级、4 级之间差异有统计学意义(P<0.05,表1)。
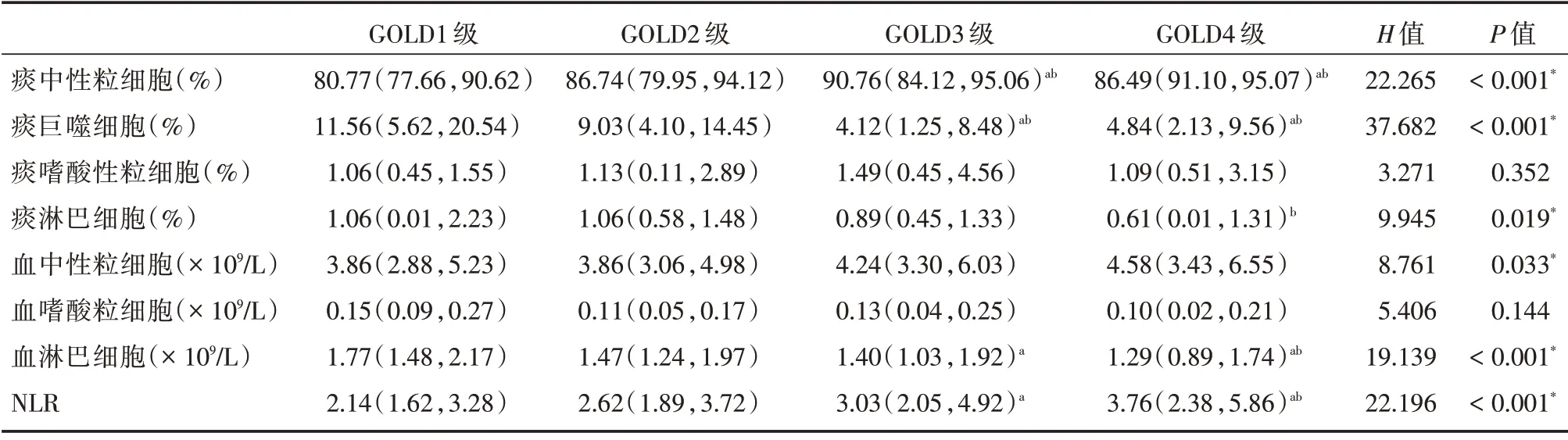
表1 GOLD 分级间炎性因子比较Tab.1 Inflammatory factors were compared between different GOLD grades M(P25,P75)
2.2 痰细胞和血细胞相关性痰嗜酸粒细胞百分数与血嗜酸粒细胞有弱相关关系(r= 0.378,P<0.001);痰中性粒细胞百分数与血中性粒细胞也有弱相关关系(r=0.234,P<0.001)。痰淋巴细胞与血淋巴细胞无关(r=-0.023,P=0.694)。
2.3 出院3 个月内再次急性加重组与未加重组比较两组间痰中性粒细胞、痰巨噬细胞百分比、血淋巴细胞数以及NLR 和肺功能指标FEV1(L)、FEV1%pred(%)、FEV1/FVC(%)差异有统计学意义(P<0.05)。出院3 个月内再次急性加重发生比率为31.9%(表2)。
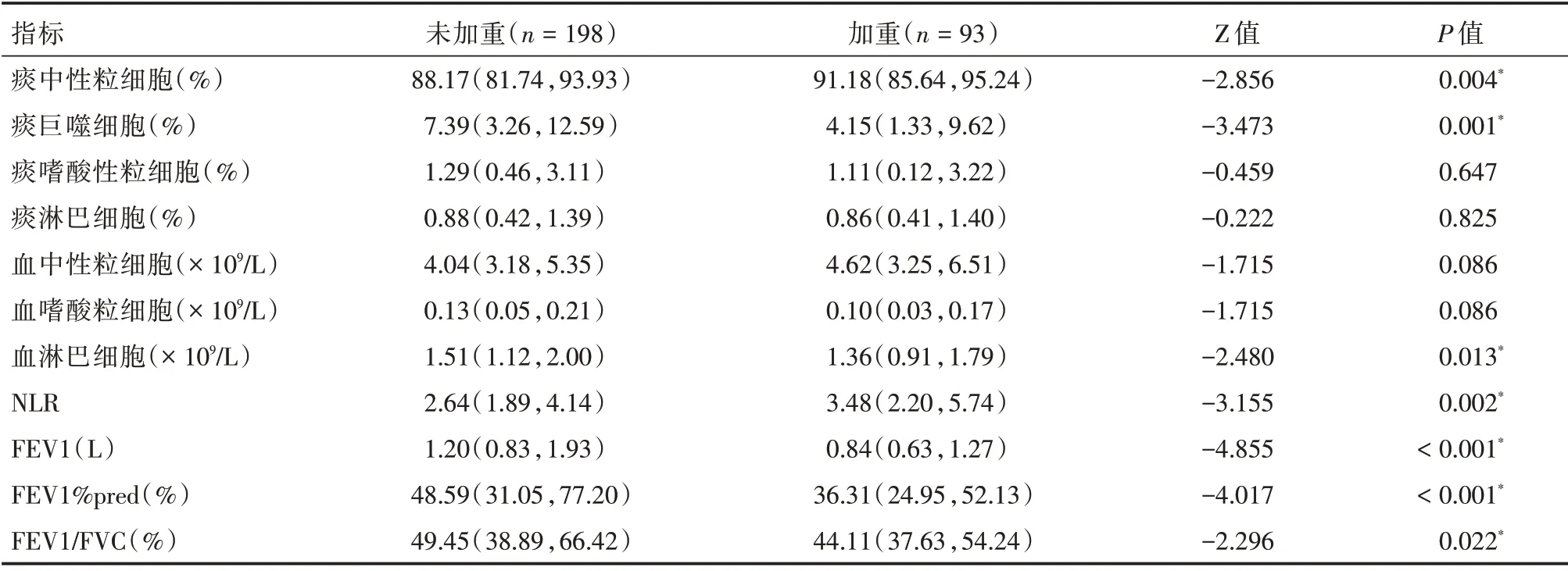
表2 出院3 个月内急性加重组和非加重组比较Tab.2 Comparison with acute exacerbation and non-exacerbation within 3 months after discharge M(P25,P75)
2.4 出院1年内再次急性加重组与未加重组比较两组间痰中性粒细胞、痰巨噬细胞百分数、血淋巴细胞数以及NLR 和肺功能指标FEV1(L)、FEV1%pred(%)、FEV1/FVC(%)差异有统计学意义(P<0.05)。出院1年内发生再次急性加重比率为54.6%(表3)。
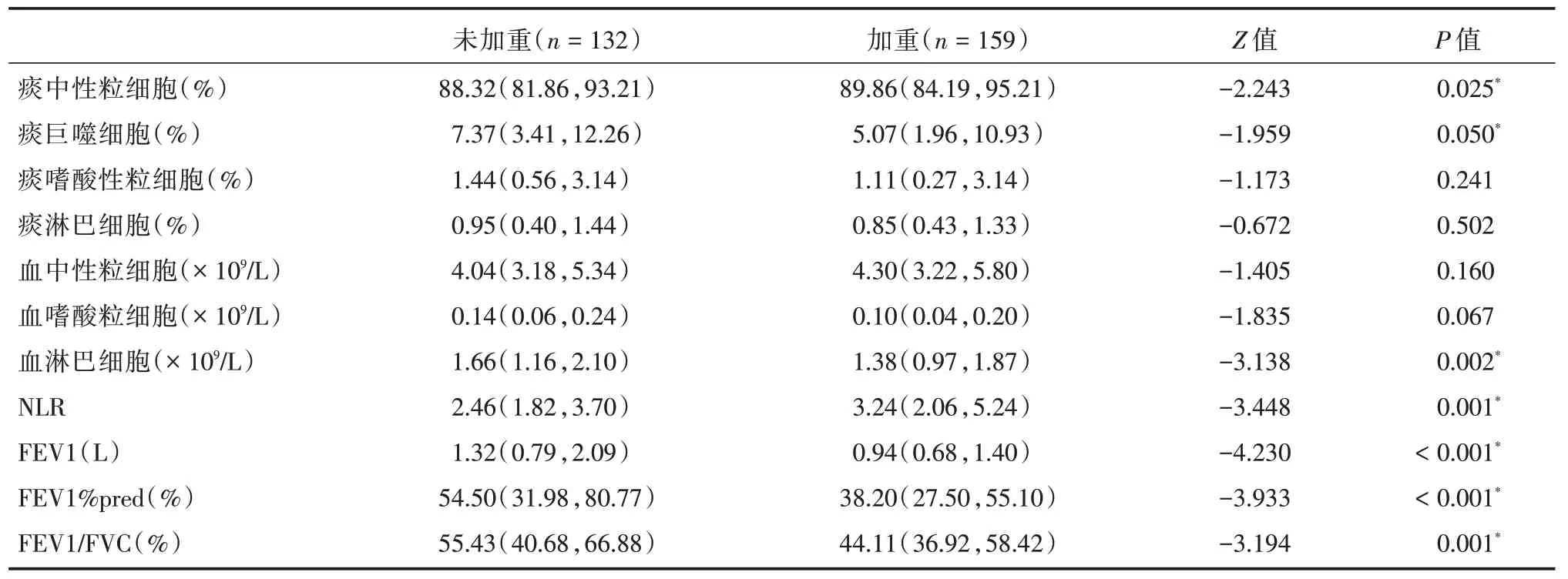
表3 出院1年内急性加重组和非加重组比较Tab.3 Comparison with acute exacerbation and non-exacerbation within 1 year after discharge M(P25,P75)
2.5 出院2年内存活患者与死亡患者比较两组间痰中性细胞、痰巨噬细胞百分比、血中性粒细胞数、血淋巴细胞数以及NLR 和肺功能指标FEV1、FEV1%pred(%)、FEV1/FVC(%)差异也有统计学意义(P<0.05)。出院2年内死亡率19.9%(表4)。
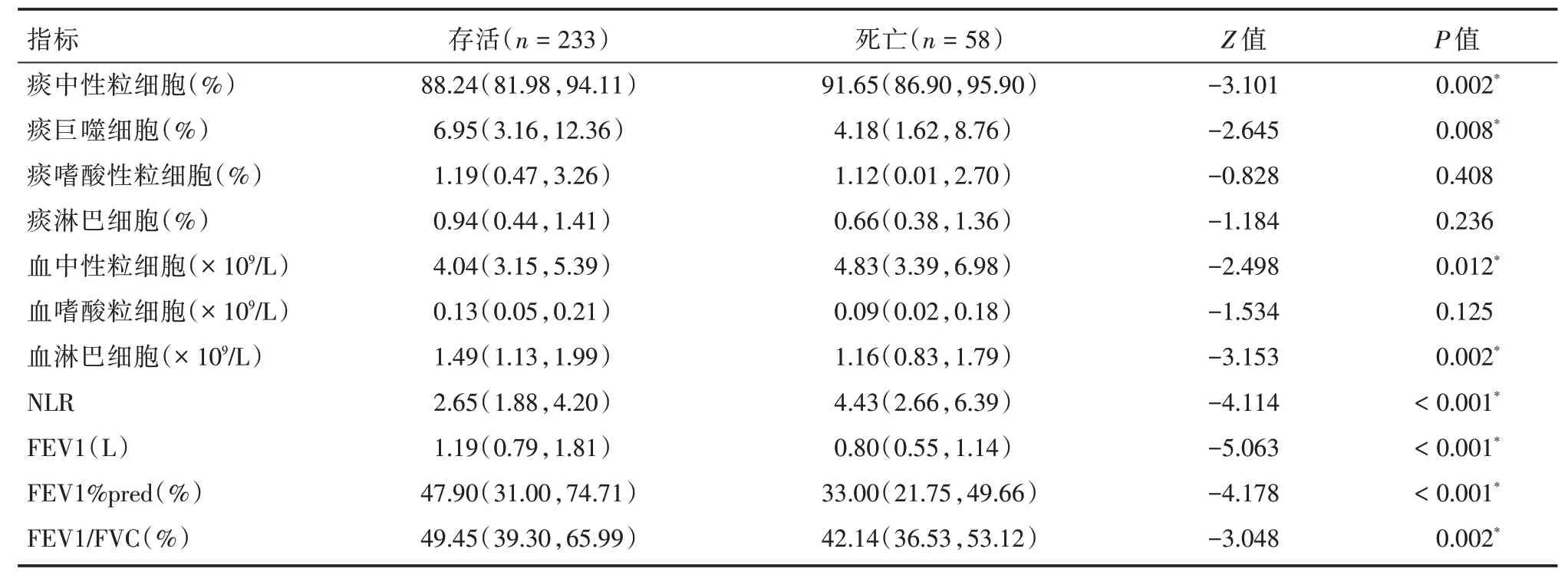
表4 出院2年内死亡组和存活组比较Tab.4 Comparison with survivor and death within 2 years after discharge M(P25,P75)
2.6 痰中性粒细胞、NLR 预测3 个月内再次发生COPD 急性加重的ROC 曲线分析痰中性粒细胞百分比的AUC 为0.605(95%CI:0.532 ~0.673,P<0.05),截断点为87.5%,灵敏度70.3%,特异度48.7%。NLR的AUC为0.616(95%CI:0.543 ~0.689,P<0.05),截断点为4.6,灵敏度40.7%,特异度82.6%(图1)。
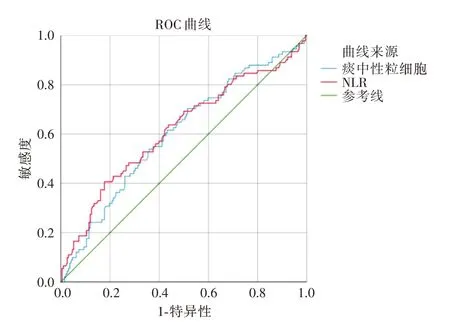
图1 痰中性粒细胞、NLR 预测3 个月内发生COPD 急性加重的ROC 曲线分析Fig.1 ROC curve for sputum neutrophils and NLR to predict exacerbation within 3 months after discharge
2.7 痰中性粒细胞、NLR 预测1年内再次发生COPD 急性加重的ROC 曲线分析痰中性粒细胞的AUC为0.576(95%CI:0.510 ~0.642,P<0.05),截断点为86.0%,灵敏度71.2%,特异度43.1%。NLR的AUC 为0.619(95%CI:0.554 ~0.683,P<0.05),截断点为2.8,灵敏度为59.6%,特异度为63.1%(图2)。
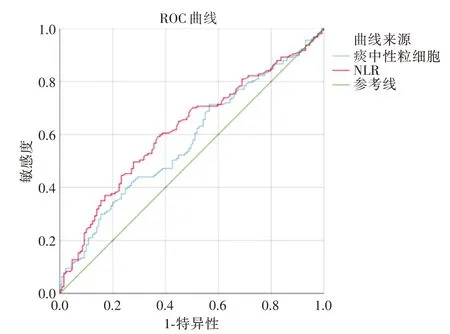
图2 痰中性粒细胞、NLR 预测1年内发生COPD 急性加重的ROC 曲线Fig.2 ROC curve for sputum neutrophils and NLR to predict exacerbation within 1 year after discharge
2.8 痰中性粒细胞、NLR 预测2年内发生死亡的ROC 曲线分析痰中性粒细胞百分比的AUC 为0.635(95%CI:0.557 ~0.712,P<0.05),截断点为90.6%,灵敏度61.4%,特异度62.0%。NLR 的AUC为0.676(95%CI:0.597 ~0.756,P<0.05),截断点为2.6,灵敏度80.7%,特异度50.2%(图3)。
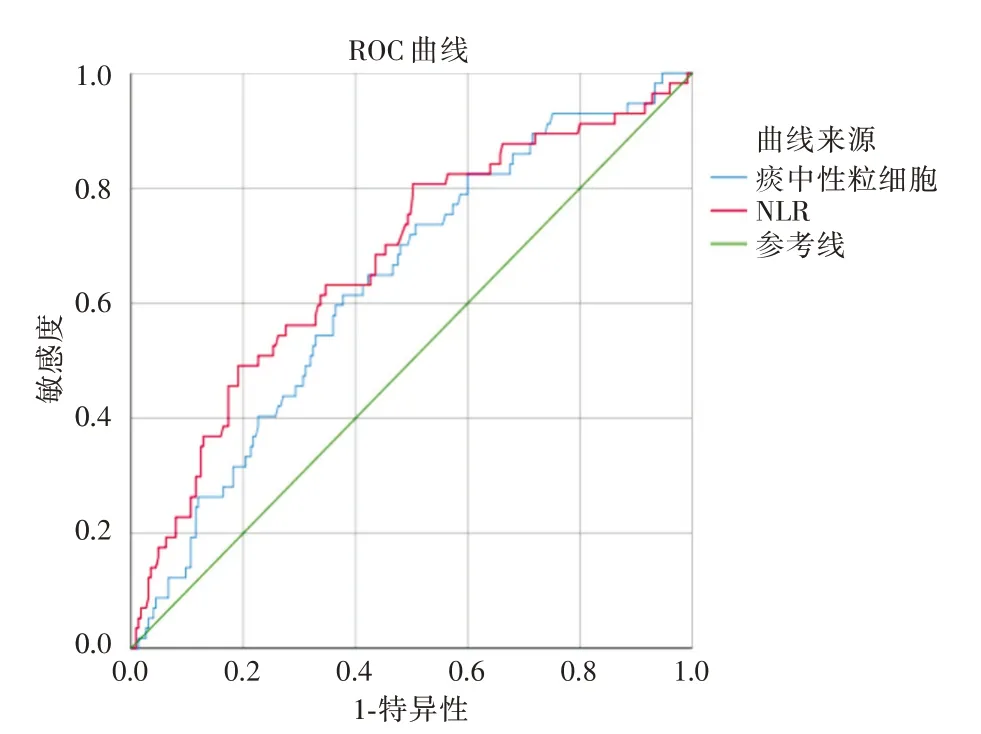
图3 痰和血中性粒细胞、NLR 预测2年内发生死亡的ROC 曲线Fig.3 ROC curve for sputum and blood neutrophils,NLR to predict death within 2 years after discharge
3 讨论
AECOPD 患者在机体感染病原体后,肺泡巨噬细胞作为机体免疫细胞,协调气道内炎症反应放大,损伤肺组织,造成疾病加重[11]。近期也有学者指出,中性粒细胞等炎症细胞释放的蛋白酶,可作为自身抗原,参与COPD 自身免疫致病机制[12]。COPD 患者的中性粒细胞与巨噬细胞通过共同产生细胞外基质降解酶导致支气管和肺实质多种病理改变,从而促进COPD 形成发展[13]。与本研究发现急性加重期痰中性粒细胞、巨噬细胞百分数与GOLD 指标同样能反应COPD 患者病情严重程度的结论相符。
本研究发现诱导痰中性粒细胞、嗜酸粒细胞百分数与血中性粒细胞、嗜酸粒细胞有相关性,但预测价值不高。单靠血嗜酸性粒细胞COPD 患者可显示微小的临床差异,与恶化没有关联,而分层痰嗜酸性粒细胞与较大的表型差异和COPD 加重有关[14-16]。重要的是,增加的血嗜酸性粒细胞并不能可靠地预测气道嗜酸性粒细胞[17-18]。血嗜酸性粒细胞在本研究死亡与存活组及出院再次发生急性加重和未发生组之间比较虽然差异无统计学意义,但也表现出明显差异。主要原因考虑本研究未将COPD 合并支气管哮喘的患者纳入研究人群,部分AECOPD 的患者入院前存在长期糖皮质激素的吸入等原因可能影响了嗜酸性粒细胞的表达,也是本研究的不足之处,有待进一步研究来验证。
血液NLR 由两种相互补充免疫细胞数值组成,其中,中性粒细胞反映特异性炎症情况,淋巴细胞反映免疫系统的调控[19],在AECOPD 患者中,机体中儿茶酚胺类产物增高,造成淋巴细胞数目的降低,从而造成NLR 值上升,因此NLR 数值在一定程度上升高可以对COPD 严重程度进行诊断和评估[20]。近年来在多种临床应用和各种疾病中得到了高度评价[21],不仅可以预测COPD 患者急性加重风险[22-23],还是COPD 患者死亡的独立预测因子[24-25]。不同研究发现的截断点略有差异,本研究发现截断点较其他研究[26-27]偏低,本研究对象虽然为单纯AECOPD 呼吸系统疾病的患者,但是我院收治患者多为外地转诊患者,病情偏重,存在其他系统合并症因素;入院前可能已经存在抗生素及糖皮质激素治疗的情况;云南地区多高海拔等因素,所以对结果可能会产生一定影响。
诱导痰检测技术和血常规检查简便、廉价、安全且[20]能真实而可靠的反映气道炎症程度[21],所以AECOPD 患者诱导痰中性粒细胞百分比以及血NLR 在指导临床治疗、评估治疗效果、评测预后等方面都具有良好的应用前景。
