3D打印人工椎体在脊柱转移瘤整块切除后脊柱稳定性重建中的应用
2022-01-03王林高嵩涛刘继军罗建平张俊娟钟楚楠张瑜哲牛科润
王林 高嵩涛 刘继军 罗建平 张俊娟 钟楚楠 张瑜哲 牛科润
河南省人民医院骨科(郑州450003)
脊柱转移瘤是脊柱最常见的肿瘤,约有30%~70%的恶性肿瘤会出现脊柱转移[1]。脊柱转移瘤可造成严重的骨质破坏,影响脊柱稳定性和脊髓的神经功能[2]。据研究[3]显示,5% ~10%的脊柱转移患者会出现脊髓及神经根的压迫症状,严重者可导致截瘫,大大影响患者的生存质量。
手术仍然是切除肿瘤组织、解除神经压迫最有效、最直接的方式。随着外科技术的不断提高,多数脊柱转移瘤病灶均能够有效切除边界,其有利于降低肿瘤局部复发率并延长患者的远期生存时间[4]。然而整块切除创伤大,切除了脊柱的骨性结构、小关节、韧带、椎间盘等,脊柱彻底失稳,需要对脊柱连续性、稳定性进行重建。传统的重建材料有自体髂骨块、人造骨柱、钛网等,但存在着融合率低、界面吸收、塌陷、移位等问题[5]。
随着3D 打印技术的发展,3D 打印植入物在骨科的应用范围不断拓展。3D 打印人工椎体具有与人体自身椎体相似的弹性模量、良好的组织相容性和机械强度、适合骨长入的微孔结构,这些均使个体化人工椎体重建脊柱转移瘤术后骨质缺损成为可能[6]。国内外对于脊柱转移瘤整块切除后使用钛网和3D 打印人工椎体重建其稳定性的对比研究鲜有报道,本研究回顾性分析我科2016年5月至2020年5月脊柱转移性肿瘤整块切除术后行3D 打印人工椎体材料和钛网材料重建患者的资料,并对两种重建材料术后疗效、并发症情况进行对比,现报告如下。
1 资料与方法
1.1 一般资料根据纳入与排除标准,选取自2016年5月至2020年5月于我院行脊柱转移性肿瘤整块切除手术的患者。纳入标准:(1)病理结果明确为脊柱转移性肿瘤;(2)出现病理性骨折或有明确脊髓压迫症状;(3)脊柱转移病灶仅累及单个椎体;(4)于我院行椎体整块切除手术治疗,并接受3D 打印人工椎体或钛网重建脊柱。排除标准:(1)临床评估患者预期寿命较短,小于6 个月[7];(2)合并其他脏器多发转移患者;(3)脊柱转移为复发病灶或累及多个椎体;(4)一般情况较差,合并严重糖尿病、肾病、心血管系统(如高血压、心梗、心律失常)、免疫系统及血液系统疾病无法耐受手术。
根据术中使用的重建材料分为两组。使用3D打印人工椎体材料重建的为观察组,共24 例患者,男14 例,女10 例,年龄45 ~72 岁,平均(55.2 ±5.3)岁;使用钛网材料重建的为对照组,共24 例患者,男13 例,女11 例,年龄42 ~75 岁,平均(52.4 ±6.2)岁。手术前对所有患者均进行了预后评估,包括Tomita 评分[8]和Tokuhashi 评分[9]。两组一般资料差异无统计学意义(P>0.05,表1)。
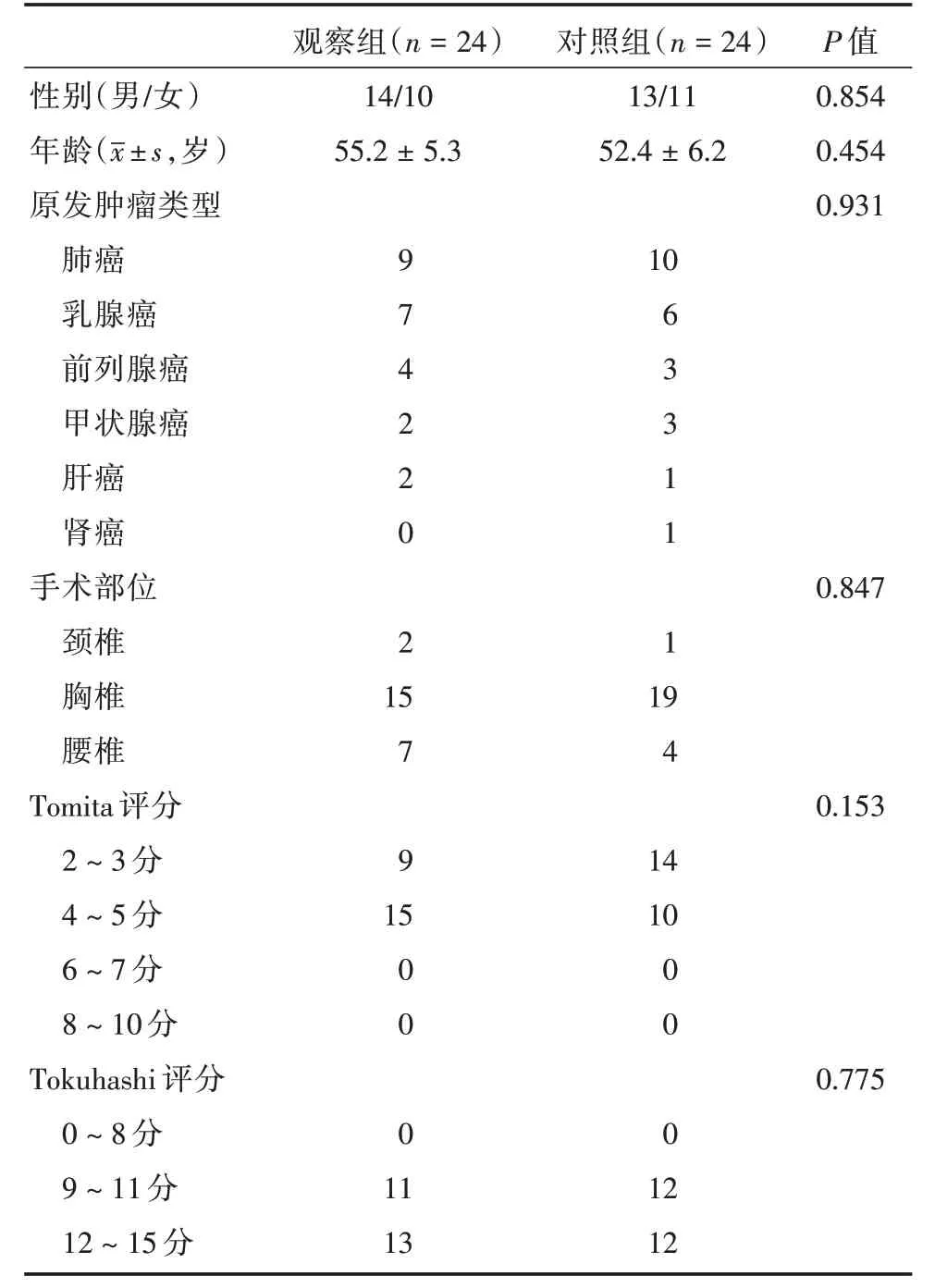
表1 两组患者一般资料对比Tab.1 Comparison of general data between the two groups例
1.2 植入材料 3D 打印人工椎体:由北京爱康宜诚医疗器材有限公司提供,材料为多孔型钛合金(金钛-6 铝-4 钒),孔隙率为80%左右,孔隙结构为(800 ± 200)μm,杨氏模量为(2.5 ± 0.2)GPa,前凸角为0/4/8 度。规格:颈椎人工椎体直径12/14 mm,高度12 ~90 mm(2 mm 递增);胸腰椎人工椎体直径12×18 mm~18×24 mm,高度25 ~120 mm(5/10 mm 递增)。钛网:由北京理贝尔生物工程研究所有限公司提供,材料为钛合金,圆柱形状,直径为12/14 mm,厚度1 mm,最大高度为100 mm。颈前路钛板螺钉系统:由北京理贝尔生物工程研究所有限公司提供,材料为钛合金,钛板长度为22 ~88 mm,螺钉直径为4/4.5 mm,长度为12 ~18 mm。胸腰椎钉棒系统:由上海锐植医疗器械有限公司提供,材料为钛合金,螺钉长度30 ~50 mm,直径为3.5 ~7.5 mm。
1.3 手术方法
1.3.1 术前栓塞术前1 周内,患者在局麻下由介入科医师行血管造影术以明确肿瘤供血情况,为减少术中出血,选择性地给予血管栓塞。为避免栓塞物脱落入颅,一般颈椎肿瘤血管不栓塞。
1.3.2 肿瘤椎体的切除以胸腰椎肿瘤为例,全身麻醉后采取俯卧位,以病椎为中心做后正中切口,长度范围包括病椎上下各两个阶段椎体,依次切开皮肤、皮下、筋膜,分离椎旁肌肉并向两侧牵开,分离软组织时注意避免进入肿瘤组织。于病椎上下两个椎体分别置入椎弓根螺钉,切除肿瘤椎体时交替连接两侧连接杆,整块切除肿瘤椎体,彻底减压脊髓及神经根,蒸馏水、化疗药物交替浸泡灭活术区,处理残留椎间盘组织,刮除上位椎体下终板软骨和下位椎体上终板软骨以准备融合界面,注意保护脊髓、神经根及椎体前方血管,严密止血。颈椎肿瘤采用平卧位,颈前路入路切除肿瘤组织。
1.3.3 重建观察组:测量缺损高度,试模安装,选择合适规格3D 打印人工椎体,制备异体骨颗粒填塞于中央植骨管道内,将人工椎体放置于缺损区并调整位置,适当加压相邻椎体保证骨-人工椎体界面紧密贴合,透视确认假体位置良好。胸腰椎肿瘤病例连接椎弓根螺钉连接杆及横联,颈椎肿瘤病例安装颈前路钛板螺钉固定(图1);对照组:取异体骨颗粒紧密填塞于修剪后的钛网内,其余步骤同观察组(图2)。
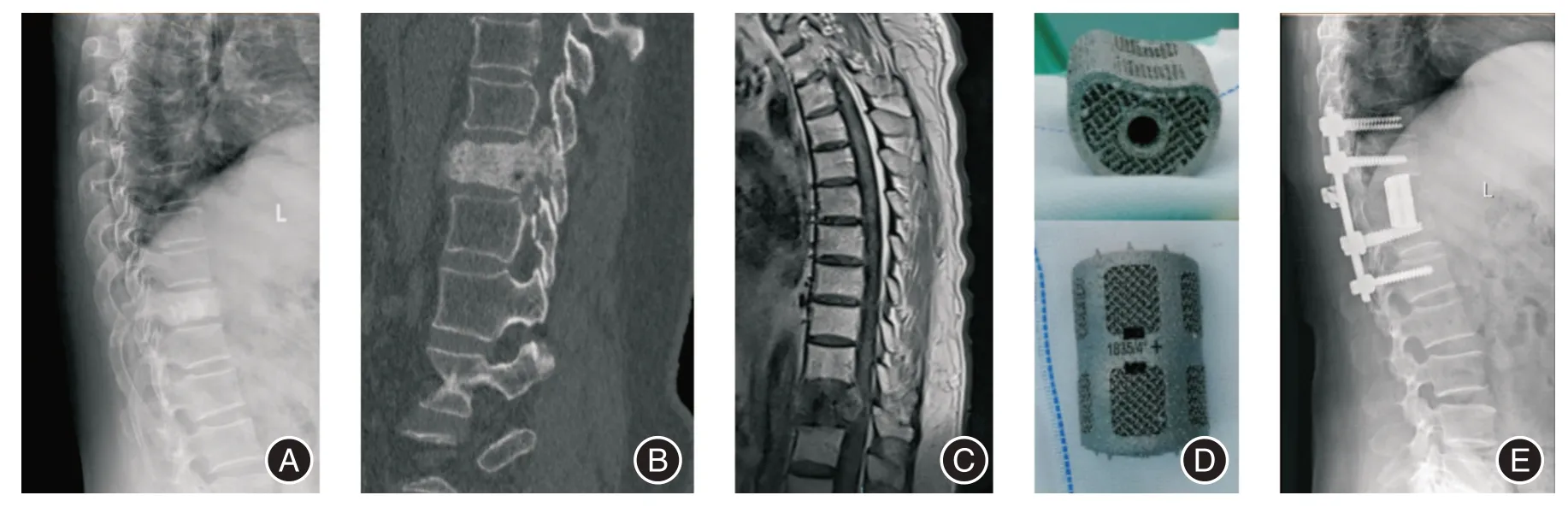
图1 胸椎转移瘤整块切除并3D 打印人工椎体重建Fig.1 Thoracic metastases were resected en bloc and reconstructed with 3D printing artificial vertebral body
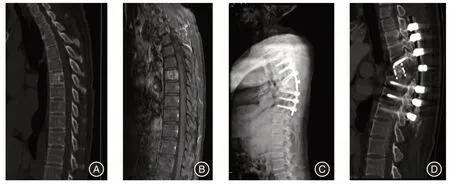
图2 胸椎转移瘤整块切除并钛网重建Fig.2 Thoracic metastases were resected and reconstructed with titanium mesh
1.4 术后处理肿瘤标本送常规病理,明确原发肿瘤类型。术后常规卧床,指导双下肢功能锻炼,给予预防感染、消肿、止痛等药物应用,术后1 周内给予甲泼尼龙静脉输液以减轻脊髓、神经根水肿。引流量24 h 少于20 mL 时拔除引流管。切口愈合并拆线2 周后开始原发肿瘤的内科治疗。
1.5 疗效评价标准
1.5.1 一般指标记录患者手术时间(从皮肤切开到皮肤缝合完毕)、出血量(纱布估计出血量+吸引器瓶内液体量-术区冲洗量)。
1.5.2 疼痛评价采用疼痛视觉模拟评分(visual analogue scale,VAS)系统于患者术前、术后1 周对疼痛程度进行评估,并计算缓解度,缓解度=(术后1 周评分-术前评分)/术前评分×100%[10]。
1.5.3 神经功能评价采用JOA(Japanese Orthopaedic Association Scores)评分系统对患者脊髓功能评分,并计算术后1 周、3 个月、6 个月、末次随访时的改善率,改善率=(随访时评分-术前评分)/(17-术前评分)×100%[11]。
1.5.4 术后椎体融合情况6个月后行脊柱X线及
CT 检查,评估人工椎体或钛网与相邻椎体整合情况,具体评估标准如下:(1)确定融合,影像学检查观察到骨重塑,人工椎体或钛网与上下临近终板骨界面处有骨小梁穿过;(2)可能融合,人工椎体或钛网完整,但与邻近椎体未完全重塑和整合,无明显放射透亮带;(3)可能不融合,人工椎体或钛网完整,但与邻近椎体间有明显放射透亮带;(4)确定不融合,人工椎体或钛网断裂、移位或下陷[12]。
1.5.5 沉降情况及稳定性评价由融合节段的高度及曲度变化作为评价指标,通过脊柱X 线侧位片测量术后1 周、3 个月、6 个月、末次随访时融合节段椎体前缘高度(height of anterior bone,HAB)、椎体后缘高度(height of posterior bone,HPB)和cobb 角数值,并计算其与术后1 周(等同于术后即刻)的差值[13]。
1.6 统计学方法采用SPSS 24.0(IBM,美国)统计软件包进行统计分析,计量资料用均值±标准差表示,两组间比较统计分析采用两独立样本t检验,同一组内不同时间点间计量资料的比较采用配对样本t检验;两组间计数资料的统计分析采用卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 一般指标手术时间:观察组(322±42)min,对照组(355 ± 30)min,观察组手术用时少于对照组,差异有统计学意义(P= 0.003);术中出血量:观察组(2 229±231)mL,对照组(2 420±273)mL,观察组术中出血量少于对照组,差异有统计学意义(P=0.012)。
2.2 疼痛评价VAS 评分:观察组由术前(7.4 ±1.4)分降至术后(2.2±0.8)分,对照组由术前(6.8±1.1)分降至术后(2.4 ± 1.0)分,两组患者术后VAS评分均较术前明显下降(P<0.001)。观察组疼痛缓解度(70.4 ± 11.5)%,对照组疼痛缓解度(65.8 ±11.2)%,差异无统计学意义(P=0.164)。
2.3 神经功能评价两组患者术前JOA、术后1 周JOA 评分及改善率差异无统计学意义,术后3、6 个月、末次随访JOA 评分及改善率观察组均高于对照组,差异有统计学意义(P<0.05)。见表2。
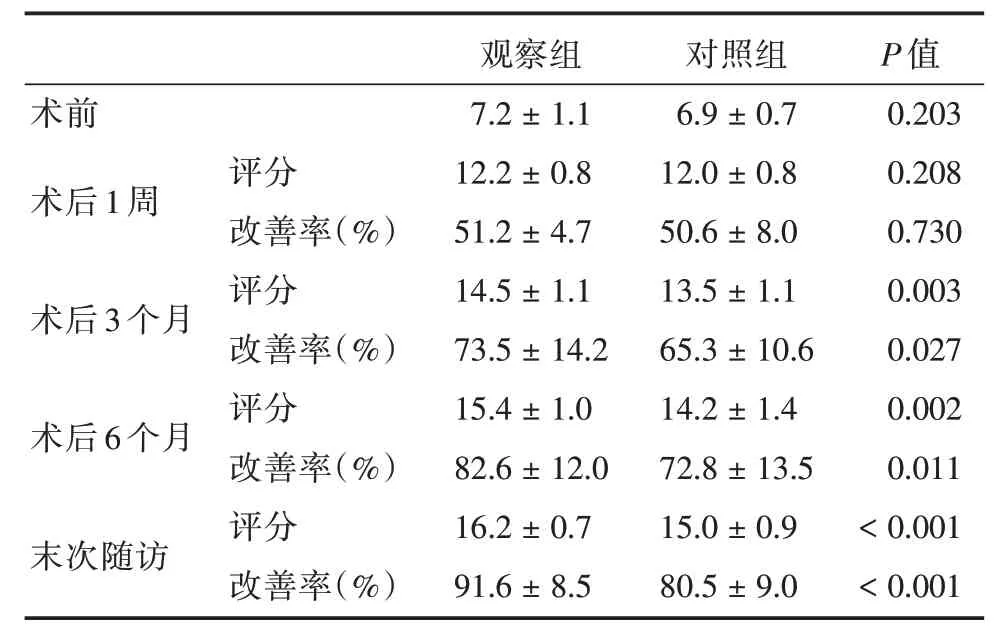
表2 两组患者JOA 评分及改善率Tab.2 JOA score and improvement rate of two groups x±s
2.4 术后并发症48例患者随访时间为10 ~45个月(平均20.4 个月),所有患者术中无脊髓或大血管损伤或排异反应出现。观察组与对照组术后出现脑脊液漏各2 例,改变体位、延迟拔管后均顺利愈合;观察组1 例胸7 椎体转移瘤患者术后出现切口浅表感染,加强换药、延长敏感抗生素应用后顺利愈合,对照组1 例肺癌并胸4 椎体转移瘤患者术中出现胸膜破裂,术后肺部感染,转ICU 治疗后感染得到有效控制。
2.5 术后椎体融合情况两组患者植入物与相邻椎体融合情况见表3,两组融合情况差异有统计学意义(P=0.020)。
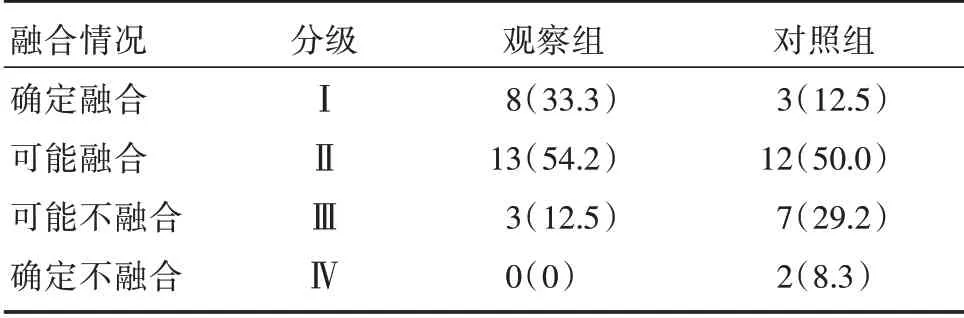
表3 两组患者植入物与相邻椎体融合情况Tab.3 Fusion of implants and adjacent vertebral bodies in two groups 例(%)
2.6 沉降情况及稳定性评价术后3、6 个月及末次随访时,观察组HAB、HPB 及cobb 角度的减小值均小于对照组,差异有统计学意义(表4)。
表4 两组患者沉降高度及曲度变化Tab.4 Changes of settlement height and curvature in two groups ±s
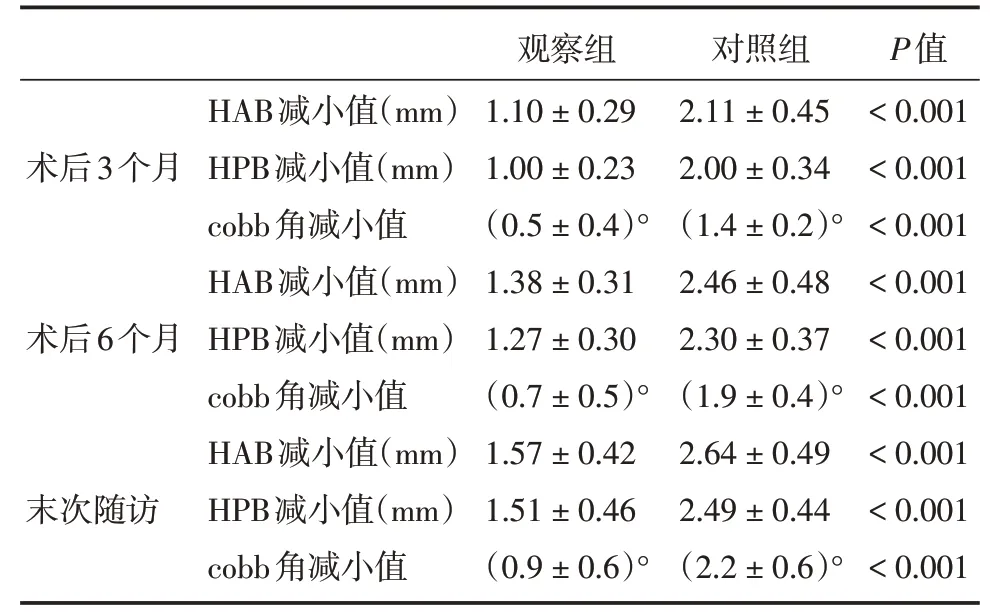
表4 两组患者沉降高度及曲度变化Tab.4 Changes of settlement height and curvature in two groups ±s
注:减小值均为与术后1 周的差值
术后3个月术后6个月末次随访HAB减小值(mm)HPB减小值(mm)cobb角减小值HAB减小值(mm)HPB减小值(mm)cobb角减小值HAB减小值(mm)HPB减小值(mm)cobb角减小值观察组1.10±0.29 1.00±0.23(0.5±0.4)°1.38±0.31 1.27±0.30(0.7±0.5)°1.57±0.42 1.51±0.46(0.9±0.6)°对照组2.11±0.45 2.00±0.34(1.4±0.2)°2.46±0.48 2.30±0.37(1.9±0.4)°2.64±0.49 2.49±0.44(2.2±0.6)°P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001
3 讨论
随着恶性肿瘤临床治疗效果的提高,大约有70%的恶性肿瘤患者会出现脊柱转移[14]。脊柱转移性肿瘤手术成功的关键在于周密的术前规划、术中彻底切除肿瘤以及重建脊柱的稳定性[15]。手术切除脊柱转移瘤后能否有效重建,其中一个重要因素就是重建材料的选择。传统的重建材料包括自体髂骨块、异体骨或人造骨柱,以及各种金属重建材料如钛网、人工椎体等。自体髂骨取材方便、价格低、融合率高,但自体髂骨取材后可导致供区感染、血肿、疼痛和感觉障碍等并发症[16]。异体骨或人造骨柱同样存在排异、融合率低、弹性模量不匹配等缺点[17]。钛合金由于其良好的生物相容性、高强度和耐腐蚀的特点已经被广泛应用于椎体切除后的重建。然而,钛网由于其与相邻椎体接触面积较小,弹性模量较高,其术后并发症如钛网沉降、移位以及不融合等并不罕见[18]。
近年来随着数字化技术在骨科的广泛应用,3D 打印为脊柱转移瘤切除术后重建带来了新的选择方案,其具有更好的个体化设计,与相邻椎体解剖形态匹配良好,生物稳定性强,但有关其与钛网在脊柱转移瘤切除术后重建的对比研究较少。本研究对脊柱转移性肿瘤切除术后行3D 打印人工椎体材料和钛网材料重建患者的临床资料进行了对比分析,发现3D 打印人工椎体组手术时间和术中出血量均小于钛网组(P= 0.003 和P= 0.012)。手术操作中需要经历撑开相邻椎体-测量高度-植入重建物-加压的过程,因此手工截取相应长度钛网存在因测量导致的误差,而3D 打印人工椎体可以根据术前测量预先制备相应高度的假体,与真实缺损高度误差较小;且钛网和3D 打印人工椎体生产工艺存在区别,钛网需要反复修剪并测试与相邻终板的契合度,3D 打印椎体上下缘的弧形或斜坡形设计能更好地与邻近终板吻合,大大降低了安装的难度和时间[19],同时减少了术中的出血量。
为了评估3D 打印人工椎体和钛网在脊柱转移瘤术后解剖和功能重建的差异,本研究对两组术后椎体融合情况、沉降情况及稳定性评价进行了评估。结果显示,术后6 个月,3D 打印人工椎体组总体融合率为87.5%,钛网组总体融合率为62.5%,两组融合情况差异有统计学意义(P= 0.020)。术后3、6 个月及末次随访3D 打印人工椎体组塌陷速度均小于钛网组,生理曲度恢复速度大于钛网组,差异有统计学意义(P<0.05)。YOSHIOKA 等[20]对47 例食管癌脊柱转移患者行全椎体切除术并钛网植骨重建,其研究发现30 例患者(63.8%)发生下陷,其中22例术后1个月CT即发现下陷。钛网与终板因无法完全契合易导致应力不均、局部点状压强过大,不仅容易高度丢失且延长愈合时间。3D 打印人工椎体与相邻终板吻合度高、接触面积大,有利于分散承重力量,进而降低塌陷率。且3D 打印人工椎体的海绵状微孔结构更接近于人体骨组织中的哈氏管,更易于骨长入,有利于提高愈合率、降低愈合时间[21]。而术后脊髓神经功能的恢复有赖于椎体高度的维持和曲度的恢复,这也解释了本研究中虽然术后1 周JOA 评分及缓解率两组无明显差异,但是术后3、6 个月及末次随访时3D 打印人工椎体组JOA 评分及改善率均高于钛网组。
本研究仍存在一定的不足:(1)随访时间较短,未对患者术后肿瘤控制率、生存时间和预后影响因素进行相关统计;(2)随访病例较少且仅为单中心研究,之后需要扩充样本量并联合多中心研究;(3)影像学检查中因存在金属伪影导致测量存在一定偏差,因此尚需要优化影像技术及测量精度。
综上所述,3D 打印人工椎体作为脊柱转移瘤切除术后重建材料,能降低手术时间、减少术中出血,且不易出现假体下沉并发症,能更好地维持脊柱高度和曲度,提高总体融合率,在脊柱转移瘤的手术治疗中有较好的临床效果。
