脊柱肿瘤手术术中神经生理监测信号改善的临床意义
2022-01-01牛慧霞王玉强刘屹林刘宏建王利民
牛慧霞,王玉强,吴 恺,刘屹林,刘宏建,王利民
(郑州大学第一附属医院,河南 郑州 450052)
虽然一些神经并发症在手术过程中可能没有任何可识别的不良事件发生,但是脊柱手术尤其是脊柱肿瘤手术术后神经功能的缺损将是一个毁灭性的并发症[1-3]。为降低神经损伤等并发症的发生率,近年来术中多模式神经生理监测(intraoperative neurophysiological monitoring,IONM),包括体感诱发电位(somatosensory-evoked potentials,SSEPs)、运动诱发电位(motor-evoked potentials,MEPs)和肌电图已被广泛应用,并已被证明是预防脊柱手术中神经损伤的有效方法[4-6]。SSEPs用于监测脊柱功能,MEPs用于监测包括皮质脊髓束在内的脊髓前部和中央部分的功能。自引入IONM以来,大多数研究都将信号丢失作为提示神经损伤的警报信号,这可能预测术后神经功能恶化;很少有研究探讨手术中IONM信号改善的临床意义[7-8]。本研究回顾性分析了脊柱肿瘤患者IONM信号改善的病例,以确定改善的信号是否与术后的神经功能状态相关。
1 资料与方法
1.1 一般资料回顾性分析2017年4月至2019年10月期间在郑州大学第一附属医院手术治疗的脊柱肿瘤患者206例,其中男119例、女87例,年龄18~74(43.76±4.21)岁。颈椎肿瘤79例,胸椎肿瘤107例,腰骶椎肿瘤20例。脊柱原发性肿瘤84例,继发性肿瘤122例。其中合并神经功能障碍者138例。所有患者及其家属均知情同意并签属知情同意书,且本研究已通过医院医学伦理委员会审核批准。
1.2 方法对行脊柱肿瘤手术的患者应用多模式IONM时,从患者被放置在手术台上到患者从麻醉中醒来,我们对患者的上下肢均进行了一系列的监测。刺激胫后神经和正中神经诱发SSEPs,通过连接在标准头部位置的皮下针电极记录皮质电位。经颅刺激来自上肢的双侧三角肌、肱三头肌和大鱼际肌肉,来自下肢的双侧胫骨前肌和足拇外展肌记录MEPs。在监测MEPs的相同部位记录自发肌电图。根据需要对每例患者的刺激幅度进行调整。患者的生命体征及动脉血氧饱和度均维持在正常范围内,体温维持在33.2~36.4 ℃[9]。IONM数据全面记录手术操作过程中诱发放电的基线和波形变化。
1.3 观察指标及评价标准MEPs显著改善:定义为术中振幅或可辨别波形的外观增加大于100%,SSEPs显著改善定义为振幅增加大于100%或潜伏期减少至少6%[10]。神经和临床结果评估:在定期门诊随访期间,获得术前和术后的神经系统评估和患者临床结果的问卷,选择术前和术后1 a的资料。采用运动指数评分系统(motor index scoring system,MISS)评估肌肉力量[11]。采用自述式问卷健康调查简表-36(short-form 36 health survey questionnaire,SF-36)对所有患者的主观症状的恢复情况进行评估[12];采用日本骨科协会颈脊髓病评分(Japanese Orthopedic Association for cervical myelopathy score,JOACMS)和颈功能障碍指数(neck disability index,NDI)对颈椎肿瘤伴神经功能障碍的患者进行评价[13-14];采用获得日本骨科协会(Japanese Orthopedic Association,JOA)下腰痛评分(low back pain scores,LBPS)对胸椎肿瘤或腰骶椎肿瘤伴神经功能障碍的患者进行评估[15](由于本组病例腰骶椎患者较少,将胸椎肿瘤和腰骶椎肿瘤患者合并在一起进行评估)。
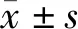
2 结果
2.1 20例脊柱肿瘤患者的一般情况分析206例脊柱肿瘤患者中除外2例1 a内死于与脊柱肿瘤无关的疾病,共31例患者术中IONM信号(MEPs或SSEPs)出现明显改善并随访至少1 a,且所有患者术前均存在明显的神经功能障碍。男20例,女11例;年龄29~68(49.37±6.54)岁。其中颈椎肿瘤12例(包括1例枕颈区神经源性肿瘤),胸椎肿瘤15例,腰骶椎肿瘤4例。MEPs和SSEPs信号均有改善者8例,仅MEPs信号有改善者11例,仅SSEPs信号有改善者12例。MEPs振幅增加超过100%的患者中,有3例在手术过程中产生多相波形。13例患者SSEPs振幅升高超过100%,7例患者潜伏期减少≥6%。
2.2 手术前后神经功能和主观症状的数据比较IONM信号明显改善患者术前的MISS评分(87.68±13.95)分增加到术后的(94.47±9.12)分(t=5.976,P=0.023)。SF-36评分由术前的(101.33±9.82)分增加到术后的(111.68±9.73)分(t=6.742,P=0.017)。与术前相比,12例颈椎肿瘤患者的JOACMS评分明显提高[(8.23±42.57)分和(14.37±47.59)分;t=14.396,P=0.004],而NDI评分则明显下降[(40.62±8.28)分和(22.96±7.55)分;t=19.417,P<0.001]。19例胸椎及腰骶椎肿瘤患者的LBPS评分由术前的(14.73±3.26)分升高至术后的(25.14±4.29)分(t=17.528,P<0.001)。结果提示,IONM信号改善患者的神经功能和主观症状均有显著改善,随访期内无一例患者出现术后神经功能的恶化。
3 讨论
脊柱肿瘤患者往往因瘤体压迫脊髓或马尾而产生神经功能障碍[16]。临床上尚缺乏针对脊髓或马尾神经减压术后的预后指南,这使得外科医生难以预测患者神经减压术后的神经功能恢复情况[17]。许多因素影响颈、胸脊髓疾患减压术后的神经功能恢复。先前的研究已经表明,患者的年龄、性别、症状持续时间、术前JOACMS得分、脊髓诱发电位的类型、手术持续时间、脊髓的髓内信号变化等均会对手术结果和预后产生影响[18-19]。此外,即使在手术中没有观察到不良事件,术后也可能发生神经功能障碍[1-3]。本研究回顾性分析了206例脊柱肿瘤患者,发现其中31例患者IONM信号有显著改善。我们使用客观的MISS系统来评估每例患者的肌肉力量情况,并使用SF-36评分来评估主观症状。所有患者术后神经系统状况均未见恶化。术后神经功能和主观症状(MISS、SF-36、JOACMS、NDI、LBPS)均有明显改善。虽然先前的研究中也发现了类似的IONM情况[9,20],但除了比较术前和术后的神经状态外,我们还评估了主观症状和整体功能,使用了已证实对不同病变节段(颈椎或胸腰椎)有效和可靠的各种系统(JOACMS、NDI、LBPS)评分。因此,本研究提供了一个比先前研究更客观的临床症状和神经系统状况的评估。我们的研究结果表明:IONM信号的改善伴随着良好的手术结果,并间接地提供了坚实的证据提示手术期间没有不良事件的发生。通过分析IONM数据的变化将提高脊柱外科医生预测脊柱肿瘤患者术后临床结果的能力。
研究表明,多种因素可以影响IONM的信号[4-6],如果IONM信号发生变化,则应考虑术中神经受到刺激,损伤或解除了机械性的压迫[7-8,21]。缺血损伤可使MEPs或SSEPs振幅降低;机械性损伤可延迟SSEPs潜伏期,使SSEPs振幅降低;血压、体温和氧合也会影响IONM信号,当体温低于28 ℃或高于42 ℃时,诱发电位会恶化,有研究认为诱发电位应在基线温度上下2~2.5 ℃范围内进行;低氧合血和血压的突然下降可能引起SSEPs电位的变化;此外,IONM的技术或操作问题也可能影响信号[4-6,9,21]。虽然本研究包括各种诊断(原发性或继发性肿瘤)的患者,但是所有的病因都涉及神经组织的机械压迫(即颈、胸脊髓或马尾)。直接机械压迫神经组织及其血液供应被认为会导致神经损伤[20-21]。在我们的研究中,31例患者在进行脊髓或马尾减压手术后IONM信号都得到了改善。其他潜在的影响信号的因素在本研究的IONM方案中得到了控制,生命体征及动脉血氧饱和度均维持在正常范围内,体温维持在33.2~36.4 ℃,IONM的操作由经验丰富的神经电生理专家执行,并且使用一致和可重复的神经监测技术。因此,我们有理由认为其他可能的解释可以被排除,通过手术减压缓解机械压迫可以改善神经传导,进而获得良好的临床结果。
尽管如此,我们的研究还是有一些局限性。首先,回顾性设计可能被认为是较低质量的研究设计;其次,我们的样本量相对较小,只包括4例腰骶椎病变的患者;此外,我们没有比较术中信号改善的患者和信号没有改变或恶化的患者的临床结果;最后,我们没有对手术节段、手术时间和出血量等进一步进行分组研究。今后,需要更多的更大样本的研究来支持本研究的结果,并进一步确定IONM信号改善与术前临床神经异常(如锥体束损害)之间的相关性。
综上所述,我们确定了脊柱肿瘤患者术中IONM信号显著改善的病例,并评估了术中信号改善与临床结果之间的相关性。IONM信号的改善是神经系统预后良好的一个预测因子,特别是对于脊髓减压手术。基于目前的研究结果,我们相信在IONM信号改善的情况下可以排除术中神经损伤,并且术后神经功能可望改善。因此,我们建议脊柱外科医生将术中IONM信号的改善作为神经组织减压成功的标志。
