水解度对牡丹籽蛋白肽乳状液稳定性的影响
2021-12-31张谨华杨万明苏艳玲周哲峰
张谨华,杨万明,苏艳玲,周哲峰
晋中学院生物科学与技术系(晋中 030600)
水包油型乳状液在大多数食品的加工、配方和感官特性中起着关键作用。乳状液往往会受到几个机制的影响产生物理不稳定状态,包括分散液滴的絮凝、聚集和聚结等。此外,乳状液在乳化成小液滴之后,会增加脂滴的界面面积,这就增加了与氧分子和过渡金属的接触。水解的蛋白在乳状液中不仅能将乳状液乳化成小分子的液滴,减小乳化液滴的粒径,还能够通过终止自由基链式反应、螯合金属离子对抗油脂的氧化,稳定油滴对聚结或絮凝的作用,有助于形成稳定的乳状液[1]。一般认为,蛋白质稳定乳液的物理不稳定性(如聚结)与油水界面上蛋白质膜的性质(如形成具有高弹性模量的紧密黏弹性和相互连接的网络)之间存在明显联系。
牡丹因其优异的观赏价值和品种选择而成为世界范围内的商品植物。牡丹籽粕是榨油后的副产品,仅作为饲料和有机肥使用,附加值较低。牡丹籽粕蛋白质含量较高,是一种营养健康的植物蛋白,在食品工业中可作为食品原料和功能蛋白的替代来源。牡丹籽蛋白营养价值高,能作为乳化剂提供物理稳定性而常被用于水包油型食品中。牡丹籽蛋白水解物能够作为牡丹籽蛋白的替代品,拥有更好的功能特性。酶解是一种特别有吸引力的蛋白质修饰技术,因为所需的工艺条件较温和,控制反应相对容易,副产物形成最少。肽键的断裂导致自由氨基和羧基的浓度增加,从而增加溶解度[2]。与天然蛋白质相比,低水解度或高水解度的蛋白水解物具有较差的乳化能力,而具有中间水解度的蛋白水解物具有更好的乳化能力。对蛋白进行重度水解能够产生较多的游离氨基酸和小分子的多肽,使得蛋白质具有较强的抗氧化活性,但此时蛋白质已丧失原有的乳化特性[3]。因此,水解度影响着蛋白质的功能特性。试验采用碱性蛋白酶对牡丹籽蛋白水解1,2,3和4 h,并研究水解度对牡丹籽蛋白水解物制备乳状液的物理稳定性。
1 材料与方法
1.1 材料
牡丹籽蛋白(杭州景杰生物科技股份有限公司);碱性蛋白酶(丹麦Novo公司);大豆油(山东万得福实业集团有限公司);十二烷基硫酸钠(美国Sigma公司)。
1.2 仪器与设备
T18匀浆机(德国IKA公司);马尔文Nano ZS动态光散射仪(马尔文仪器有限公司)。
1.3 试验方法
1.3.1 牡丹籽蛋白水解物的制备
将牡丹籽蛋白配制成质量分数4%的溶液,在95℃下加热5 min,用碱性蛋白酶(酶活2.4 AU/g)在pH 8.0,55 ℃水浴中分别水解1,2,3和4 h,水解过程中始终保持pH不变。酶与底物浓度的质量比1∶100。水解结束后,调至pH 7.0,于95 ℃灭酶5 min,水解物在9 000 r/min下离心10 min,上清液冻干备用。
1.3.2 乳状液的制备
将质量分数10%的大豆油和质量分数90%的牡丹籽蛋白水解物混合,在13 500 r/min下匀浆2 min后,在40 MPa高压下均质2次。
1.3.3 水解度的测定

式中:h为水解液中的肽键数,mmol/g;htot为蛋白质中肽键总数,mmol/g;V为水解所消耗碱量,mL;Nb为碱浓度,mol/L;MP为水解液中蛋白质质量,g;1/α为校正系数。
1.3.4 溶解度的测定
将牡丹籽蛋白水解物在5 000 r/min下离心15 min,测定上清液中的蛋白含量。上清液的蛋白含量与总蛋白含量所得比值即为蛋白溶解度。
1.3.5 乳化活性和乳化稳定性的测定
取50 μL新制备的乳状液加入到5 mL体积分数0.1%十二烷基硫酸钠中充分混匀,在500 nm下测定吸光度。乳化活性为新制备乳状液在500 nm下的吸光度,用A500表示。乳化稳定性按式(3)计算。

式中:A0为乳状液静置0 h在500 nm下的吸光度;A12为乳状液静置12 h后500 nm下的吸光度。
1.3.6 粒径和电势的测定
取50 μL乳状液加入到5 mL超纯水中混匀,在室温下测定乳状液的粒径和电势。
1.4 统计分析
每个试验重复操作3次,结果以平均值±标准差的形式表示。采用IBM Spass statistics 25和Orign 2018进行数据统计分析与差异显著性分析。
2 结果与分析
2.1 牡丹籽蛋白水解物的水解度和溶解度
由表1可知:酶解蛋白质的水解时间与水解度呈正比例关系,随着水解时间增加,水解度显著增加(p<0.05)。水解前的加热处理能够打开蛋白质的内部结构,这让氨基酸残基得以足够表露,能够使水解变得更加完全[4]。随着水解的进行,溶解度呈现显著增加的变化趋势(p<0.05),牡丹籽蛋白通常以高度聚集的形式存在,导致其溶解性差且分散性差。水解所得到的小肽比非水解蛋白中多肽的极性更强,能与水形成较强的氢键,从而更易溶于水溶液。预热处理使蛋白容易产生聚合物,使其在后续的水解中依然存在一部分并未得到完全溶解,并且在最终阶段蛋白酶会与暴露出的疏水基团反应,引发基团的进一步暴露[5]。

表1 牡丹籽蛋白水解物的水解度和溶解度
2.2 水解度对牡丹籽蛋白水解物制备乳状液乳化活性和乳化稳定性的影响
表2结果表明:随着水解度的增加,乳状液的乳化活性和乳化稳定性呈现先上升后下降趋势(p<0.05)。水解度为10.91%时,油滴在乳状液中分散得更好,体系表现出更高的乳化活性。蛋白质经过水解后,蛋白质的分子特性发生改变,如分子量变小,亲水和疏水基团的数量和位置发生改变。牡丹籽蛋白水解物通过吸附在界面上并筛选油水分子间的不利相互作用来降低界面张力,并且能够吸附在油和水的界面上,使乳状液达到均一、稳定的状态。水解度超过10.91%时,过度水解使暴露出来的疏水位点遭到破坏或是蛋白质之间的聚集物会掩盖一部分的疏水位点,致使表面疏水性降低,蛋白质的乳化活性降低,乳状液的乳化稳定性降低[6]。
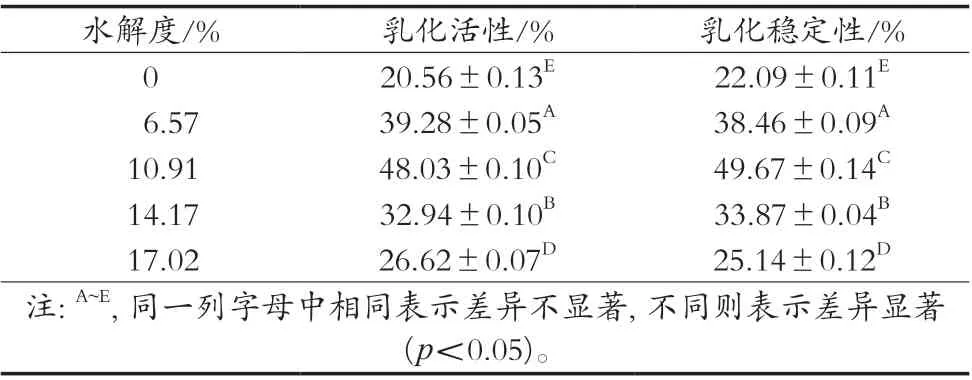
表2 水解度对牡丹籽蛋白水解物制备乳状液乳化活性和乳化稳定性的影响
2.3 水解度对牡丹籽蛋白水解物制备乳状液粒径的影响
如图1所示:随着水解度增加,由牡丹籽蛋白水解物制备乳状液的粒径呈现先降低后增加趋势(p<0.05);水解度为10.91%时,乳状液的粒径最小。这是由于随着水解度增加,水解会使多肽链增加,牡丹籽蛋白的分子构象发生改变,降低油水界面张力,从而使牡丹籽蛋白水解物的乳化性增强。蛋白质分子间和分子内的非共价相互作用(例如氢键、疏水相互作用)减弱,导致蛋白质变性以及蛋白质聚集体的解离[7]。在碱性蛋白酶作用下,蛋白质结构的断裂会更加均匀,这有助于聚集蛋白质颗粒的逐渐破碎和其尺寸的减小。然而,水解度超过10.91%时,过度水解破坏了牡丹籽蛋白内部的氢键、离子键和范德华力等,破坏蛋白质本身的乳化性,导致乳状液发生聚集和凝结等现象。
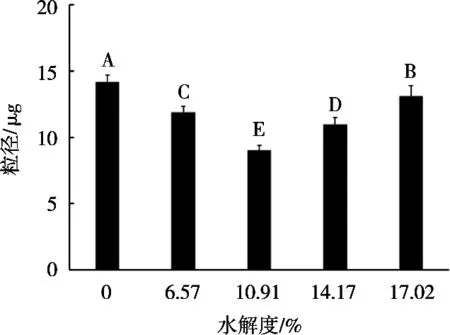
图1 水解度对牡丹籽蛋白水解物制备乳状液粒径的影响
2.4 水解度对牡丹籽蛋白水解物制备乳状液ζ-电势值的影响
图2表明:水解度对牡丹籽蛋白水解物制备乳状液的ζ-电势值的影响较为显著(p<0.05)。随着水解度增加,乳状液的ζ-电势值先升高后降低,水解度为10.91%时,乳状液的ζ-电势值最高。蛋白质经过水解后液滴所带电荷的电荷量增加,蛋白质上的极性基团能够吸附在液滴表面,在相邻液滴间形成静电斥力,使液滴间保持一定的分离距离从而抵抗液滴间的聚集,从而增加乳状液的稳定性[8]。高水平的表面电荷,使吸附的蛋白质在液滴周围形成黏弹性保护界面层,乳状液聚结的可能性较小,因此稳定性增加。水解度超过10.91%时,乳状液的ζ-电势值显著降低(p<0.05)。用水解度较高的水解物稳定的乳状液的ζ-电势值降低,这可能是较少量的蛋白质吸附在界面上,液滴尺寸越大,蛋白质的吸附量越小,液滴越少,界面面积越小。此时,吸附在界面上的蛋白质产生空间排斥和静电排斥减弱,从而使乳状液物理稳定性降低。
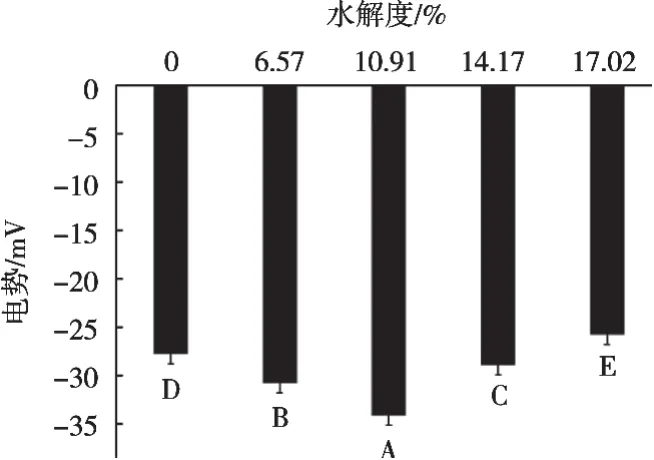
图2 水解度对牡丹籽蛋白水解物制备乳状液ζ-电势值的影响
3 结论
试验结果表明,水解后牡丹籽蛋白以胶状聚集体形式存在于溶液中,并形成较强的氢键,从而使牡丹籽蛋白以溶解性良好的小分子形式存在。水解能够增加蛋白质的乳化性,当水解时间2 h,水解度为10.91%时,乳状液具有最好的物理稳定性。适度水解的牡丹籽蛋白在乳状液中分散得更好,表现出更高的乳化活性和乳化稳定性。水解能够使蛋白质结构断裂,并有助于聚集蛋白质颗粒破碎、乳化液滴尺寸减小。水解后液滴所带电荷的电荷量增加,在相邻液滴间形成静电斥力,抵抗液滴间的聚集,从而增加乳状液的稳定性。高度水解是不可取的,当水解度超过10.91%时,蛋白质被水解为分子量极小的多肽,这多肽缺乏所需的表面功能特性,乳状液的物理稳定性降低。
