COP-PDMS 微流控芯片的制备及在太赫兹对肠道上皮细胞生物效应中的应用*
2021-12-31王澄瑶李旭卢晓云
王澄瑶 李旭 卢晓云†
1) (西安交通大学,瞬态电磁环境与应用国际联合研究中心 西安 710049)
2) (西安交通大学生命科学与技术学院,线粒体生物医学研究所,生物医学信息工程教育部重点实验室,西安 710049)
用于细胞培养的常规培养皿无法直接用于激光共聚焦显微镜的观察,在很大程度上限制了细胞水平上的太赫兹生物效应研究的开展.本文采用了对太赫兹吸收率低的材料—环烯烃聚合物(COP),与聚二甲基硅氧烷(PDMS)进行共键合,借用软蚀刻、光刻、等离子清洗和高温高压孵育技术将两种材料整合成新型微流控芯片,并利用该微流控芯片探索太赫兹对肠道细胞的生物效应.该微流控芯片可实现肠上皮细胞Caco-2的动态培养,原位免疫荧光染色及激光共聚焦显微镜的直接观察,为太赫兹细胞水平的生物效应研究提供了高效便捷的实验环境.研究中将微流控芯片中培养的肠上皮细胞Caco-2 经15 mW/cm2 的0.1 THz 波辐照10 min,免疫荧光染色结果显示细胞贴附生长的形态改变,胞间紧密连接蛋白ZO-1 及桩蛋白Paxillin 的水平及分布发生变化,提示太赫兹对细胞的胞外连接及胞间连接均可产生影响,可减弱细胞与培养界面的黏附.本研究设计制备的COP-PDMS 共键合微流控芯片为探索太赫兹对细胞的生物效应提供了便捷有效的平台,有望在未来进一步用于太赫兹对细胞分子效应的实时研究.
1 引言
太赫兹(terahertz,THz)是介于电子学和光子学之间的一个特殊波段,其波段的频率范围与生物分子骨架的振动和旋转频率相当[1],辐射能级与生物分子间的弱相互作用的能级较为一致[2].因此,目前认为太赫兹波在生物医学领域中具备一些其他频段电磁波所不可替代的优势.除了目前已大量开展的太赫兹时域光谱对生物分子特征指纹的鉴定及生物组织成像之外[3],太赫兹的生物效应研究也成为太赫兹技术应用研究的热点领域.研究发现,太赫兹对细胞基因表达、细胞膜功能、生物分子互作均产生一定程度的作用,提示了太赫兹可在分子细胞水平上对生命活动的多个方面产生影响[4],如太赫兹辐射能够促进细胞微丝蛋白Actin 的聚合[5],太赫兹破坏皮肤组织的同时增加了抑制肿瘤的蛋白质[6],以及太赫兹可造成神经元膜屏障特性的可逆破坏,从而使得对化合物的通透性增加[7].
然而,目前研究太赫兹在细胞水平上的生物效应研究的局限性在于难以进行对细胞或分子样品的实时同步观察或检测.目前用于细胞培养的培养皿的主要材料为聚苯乙烯(polystyrene,PS),如需进行激光共聚焦显微镜观察,则通常采用底部为石英材质的培养皿或制备细胞爬片来进行,这两种材料特别是石英被报道在0.5—2.5 THz 波段下对太赫兹的吸收率较高[8-10],难以将细胞直接培养进行太赫兹辐照并实现激光共聚焦显微镜的观察.一款新材料—环烯烃聚合物(cyclic olefin polymer,COP)的出现或可解决太赫兹在传输到细胞过程中被吸收的问题,该材料对太赫兹的吸收低于其他常规用于细胞培养的材料[9,11,12].本文利用COP在0.5—2.5 THz 波段下对太赫兹吸收率低的特点,结合微流控技术的灵活性和可设计性,将COP 用于适合太赫兹细胞效应研究的微流控芯片的制备中.而用于常规微流控芯片制作的聚甲基丙烯酸甲酯(poly(methylmethacrylate),PMMA)、聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)、聚碳酸酯 (polycarbonate,PC),以及聚二甲基硅氧烷(polydimethylsiloxane,PDMS)等材料中,因PDMS 具有出色的可塑性,其在软蚀刻和光刻中的多次复制沟道技术中应用极广.与PMMA,PET 和PC 相比,PDMS 具有较低的太赫兹的吸收率[8,11,13],但其对太赫兹的吸收率在0.5 THz 波段下仍高于4.5 cm—1[8].本文将PDMS 和COP 结合起来,利用PDMS 在沟道复制中的优势以及COP 对太赫兹的低吸收率的特性,设计并制备了COP-PDMS 微流控芯片模型,并利用微流控芯片探索了太赫兹对肠道上皮细胞的生物效应,实现了基于COP-PDMS 微流控芯片的细胞培养、太赫兹辐照干预和激光共聚焦检测的一体化.
2 研究方法
2.1 太赫兹吸收率检测
采用太赫兹三维层析成像系统(QT-TO1000)基于太赫兹时域光谱探测COP 和PDMS 样片的透射信号.通过调节该系统中器件的相对位置将光路调节至最佳状态,将待测样片放置于太赫兹光路聚焦光斑位置,扫描样品置于聚焦光路中的太赫兹透射信号作为样品测试信号.参考信号为无样片时的太赫兹透射信号.其中,COP 和PDMS 样片的厚度均为1.6 mm.
2.2 微流控芯片设计及制作
在前期微流控芯片设计工作的基础上[14,15],优化本COP-PDMS 微流控芯片中单个芯片模块的设计参数为:2.6 cm × 1.5 cm × 0.1 cm (长×宽×高)(图A1).模具制作和重复倒模过程如图1 所示,具体步骤如下:设计的微流控沟道采用软蚀刻技术通过光刻模式形成以SU-8 光刻胶和硅片为基底的圆形阵列式模具,采用含有机硅和固化剂的SYLGARD 184 硅胶套件 (Dow Chemical,USA)制备PDMS 器件.有机硅和固化剂按9∶1 的比例混合,倒入模具,将模具放置在真空脱气室中 (Bel-Art Products,USA)过夜以清除混合后液体PDMS中的空气,再放入80 ℃的烘箱中烘烤6 h 固化成型.PDMS 模块固化后,用打孔器切割出0.75 mm的孔径作为微流控通道的进出口并连接连接管.微流控连接管的尺寸为内径0.25 mm,外径0.75 mm.

图1 COP-PDMS 共键合微流控芯片倒模制作图例 (a) 通过光刻技术形成以SU-8 和硅片为基底的圆形微流控芯片阵列式模具;(b) 切割后的单个微流控芯片模块;(c) PDMS 模块与COP 板材通过等离子处理后键合;(d) 在形成的COP-PDMS 微流控沟道中进行动态细胞培养的侧面图;(e) 含有细胞的微流控沟道的三维图Fig.1.Schematic fabrication process of COP-PDMS co-bonded microfluidic device:(a) Using soft lithography technology to prepare the round microfluidic device array mold on the SU-8 and silicon wafer;(b) the single microfluidic device module;(c) the PDMS module and COP plate are fabricated by plasma treatment;(d) side view of cells dynamically cultured in the COP-PDMS microfluidic channel;(e) three-dimensional view of microfluidic channels containing cells.
2.3 COP-PDMS 键合
采用的COP 板材由COP 颗粒压制而成,通过上述2.1 节中的方法在实验室加工PDMS,两种材料的厚度均为1.6 mm.由于COP 和PDMS 材料表面的疏水性,两种材料无法在表面未处理的情况下进行键合,因此有必要对COP 和PDMS 表面进行化学基团修饰.利用等离子体清洗机(PLUTO-T)处理引入极性基团,COP 表面的化学键由疏水性(C—H 键)变为亲水性(C—OH,C—NH,—COOH键);而PDMS 由重复的—O—Si(CH3)2—基团组成,极性基团,如硅醇基团(Si—OH),通过将PDMS块暴露在空气等离子体中引入.因此,当含有这些极性基团的COP 和PDMS 表面接触时,两种材料表面产生脱水反应后形成化学键,可以被紧密黏合密封.根据已经报道的COP 以及PDMS 键合的条件[14-16],本文中等离子处理条件为:真空度0.024 kPa,空气流量参数为180 mL/min,发射功率150 W,时间60 s,COP 与PDMS 黏合后的烘烤温度为80 ℃,烘烤时长为 6 h.
2.4 键合强度测试
在采用已报道的键合条件进行COP-PDMS键合后,由于其键合强度无法满足本研究中所模拟不同器官内流体剪切应力所需的高灌注流量,因此,对COP-PDMS 的键合方式进行进一步改良,在高温烘烤过程中通过添加重物给COP-PDMS表面以添加不同的压强(0,125,250,750,1000,1250,2500,3750 和5000 Pa),加压的原因是为了应对COP 板与PDMS 模块的表面不平整而造成二者键合不牢固,由于PDMS 的硬度不高且具有弹性,加压后可使得COP 与PDMS 的接触面增大,从而抵消了板子不平整而产生的键合不牢固的问题.在键合完成后通过推拉力计测试COP 和PDMS 的键合强度,即通过侧面推拉的方式完全剥离两种材料所需的剪切应力

其中F是推拉力计的输出数据,A为微流控芯片单个模块的面积,推拉力计的输出速度控制为0.2 mm/s.
2.5 生物流体剪切应力对应的微流控灌注流量计算
为计算在微流控芯片中模拟与生物体内一样水平的流体剪切应力所需的灌注流量,假设在微流控沟道中的液体为牛顿液体,流动方式为层流,重力影响忽略不计,流体剪切应力计算方式如下:

其中τ1为生物各个组织器官中的流体剪切应力;μ为牛顿液体动态黏性系数,常温下,水的动态黏性系数为8.90 × 10—3dyne·s·cm—2,细胞培养基的动态黏性系数可认为约等于水;v为流体速度;y为层流距离底部边界高度.
通过对(2)式进行积分得到流体速度与流体剪切应力的关系为

其中h为微流控芯片沟道高度.在已知生物体各个器官的流体剪切应力的情况下,根据沟道的尺寸得出了在微流控系统中对应的流量:

其中Q为微流控系统中的流体流量,A1为微流体沟道中流体流过的横截面面积.
2.6 细胞培养
本文以人肠上皮细胞Caco-2 (ATCC,USA)为模式细胞探索太赫兹辐照对细胞的生物效应.Caco-2 细胞在75 cm2细胞培养瓶中培养完成复苏和扩增,培养基为低糖DMEM (HyClone,SH-30021.01),含有20%胎牛血清FBS (BI,04-001-1A)和1%的青霉素-链霉素(Solarbio,P1400).细胞在37 ℃和5% CO2的湿润条件下孵育直至覆盖培养瓶表面70%,将细胞消化后接种至微流控芯片.在细胞接种至微流控芯片之前,先对芯片进行清洁灭菌处理.简单来说,先用75%酒精灌注微流控沟道和连接管进行清洁,在生物安全柜中用紫外灯灭菌后,用50 μg/mL 人类成纤维细胞纤连蛋白(Sigma-Aldrich,33016015)和100 μg/mL 大鼠来源的鼠尾胶原蛋白(Roche,11179179001)依次对沟道表面进行包被.使用细长低吸附移液枪头(Rainin,30389291)将密度为5 × 106个/mL 的细胞悬液通过移液枪泵入到微流控沟道中,在培养箱中静置3 h 使得细胞贴附,随后分为静态培养和动态培养.静态培养中,细胞贴附后每天进行换液;动态培养中,细胞贴附后使用注射泵(DK Infusetek Co.,ISPLab12)以与肠上皮的生理管腔应力等同的流量(0.05 μL/s[17,18])向微流控沟道中灌注新鲜细胞培养基,动态和静态均持续培养4 天.
2.7 辐照条件
在植入细胞后的第二天开始对微流控芯片进行太赫兹辐照.太赫兹发射源(Terasense Sub-THz wave source,S/N:200382)放置于COP-PDMS 芯片底部1.5 cm 处.采用0.1 THz、实测平均功率密度为15 mW/cm2的太赫兹波对微流控芯片进行辐照,每天辐照10 min,连续辐照3 天.在最后一次辐照后继续培养6 h,再进行后续的细胞固定及免疫荧光染色.
2.8 免疫荧光染色
用3.7%多聚甲醛固定细胞10 min 后,用体积浓度为0.1%的triton X100 (Solarbio,T8200)在室温下渗透细胞10 min.用体积浓度为5% 的牛血清白蛋白 (Bioforxx,4240GR100)覆盖芯片沟道,并在室温下停留30 min 以阻断非特异性蛋白的结合,洗去牛血清蛋白后加入鬼笔环肽标记的染料(Beyotime,C2207S)对细胞骨架微丝蛋白F-actin进行染色,孵育时间为1 h.随后加入1∶200 稀释的一抗(细胞紧密连接蛋白ZO-1 (ProteinTech,66452-1-Ig)或桩蛋白Paxillin (ProteinTech,1002 9-1-Ig)),在4 ℃ 孵育过夜后加入1∶100 稀释的二抗FITC (ProteinTech,SA00003-1),在室温下孵育1 h 后使用DAPI 对细胞核进行染色.免疫荧光染色完成后,用共聚焦显微镜(ZEISS LSM 700)对细胞进行成像,记录荧光强度和细胞核数,通过ImageJ 软件对每个细胞中相应种类蛋白的荧光强度进行定量分析.
2.9 数据分析
每个实验测试的重复次数为n≥ 3.数据采用平均值±均值标准误差(SEM)表示,特定情况单独说明,实验组之间结果差异的显著性分析采用单因素方差分析和t检验.为了避免统计上的出现I 型和II 型误差增加,本文使用了Bonferroni 校正和霍尔姆法.统计分析通过Microsoft Excel 和Matlab 完成,p值小于0.05 时认为结果具有显著性差异.
3 结果与讨论
3.1 COP 和PDMS 的太赫兹吸收率
通过对两种材料的太赫兹吸收率的检测发现,PDMS 对太赫兹的吸收系数在低频段时(小于1 THz)随着太赫兹频段上升而增加,而当太赫兹频率超过1 THz 后,PDMS 的吸收系数出现最高峰:约为20 cm—1(图2).不同于PDMS 的吸收系数随着太赫兹频率变化而产生差异,在太赫兹频段0.1—2.4 THz 范围内,COP 的吸收系数维持在0.01—1 cm—1(图2)范围内.该结果提示了COP对太赫兹的透过性高,对比其他常用高分子材料如PMMA,PET,PC,PS 和石英在该频段范围的吸收率[8,10,12,19],COP 将会在未来太赫兹生物效应的研究中发挥巨大作用.

图2 两种微流控材料—COP 和PDMS 在太赫兹频段0.1—2.4 THz 范围内的吸收光谱Fig.2.The THz absorption map of two characteristic materials:COP and PDMS,between the frequency from 0.1 to 2.4 THz.
3.2 COP 等离子改性
COP 表面改性结果显示,经过等离子处理后,该COP 板材的表面被成功改性:未经过改性的板材表面的超纯水液滴呈现球状,等离子改性后,超纯水液滴在板子表面张力减小,呈现平铺状态(图A2),提示了改性后的COP 表面呈现亲水性.PDMS 的等离子改性参数及结果在前期的工作中已经完成[20].COP 和PDMS 表面均呈现亲水性,代表了极性基团的成功引入,理论上,其表面进行脱水反应后产生的化学键可以使两种材料紧密黏合.
3.3 COP-PDMS 键合强度
通过推拉力计对COP-PDMS 的键合强度进行检测后发现,完全剥离COP 和PDMS 模块需要的剪切应力从0.1 至0.6 MPa 不等(图3(a)).根据目前已发现的PDMS 与其他材料的键合强度数据,PDMS 与石英的键合强度最大[21],为0.33 MPa[22]至 0.497 MPa[23,24].COP-PDMS 键合强度的结果显示,在外加压强3750 和5000 Pa 时,对应的剪切应力分别为0.51 MPa 和0.56 MPa,均高于PDMS与石英的键合强度,证明了额外加压后,COP-PDMS能够达到与PDMS-石英同样甚至更高强度的键合效果.该研究结果还显示,不同加压条件下键合的COP-PDMS 的强度与压强呈正相关关系(图3(b)).在压强较低时(低于750 Pa),加压与键合强度的正相关关系坡度较陡,提示了在低压条件下,加压对增加键合强度的效果更明显;而加压高于750 Pa时,加压与键合强度的正相关关系的坡度变缓,这是缘于加压后PDMS 与COP 增加的接触面积有限且两种材料表面互相反应的极性基团的数量逐渐被饱和.

图3 (a) 键合过程加压后(0 至5000 Pa) COP-PDMS 微流控芯片的键合强度测试结果,键合强度代表的是完全剥离两种材料需要的剪切应力,该剪切应力通过推拉力计测量得出;(b) 芯片键合强度与额外加压的对应关系;(c) 高灌注速率(200 μL/s)下沟道变形及密封度变化情况;(d) 2 周长时程动态灌注(灌注速率为0.05 μL/s)后沟道形变及密封度变化情况Fig.3.(a) Bonding strength test results of COP-PDMS microfluidic device with the vary compressions (0 to 5000 Pa) during the bonding process.The bonding strength represents the shear stress required for completely stripping two materials,which is measured by push-tension meter.(b) The corresponding relationship between the bonding strength of microfluidic device and the compressions during the bonding process.(c) The seal and deformation change of channels and chamber at high fluid perfusion rate(200 μL/s).(d) The seal and deformation change of channels and chamber after a 2-week time-course dynamic perfusion (0.05 μL/s).
3.4 COP-PDMS 微流控芯片高灌注量和长时程检测
由于PDMS-石英键合的微流控芯片的强度和密封性的优势,其在体外细胞培养中应用广泛,而在本研究中键合的COP-PDMS 微流控芯片强度能够达到同样的水平,为了验证该芯片同样可以用于体外细胞培养,进一步进行了COP-PDMS 微流控芯片液体高灌注量和长时程检测以确定其在不同细胞培养中应用的稳定性.本实验中,根据键合强度结果,COP-PDMS 芯片的键合条件为表面加压5000 Pa.基于微流控沟道的设计参数,计算出了在COP-PDMS 微流控芯片中模拟生物体内各个器官组织的流体剪切应力所需要的流量(表1).根据计算结果,采用对应的流量对上述芯片沟道的密封性、完整性进行了测试.参考表1 中的结果,用于测试的流体流量为0.05,0.1,0.2,0.4,1,2,5,10,50,100,150,200 μL/s.测试结果表示,200 μL/s及以下的流量产生的剪切应力均不会对COPPDMS 微流控芯片的沟道产生形变且不会使两种材料剥离(图3(c)).长时程检测的结果显示,在经过2 周、流量为模拟肠腔生物剪切应力的0.05 μL/s的灌注后,COP-PDMS 芯片的沟道形状、密封性均未发生变化.该结果证明,该COP-PDMS 微流控芯片的键合条件能够模拟各个器官体内的生物剪切应力,并能够在长时间的灌注下保持形状和密封性不变,从而满足后续的生物实验.
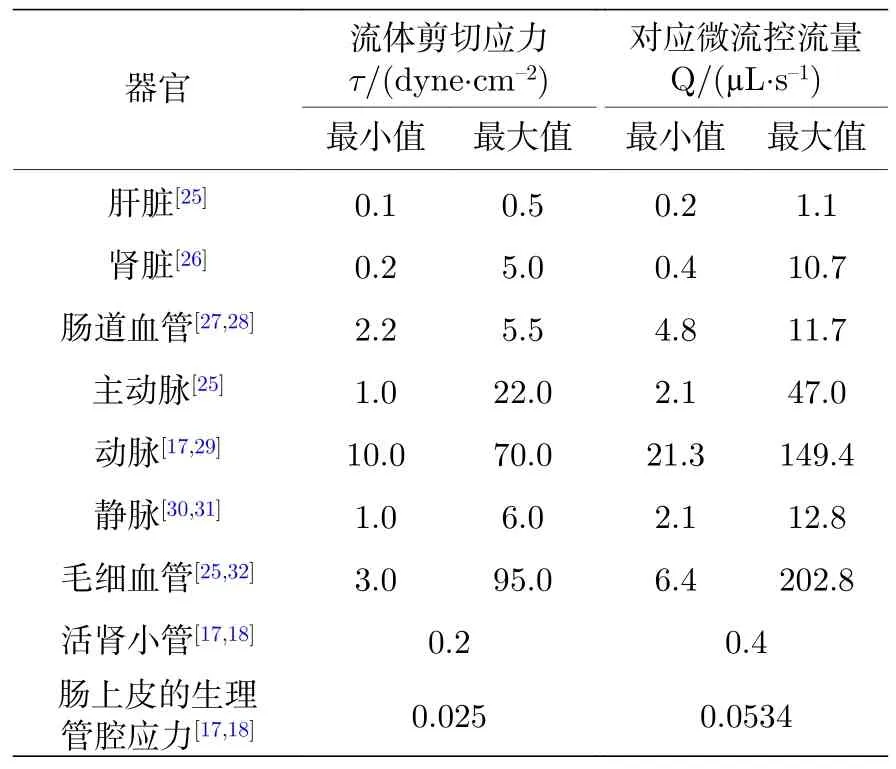
表1 生物体内各个组织器官中的流体剪切应力及在COP-PDMS 微流控芯片中模拟对应流体剪切应力需要的流体流量Table 1. Shearing stress in the in-vivo tissues and the corresponding fluidic perfusion rate in the COP-PDMS microfluidic device to simulate the shearing stress.
3.5 COP-PDMS 微流控芯片中的动态和静态细胞培养
将肠上皮细胞Caco-2 接种至COP-PDMS 微流控芯片后,首先对比了短期静态培养和动态培养后细胞的贴附生长情况,验证了在该微流控芯片中动态培养的细胞能够更近似地模拟体内环境中的细胞,表现为动态培养的肠上皮细胞能够表达更多的细胞间紧密连接蛋白ZO-1 和细胞骨架微丝蛋白F-actin (图A3(a)).ZO-1 蛋白表达量是肠上皮细胞的一项重要特征,也是判断肠上皮细胞之间是否形成紧密连接的重要依据.从荧光染色结果来看,动态培养的细胞间的ZO-1 表达出连续的荧光,且荧光强度高于静态培养的细胞.相比于传统肠上皮细胞的3 周静态培养模型以获得细胞极化和胞间紧密连接,该结果提示了动态流体灌注产生的生物剪切应力能够快速促进肠上皮细胞的极化,从而促使细胞在短时间合成大量的ZO-1,快速形成胞间紧密连接,这一结果与已报道的PDMS 与其他材料键合后形成的微流控芯片的结果一致[33-36].微丝蛋白F-actin 不仅能够作为细胞支架,还参与细胞器转运、细胞分裂、细胞运动和信号传导.我们发现,动态培养下的细胞的骨架表现出了一定的延展性,且F-actin 的荧光强度更强,提示了在动态培养条件下产生的生物剪切应力能够促进细胞中微丝蛋白间的分子相互作用,从而促进微丝蛋白的组装,这一发现也在其他类型的微流控芯片中被报道[37,38].与细胞黏附和迁移有关的桩蛋白Paxillin在两种培养条件下也表现出显著性差异(图A3(b)),动态培养下的细胞表达出更高的Paxillin,提示了生物剪切应力在细胞黏附方面起到了促进作用,这一发现与前期报道的剪切应力可促进Paxillin 表达的结果一致[39,40].基于这些发现,我们在后续太赫兹生物效应的研究中选用了动态培养模型.
3.6 太赫兹辐照对细胞的生物效应
将在COP-PDMS 微流控芯片中动态培养的Caco-2 细胞经0.1 THz 每日辐照10 min,辐照3 天后进行细胞免疫荧光染色,检测Caco-2 细胞中ZO-1,Paxillin 和F-actin 的表达及分布(图4(a)和图4(b)).从F-actin 染色的图片上可以看出,未进行太赫兹辐照的细胞表现出舒展、向外扩散的形态,细胞边缘规则光滑;而经太赫兹辐照后Caco-2细胞有一定程度的收缩,游离的未与其他细胞接触的边缘呈一定的毛刺状,提示太赫兹辐照后的肠上皮细胞与培养介质可能发生贴附减弱的现象.从Factin 的表达水平上看(图4(c)),辐照后的F-actin蛋白量并未显著改变,但可以从图中看出,太赫兹辐照的Caco-2 细胞中F-actin 形成的纤维状结构减少.Yamazaki 等[5]前期报道了太赫兹辐射能够影响细胞微丝蛋白Actin 的聚合,本文在细胞中观察到了太赫兹辐照后细胞内F-actin 聚集形态的变化,进一步提示太赫兹可能对细胞内Actin 蛋白间的相互作用具有调控作用.

图4 太赫兹辐照对COP-PDMS 微流控芯片中动态培养的Caco-2 细胞的ZO-1,Paxillin 和F-actin 的免疫荧光检测(图中基准尺为20 μm) (a) ZO-1 与F-actin 的免疫荧光染色;(b) Paxillin 与F-actin 的免疫荧光染色;(c) 对(a)和(b)图中太赫兹辐照前后ZO-1,Paxillin 和F-actin 免疫荧光强度定量分析结果(t 检验显著性差异:p < 0.05,*;p < 0.01,**)Fig.4.Immunofluorescence staining results of Caco-2 cells that are dynamically cultured in COP-PDMS microfluidic device,before and after terahertz irradiation (scale bar:20 μm).(a) The confocal result of ZO-1 and F-actin.(b) The confocal result of Paxillin and F-actin.(c) Quantitative analysis of immunofluorescence intensity of ZO-1,Paxillin and F-actin of the cells in panel (a) and (b):The quantification is determined as immunofluorescence intensity corresponding to 104 nuclei (significance of t-test:p < 0.05,*;p < 0.01,**).
对Caco-2 细胞中ZO-1 的免疫荧光染色结果显示,未经辐照的Caco-2 细胞中ZO-1 在细胞膜表面特别是相邻细胞相互接触的细胞膜界面上表现出较亮和较粗的荧光;而在太赫兹辐照后的Caco-2 细胞中,ZO-1 在细胞内呈现弥散样分布,其在细胞膜上的定位不明显.对ZO-1 荧光强度进行定量分析发现,辐照后的肠上皮细胞ZO-1 的水平是未经太赫兹辐照细胞的4 倍.这些结果显示太赫兹辐照可以改变Caco-2 细胞中胞间紧密连接蛋白ZO-1 在细胞内的分布,促进ZO-1 蛋白水平的升高,提示太赫兹能够对细胞紧密连接的结构和功能产生影响.此外,对桩蛋白Paxillin 的免疫荧光检测也发现,太赫兹辐照后的Caco-2 细胞中Paxillin 的荧光信号强度增强,且部分细胞中Paxillin出现了局部聚集分布的现象(图4(b)),这一结果提示太赫兹辐照可以提高Paxillin 蛋白的水平,且对细胞与基质的黏附产生的影响.
综合上述结果,我们认为0.1 THz 辐照可能会减弱细胞外及细胞间的黏附作用,推测ZO-1 与Paxillin 蛋白水平的升高则可能是细胞应对黏附作用降低的一种代偿性反应,进一步详细的机制仍需要更深入的实验研究.
4 结论
本文开发了新的COP 与PDMS 键合方法,设计并制备了适用于太赫兹细胞水平生物效应研究的COP-PDMS 微流控芯片.该键合方法制备的COP-PDMS 微流控芯片黏合强度和密封性均能达到与目前常用的微流控材料的相同水平,并且在瞬时高灌注量和长时程灌注检测中,能保持沟道无形变且密封性完好,可用于体外细胞的动态培养、太赫兹辐照处理及进一步的激光共聚焦显微镜观察,为太赫兹细胞水平生物效应的研究提供了便利的条件.基于该芯片开展了肠上皮细胞Caco-2 的动态培养及0.1 THz 对细胞黏附功能影响的研究,发现0.1 THz 可引起肠上皮细胞胞间紧密连接蛋白ZO-1 和桩蛋白Paxillin 的水平升高及细胞黏附状态的改变,提示辐照可能会减弱细胞外及细胞间的黏附作用.基于本研究制备的COP-PDMS 微流控芯片,未来可以进一步开展0.1 THz 对细胞黏附功能影响的实时动态观察,以深入揭示其作用的过程和分子机制.
感谢青岛青源峰达太赫兹科技有限公司在COP 和PDMS 样片太赫兹吸收率检测中的帮助;感谢西安电子工程研究所石东辰老师在推拉力计建模、软件调试和测试中的帮助;感谢西安交通大学生命科学与技术学院许丹老师提供的Caco-2 细胞.
附录A 微流控芯片设计、等离子处理及细胞培养的免疫荧光检测结果
图A1 给出了微流控芯片沟道设计CAD 图及设计参数.图A2 为COP 材料等离子改性前后亲水性测试,测试结果显示,经过发射功率为150 W,时间为60 s 的等离子处理后,COP 材料表面呈现明显的亲水性:滴落在表面的液滴由未处理前的球状变为平铺状.图A3给出了在COPPDMS 微流控芯片中动态和静态培养中,Caco-2 细胞的ZO-1,Paxillin 和F-actin 的免疫荧光检测结果.结果显示,动态培养下的肠道细胞可被快速极化,形成紧密连接结构,并呈现与静态培养不同的细胞形态.
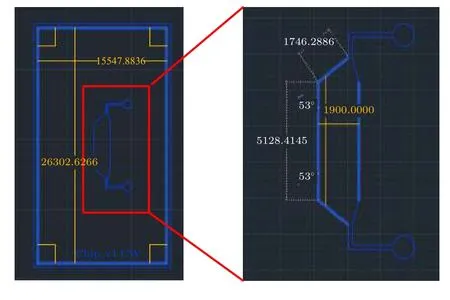
图A1 微流控芯片沟道设计CAD 图及设计参数Fig.A1.CAD drawing and design parameters of the channel design of microfluidic chip.

图A2 COP 材料等离子改性前后亲水性测试Fig.A2.Hydrophilicity test of COP material before and after plasma modification.

图A3 在COP-PDMS 微流控芯片中动态和静态培养中,Caco-2 细胞的ZO-1,Paxillin 和F-actin 的免疫荧光检测(图中基准尺为20 μm) (a) ZO-1 与F-actin 的免疫荧光染色;(b) Paxillin 与F-actin 的免疫荧光染色;(c) 对(a)和(b)图中太赫兹辐照前后ZO-1,Paxillin 和F-actin 免疫荧光强度定量分析结果(t 检验显著性差异:p < 0.05,*;p < 0.01,**)Fig.A3.Immunofluorescence staining results of Caco-2 cells that are dynamically and statically cultured in COP-PDMS microfluidic device (scale bar:20 μm).(a) The confocal result of ZO-1 and F-actin.(b) The confocal result of Paxillin and F-actin.(c) Quantitative analysis of immunofluorescence intensity of ZO-1,Paxillin and F-actin of the cells in panel (a) and (b):The quantification is determined as immunofluorescence intensity corresponding to 104 nuclei (significance of t-test:p < 0.05,*;p < 0.01,**).
