燕麦分离蛋白消化特性和消化产物对STC- 1细胞分泌胆囊收缩素的影响
2021-12-31傅秋云方子韵宋洪东罗可大余治权
傅秋云, 方子韵, 宋洪东, 管 骁,*, 罗可大,孙 注, 余治权
(1.上海理工大学 健康科学与工程学院/国家粮食产业(城市粮油保障)技术创新中心, 上海 200093;2.浏阳河集团股份有限公司, 湖南 长沙 410114;3.内蒙古燕谷坊生态农业科技(集团)股份有限公司, 内蒙古 呼和浩特 011700)
肠内分泌细胞是一大类存在于胃肠道表面,能够分泌多种激素的锥体形或圆形细胞。尽管肠内分泌细胞在整个消化道肠上皮细胞中的比例小于1%,但它们分布于整个消化道的表面,构成机体内最大的内分泌器官[1]。在肠腔特定内容物的刺激下,肠内分泌细胞可选择性分泌20多种肽类和(或)胺类激素,包括胆囊收缩素(cholecystokinin,CCK)、胰高血糖素样肽- 1(GLP- 1)、葡萄糖依赖性胰岛素释放肽(GIP)、酪酪肽(PYY)、5-羟色胺(5-HT) 以及胃饥饿素等。CCK是第1个被发现的胃肠激素,除了具有调节胰酶释放、胆囊收缩的生理功能外,亦被发现在血压调控、机体免疫、胰岛素分泌的调节等方面发挥重要作用[2-4]。作为一种典型的胃肠激素,CCK在十二指肠、空肠和回肠中高表达[5]。肠内分泌细胞分泌的CCK可直接从细胞基底部进入皮下结缔组织,通过血液或扩散方式影响靶细胞,从而发挥各种生理功能。有研究曾认为,CCK是由小肠内分泌I细胞分泌,然而最近的研究发现,CCK亦可由小肠内分泌L细胞、K细胞等表达和分泌[6]。
在体外实验中,STC- 1细胞已作为一种成熟的肠内分泌细胞模型用以研究营养物质对CCK表达和分泌的影响[7]。已有研究表明,β-伴大豆球蛋白、蛋清胃肠消化物以及肉类和土豆蛋白胨酶解物能刺激STC- 1细胞分泌CCK[8-10],但未见燕麦分离蛋白水解物相关的报道。
本研究拟以制备的燕麦分离蛋白为研究对象,探究其经过模拟胃肠道消化后的消化特性,在以燕麦分离蛋白胃肠消化产物作为优质蛋白源的前提下,进一步探究其对肠内分泌细胞STC- 1的合成和分泌CCK的影响,以期为扩展燕麦分离蛋白在食品领域的应用提供更多的理论依据。
1 材料与方法
1.1 材料与试剂
燕麦购于河北省涞水县金谷粮油食品有限公司,产地为涞水县。
胃蛋白酶(P- 7000)、胰酶(P- 1750),购于美国Sigma公司;蛋白相对分子质量标品(PageRulerTMPrestained Protein Leader)、胎牛血清(fetal bovine serum,FBS)和DMEM培养基,购于美国 Thermo Scientific公司;正己烷、氢氧化钠、盐酸均为分析纯,购于国药集团化学试剂有限公司。乙腈(色谱级),购于国药集团化学试剂有限公司;三氟乙酸(色谱级),购自上海麦克林生化科技有限公司。STC- 1细胞,购于上海富衡生物科技有限公司;CCK检测试剂盒,购于武汉云克隆科技股份有限公司。
1.2 仪器与设备
BSA224S- CW型电子天平,赛多利斯科学仪器(北京)有限公司;MYP11- 2型磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;pH计,Mettler Toledo仪器(上海)有限公司;H1850型离心机,长沙高新技术开发区湘仪离心机仪器有限公司;SCIENTZ- 10N型冷冻干燥机,宁波新芝生物科技股份有限公司;KjeltecTM8400型全自动凯氏定氮仪,丹麦FOSS分析仪器有限公司;DKZ型系列电热恒温振荡水槽、电热鼓风干燥箱、BWS- 12G型精密恒温水槽,上海一恒科学仪器有限公司;ChemiDocTMImaging System凝胶成像仪,伯乐生命医学产品(上海)有限公司; L- 8900 型氨基酸分析仪,日立仪器(中国)有限公司;配备SPD- 16型紫外可见双波长检测器的LC- 16型液相色谱,岛津(上海)实验器材有限公司;2000 SWXL型凝胶过滤柱( 长度300 mm,直径7.8 mm),东曹(上海)生物科技公司;二氧化碳培养箱,购于普和希健康医疗器械(上海)有限公司。
1.3 实验方法
1.3.1燕麦的脱脂预处理
将新鲜燕麦用磨粉机磨成粉末,用正己烷以2∶1的质量比浸提全脂燕麦粉,以400 r/min搅拌2 h,静置30 min后,倾去溶剂,通风橱下待溶剂完全挥发,封好,4 ℃储藏备用。
1.3.2燕麦分离蛋白的提取
脱脂燕麦用蒸馏水以12∶1的质量比完全浸泡于烧杯中,用1 mol/L NaOH将pH值调至11,磁力搅拌器作用2 h后离心取上清液。将上清液用1 mol/L HCl调节pH值至其等电点(pH值为4.3)后离心,将沉淀反复水洗至中性,加少量蒸馏水复溶,经过冷冻干燥后,即得燕麦分离蛋白,储存于4 ℃冰箱中备用。
1.3.3蛋白质含量的测定
按照GB 5009.5— 2010《微量凯氏定氮法》,用全自动凯氏定氮仪,对脱脂后燕麦粉和燕麦分离蛋白中的总蛋白含量进行测定,蛋白质的换算系数为5.83。
1.3.4燕麦分离蛋白的体外消化模拟
参考Ribeiro等[11]的方法,并稍加修改,进行燕麦分离蛋白的体外消化模拟。将1 g燕麦分离蛋白粉末,0.1 mol/L K2HPO4- KH2PO4磷酸盐缓冲液,与25 mg新鲜制备的胃蛋白酶一起温育。在孵育之前,用1 mol/L HCl将缓冲液的pH值调节至2,在37 ℃下孵育2 h。孵育结束,将溶液用1 mol/L NaOH调节pH值至6.8后与50 mg新鲜制备的胰蛋白酶温育2 h。在每次消化步骤结束后取样,通过100 ℃水浴8 min结束消化。离心取上清液冷冻干燥,-20 ℃保存备用。
1.3.5氮含量分布的测定
在每次消化步骤结束后,加入等体积的质量分数为10%的三氯乙酸(TCA)沉淀蛋白1 h,离心(5 000 r/min,30 min),取沉淀。沉淀用蒸馏水洗涤、离心,重复两次,于60 ℃烘箱烘干,采用凯氏定氮法测定沉淀物的蛋白含量。根据Santos-Hernández等[12]的方法提取消化后上清液中的游离氨基酸,具体方法为:将冻干的上清液粉末,溶于20 mL水中,加入等体积的质量分数为3.5%的5-磺基水杨酸,4 ℃静置1 h,离心(6 000 r/min,20 min),取上清液,冷冻干燥。冻干粉末蛋白含量的测定方法同1.3.3方法,消化后氮含量分布的计算方法见式(1)至式(4)。

(1)

(2)

(3)
肽氮含量=可溶性氮含量-氨基态氮含量。
(4)
式(1)至式(4)中:w(沉淀蛋白),g/100 g;w(粗蛋白),g/100 g;w(游离氨基酸蛋白),g/100 g。
1.3.6十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳(SDS- PAGE)分析是根据Santos-Hernández等[13]和Vera等[14]的方法并稍加修改进行的。用上样缓冲液[包含62.5 mmol/L Tris·H3PO4(pH值7.5), 1 mmol/L EDTA, 2 g/L SDS, 10 mmol/L二硫苏糖醇, 1 mmol/L NaN3, 体积分数为33%的甘油]将未消化的、经过胃消化的和胃肠消化的燕麦分离蛋白制成质量浓度为1 mg/mL样品,沸水浴5 min。浓缩胶体积分数为5%,电压为80 V;分离胶体积分数为12%,电压为120 V。相对分子质量标准品包含的相对分子质量为10、15、25、35、45、55、70、100、130、180 kDa。凝胶用考马斯蓝染色,并用凝胶成像仪拍摄图像。
1.3.7氨基酸含量的测定
根据Wang等[15]的方法分析燕麦分离蛋白胃肠消化产物上清液中的氨基酸组成。首先将50 mg样品置于20 mL安培瓶中,并在密封前与10 mL的6 mol/L HCl混合。在真空下于110 ℃水解蛋白质24 h。冷却后,打开安培瓶,在60 ℃下真空蒸发水解产物至干。将干燥的样品溶于4 mL 0.2 mol/L柠檬酸钠缓冲液(pH值为2.2)中,以达到50~250 nmol/mL的氨基酸浓度。将溶解的蛋白质溶液通过0.2 μm过滤器过滤并加载到全自动氨基酸分析仪上。
氨基酸自动分析仪的条件设置:分离柱温度为57 ℃,检测波长为570 nm,缓冲溶液流速为0.4 mL/min;反应液为茚三酮试剂,反应液流量为0.35 mL/min;反应单元温度为135 ℃,进样量为20 μL。
1.3.8食物蛋白质的营养价值评价
采用氨基酸评分(amino acid score,AAS),化学评分(chemical score,CS)和必需氨基酸指数(essential amino acid index,EAAI)对燕麦分离蛋白胃肠消化产物中可溶性部分进行营养价值评价[16-17]。计算方法见式(5)至式(7)。

(5)
(6)
(7)
式(5)至式(6)中,w(受试蛋白质中某种氨基酸),mg/g,以单位质量的蛋白质记;w(FAO/WHO评分模式下参考蛋白质中同种氨基酸),mg/g,以单位质量的蛋白质记;w[参考蛋白质(全鸡蛋) 中同种氨基酸],mg/g,以单位质量的蛋白质记。式(7)中:aa1,aa2,aa3,…aai分别为实验蛋白质中的必需氨基酸比率(A/E)(指某种必需氨基酸占必需氨基酸总量的百分比);AA1,AA2,AA3,…AAi分别为全鸡蛋蛋白质中的必需氨基酸比率;n为必需氨基酸个数,本实验中为8。
1.3.9分子质量的测定
根据Fabrice等[18]的方法进行燕麦分离蛋白胃肠消化产物中可溶性部分的分子质量的测定,并稍加修改。使用液相色谱测定样品的肽分子质量分布,所用色谱柱为TSK凝胶过滤柱,其流动相乙腈、水、三氟乙酸的体积比为45.0∶55.0∶0.1,以0.5 mL/min的流速递送,柱温设定为30 ℃。将10 μL样品注入HPLC系统中。选取细胞色素C(12 384 Da)、抑肽酶(6 512 Da)、九肽CSKSSDYQC(1 020 Da)、四肽AHLL(453 Da)和三肽GGG(189 Da)为标品。按保留时间为纵坐标,分子质量的常用对数为横坐标,获得分子质量校准曲线。通过将样品出峰时间代入分子质量校准曲线获得燕麦分离蛋白胃肠消化产物中可溶性部分的分子质量分布。
1.3.10STC- 1细胞的培养
STC- 1细胞在补充有体积分数为10% FBS的 DMEM培养基中培养,并在实验前于37 ℃、体积分数为5%的 CO2细胞培养箱中培养至对数期,用于后续实验。
1.3.11STC- 1细胞活力的测定
通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl]-2H-tetrazoliumbromide,MTT)细胞增殖及细胞毒性测试和评估燕麦分离蛋白胃肠消化产物对STC- 1细胞活力的影响。在96孔板处理后的STC- 1细胞中加入MTT,代谢活跃的细胞将黄色四唑盐MTT裂解成紫色的甲瓒晶体。将形成的甲瓒溶解,用酶标仪在检测波长为570 nm处测量吸光度,结果以对照组的百分比表示。具体方法以MTT细胞增殖及细胞毒性测定试剂盒生产说明书为依据。
1.3.12STC- 1细胞分泌CCK含量的测定
参考文献[5],将STC- 1细胞以1.25×105个细胞的密度接种在24孔培养板中。待细胞达到80%~90%汇合时,将细胞用Hank’s缓冲液洗涤两次,以除去培养基,用含有不同浓度燕麦分离蛋白胃肠消化产物的缓冲液在培养箱中孵育60 min。孵育结束后,根据云克隆胆囊收缩素测定试剂盒说明书操作,测定STC- 1细胞内外的CCK含量。
1.4 数据处理
采用Excel 2013、GraphPadTMPrism8.0版和SPSS 26软件对数据进行分析和处理,结果以平均值±标准差表示,以P<0.05表示差异显著。
2 结果与分析
2.1 燕麦分离蛋白得率和纯度分析
由1.3.2实验结果可得,100 g燕麦粉可提取分离蛋白8.51 g,即燕麦分离蛋白得率为8.51%±0.28%。由1.3.3实验结果可得:燕麦粉中蛋白质质量分数为13.9%,则燕麦分离蛋白提取率为61.22%;提取的燕麦分离蛋白的纯度为76.67%±0.37%。燕麦种类的不同以及提取方法的差别,会导致燕麦分离蛋白得率或提取率及纯度存在差异,如李玉娥等[19]通过碱提酸沉方法提取燕麦分离蛋白,提取率为75%,高于本实验中燕麦分离蛋白的提取率。许英一等[20]使用碱提酸沉方法得到的燕麦分离蛋白,纯度为64.12%,低于本实验提取的燕麦分离蛋白纯度。
2.2 燕麦分离蛋白体外胃肠消化过程中的特性变化
2.2.1相对分子质量的变化
SDS- PAGE分析可以更加直观地看出燕麦分离蛋白在体外胃肠消化过程中的分子质量变化,结果见图1。由图1可知,未经消化的燕麦分离蛋白主要组分的分子质量分布在10~70 kDa。35~40 kDa和15~25 kDa的两组蛋白质谱带很明显,分别对应12S球蛋白的酸性肽链(α-亚基)和碱性肽链(β-亚基)[21]。此外,根据文献[21-22],10~15 kDa的条带是3S球蛋白,25 kDa附近的条带对应的是燕麦醇溶蛋白,40 kDa附近是燕麦清蛋白,55~70 kDa对应的是7S球蛋白。经过胃消化之后,燕麦分离蛋白大部分被消化成小于10 kDa的肽,但在10~15 kDa有不明显条带,说明仍有3S球蛋白未被胃蛋白酶消化。经过胃和肠消化后,可以明显看到燕麦分离蛋白被全部消化成小于10 kDa的组分。这一结果说明燕麦分离蛋白具有很好的胃肠可消化性。
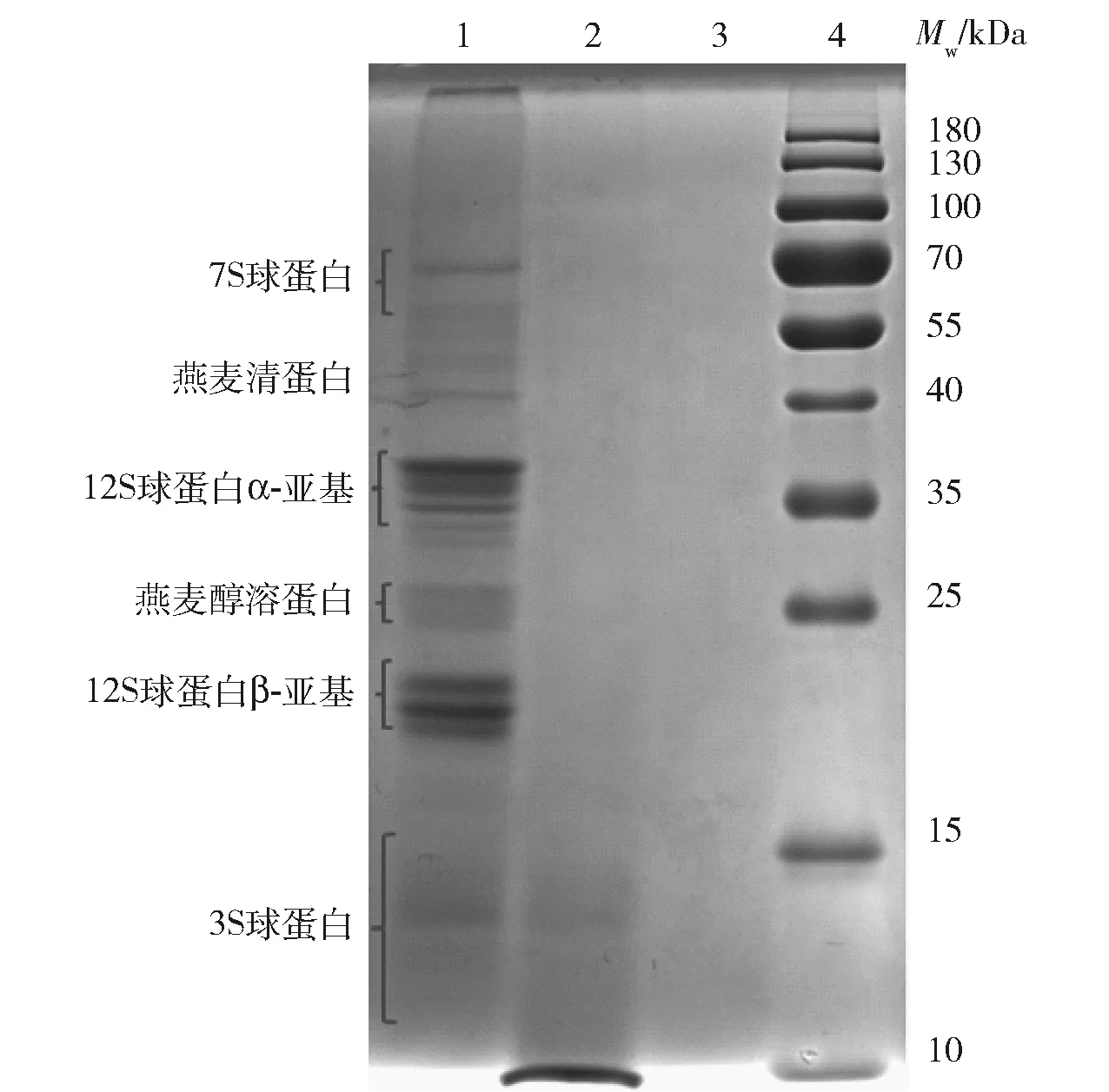
1.未消化; 2.胃消化产物; 3.胃肠消化产物; 4.Marker。
2.2.2氮含量分布变化
根据氮含量分布可以更好地看出燕麦分离蛋白在胃肠消化过程中每一阶段的消化情况,实验结果见图2。由图2可知,燕麦分离蛋白经胃消化后,不可溶性部分(氮含量)的比例为62.58%,可溶性部分(氮含量)为37.42%。可溶性部分中的氮主要是游离氨基酸和肽两种存在形式,其中游离氨基酸比例7.51%,肽比例为29.91%,说明经胃消化后可溶性组分中肽是主要成分。燕麦分离蛋白经胃和肠消化后,不可溶性部分中氮含量比例下降为9.89%,可溶性部分中氮含量比例升高为90.11%。胃肠消化产物可溶性部分中,游离氨基酸的比例为22.8%,肽的比例为67.31%。这一结果说明燕麦分离蛋白在胃部消化较少,主要消化部位在肠道。Santos-Hernández等[13]报道了大豆蛋白在体外胃肠消化过程中的氮含量分布,发现大豆蛋白经胃肠消化后不可溶性部分的比例为12.0%,可溶性部分的比例为91.9%。由此可知,燕麦分离蛋白的消化特性与大豆蛋白相当。
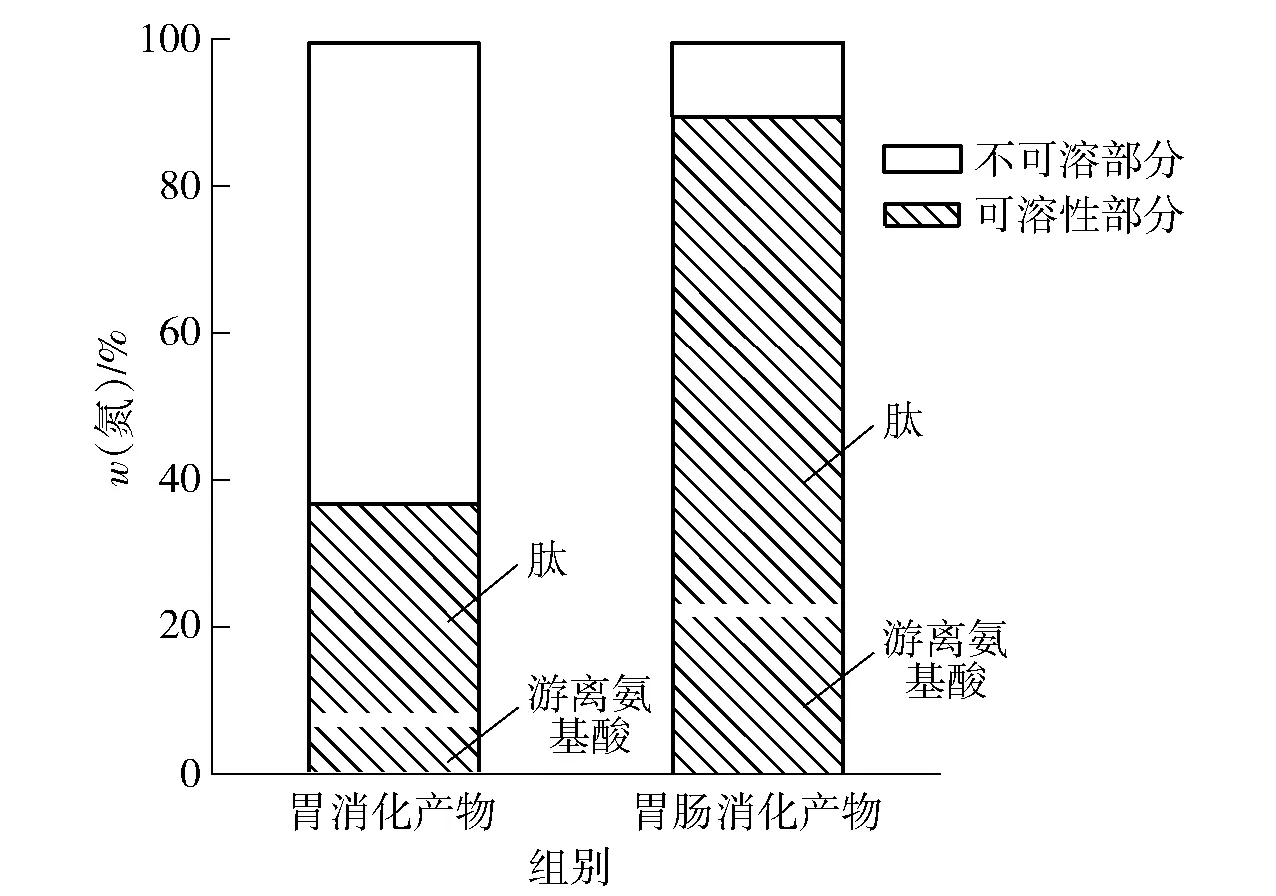
可溶性部分中白线以下为游离氨基酸所占比例,白线以上为肽所占比例。
生物可及性被定义为化合物在胃肠道中从其基质中释放出来并由此可被肠道吸收的部分,通常用在胃肠道消化过程中释放出的可溶性部分占食品总量的比例来表示[23]。生物可及性是确定食物营养效率的关键概念。经过胃肠消化后,燕麦分离蛋白的生物可及性为90.11%,这与Sánchez-Velázquez等[24]的研究一致,说明本实验结果可信。
2.3 燕麦分离蛋白胃肠消化产物中可溶性部分的特性研究
2.3.1分子质量分布
燕麦分离蛋白胃肠消化产物中可溶性部分的分子质量分布见表1。由表1可知,燕麦分离蛋白经体外胃肠消化后可溶性部分的分子质量主要在5 000 Da以下,比例超过95%。小于500 Da部分的比例占据65.65%,500~1 000 Da部分的比例占据8.39%,1 000~5 000 Da部分的比例占据21.13%。蛋白消化产物的分子质量是影响其吸收的重要因素。研究发现,小于1 000 Da的寡肽比蛋白质、多肽和游离氨基更容易被肠道吸收且更具有生物活性[25-26]。燕麦分离蛋白体外胃肠消化产物中可溶性部分中小于1 000 Da部分的比例超过74%,说明燕麦分离蛋白经胃肠消化后可以很好地被人体吸收利用。

表1 燕麦分离蛋白胃肠消化产物中可溶性部分的分子质量分布
2.3.2营养价值评价
燕麦分离蛋白消化产物可溶性部分的氨基酸组成见表2。燕麦分离蛋白经胃肠消化后,可溶性部分中Glu含量最高,达到(172.79±2.84)mg/g。其他含量较高的氨基酸包括Asp、Leu、Arg、Phe、Pro和Val。人体不能合成,必须由外界供给的必需氨基酸如Met、Lys、Leu、Val、Ile、Thr、Phe等的含量均较高,总量占据38.75%,接近于FAO/WHO标准规定的40%;必需氨基酸/非必需氨基酸的比值为0.63,高于FAO/WHO标准规定的0.6[27]。

表2 燕麦分离蛋白胃肠消化产物可溶性部分的氨基酸组成及含量
燕麦分离蛋白消化产物可溶性部分的AAS计算结果见表3,其中Phe+Tyr的含量均高于FAO/WHO的标准模式,Val、Ile、Leu的含量接近FAO/WHO的标准模式,Thr、Met+Cys和Lys的含量略低于FAO/WHO的标准模式。结合燕麦分离蛋白消化产物的可溶性部分的CS和EAAI(见表4),可知第一限制性氨基酸为Met+Cys,第二限制性氨基酸为Lys,第三限制氨基酸为Thr。如果将燕麦分离蛋白消化产物与富含这4种氨基酸的食物配合食用,可调整各种必需氨基酸的比例,弥补此产物中这4种氨基酸不足的缺憾,便于人体吸收,也能提高各种食物蛋白质的利用率。

表3 燕麦分离蛋白胃肠消化产物的必需氨基酸评分

表4 燕麦分离蛋白胃肠消化产物CS和EAAI评分
利用EAAI评价原料蛋白质的标准是:EAAI大于0.90的为优质蛋白源,在0.80左右的为可用蛋白源,小于0.70的为不适宜蛋白源。燕麦分离蛋白经胃肠消化后可溶性部分的EAAI值为0.95。由此可见,燕麦分离蛋白消化产物是氨基酸比例相对均衡的优质蛋白源,能较好地满足人体需要。
2.4 燕麦分离蛋白胃肠消化产物对STC- 1细胞的影响
2.4.1对STC- 1细胞活力的影响
用不同质量浓度(1、2、3、4、5、6 mg/mL)的燕麦分离蛋白胃肠消化产物对 STC- 1细胞进行处理,对照组为不经燕麦分离蛋白胃肠消化产物处理的正常培养细胞,细胞活力记为100%。处理前后的STC- 1细胞活力变化情况见图3。由图3可知:当燕麦分离蛋白胃肠消化产物质量浓度为1、2、6 mg/mL时,消化产物对STC- 1细胞活力无明显影响;当燕麦分离蛋白胃肠消化产物质量浓度为3、4、5 mg/mL时,消化产物对STC- 1细胞的生长有显著促进作用。本研究结果表明,当质量浓度为1~6 mg/mL时,燕麦分离蛋白胃肠消化产物对STC- 1细胞无细胞毒性。
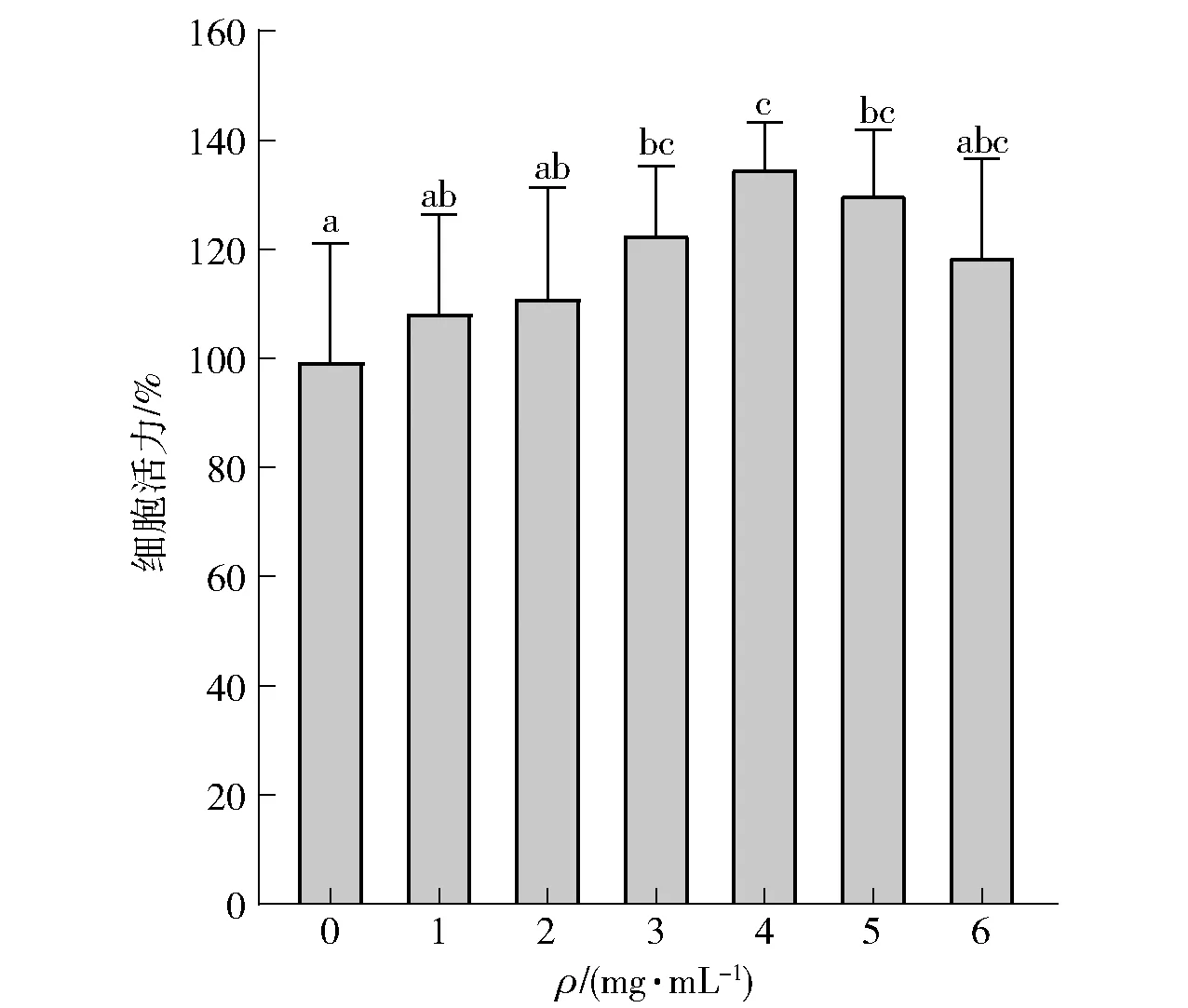
不同小写字母表示差异显著(P<0.05)。
2.4.2对STC- 1细胞合成和分泌CCK的影响
细胞内CCK的含量可反映CCK的合成情况,而细胞外CCK的含量则可反映CCK的分泌情况。用不同质量浓度(3、4、5 mg/mL)的燕麦分离蛋白胃肠消化产物对 STC- 1细胞进行1 h孵育后,观察燕麦分离蛋白胃肠消化产物对STC- 1细胞合成和分泌CCK的影响,实验结果见图4。由图4(a)可以看出,STC- 1细胞内CCK的含量有显著性的增加,且胃肠消化产物以剂量依赖性方式刺激STC- 1细胞合成CCK,5 mg/mL样品作用于STC- 1细胞能达到最大的合成量68 pmol/L。由图4(b)可以看出,细胞外CCK的含量有显著增加,也呈现剂量依赖性,当消化产物为5 mg/mL时,CCK的分泌量达到6 pmol/L。本实验结果表明,燕麦分离蛋白胃肠消化产物可显著促进STC- 1细胞合成和分泌CCK。

不同小写字母表示差异显著(P<0.05)。
3 讨 论
在食物的胃肠消化过程中,蛋白质被水解成多种肽和游离氨基酸。这些蛋白质消化产物可以通过诱导胃肠道内分泌细胞激素来发挥生理活性[30]。肠内分泌细胞因其顶端存在营养特异性受体而成为能够感知管腔内容物的特化细胞。这些细胞分散在肠道上皮中,产生和释放各种激素调节剂,例如产生CCK的Ⅰ细胞,可以调节胃肠功能和稳态功能。CCK能抑制胃排空,减少胃酸分泌,蛋白质降解产物在其释放过程中充当强诱导剂[31]。目前,燕麦分离蛋白消化产物对肠内分泌细胞分泌CCK的影响未见相关报道。
Santos-Hernández等[13]研究发现,青豆、草豌豆、大豆和扁豆经胃肠消化后,其可溶性部分中小于1 000 Da部分的比例只达到了60%、40%、50%和45%,而本研究表明,燕麦分离蛋白经胃肠消化结束后,其可溶性部分中分子质量小于1 000 Da部分的比例超过74%,说明燕麦分离蛋白比其他谷物蛋白更容易被肠道吸收。燕麦分离蛋白经胃肠消化结束后,其生物可及性达到了90.11%,远高于藜麦(70.8%~77.8%)[32]、牛皮豆(70%左右)[33]和大麦(65%)[34],说明燕麦分离蛋白经消化后具有很高的生物可及性及营养效率。燕麦分离蛋白经胃肠消化结束后,其可溶性部分中总氨基酸含量接近于FAO/WHO标准,必需氨基酸与非必需氨基酸的比值高于FAO/WHO标准,结合CS值和EAAI值,可得燕麦分离蛋白胃肠消化产物是氨基酸比例相对均衡的优质蛋白源,能较好地满足人体需要。
在燕麦分离蛋白胃肠消化产物是优质蛋白源的基础上,将其作为研究对象,探究其对肠内分泌细胞STC- 1合成和分泌CCK的影响。通过实验结果可得,细胞内外的CCK含量都有显著增加,且呈现剂量依赖性,说明该产物可以促进STC- 1细胞合成并分泌出CCK,可推测燕麦分离蛋白的胃肠消化产物具有预防慢性疾病(肥胖、高血压、糖尿病等)的潜在应用前景。
4 结 论
本研究对燕麦分离蛋白的消化特性和消化产物对肠内分泌细胞分泌胆囊收缩素(CCK)的影响进行了探讨。燕麦分离蛋白主要消化部位在肠道,胃肠消化结束时,释放的可溶性部分氮含量为90.11%,全部消化物分子质量均小于10 kDa,且大部分为小于500 Da的小肽(65.65%),因此燕麦胃肠消化产物完全可以作为短肽型肠内营养制剂的优质且经济的蛋白质原料。燕麦分离蛋白胃肠消化产物氨基酸种类丰富,其中必需氨基酸总量占据38.75%。根据AAS和CS评分,该产物有4种限制性氨基酸分别为Thr、Met、Cys和Lys;根据EAAI值,燕麦分离蛋白消化产物是优质蛋白源。燕麦分离蛋白消化产物可显著促进肠内分泌细胞CCK的合成和分泌,后续研究将进一步确定起主要作用的是混合物中的肽类成分还是游离氨基酸;此外,燕麦分离蛋白消化产物发挥促CCK分泌活性的分子机制也需深入研究。本研究旨在为进一步研究燕麦分离蛋白胃肠消化产物的营养功能提供参考。
