MMRd相关子宫内膜癌分型及治疗进展
2021-12-31滕银成
殷 倩,滕银成
上海交通大学附属第六人民医院妇产科,上海 200233
子宫内膜癌(endometrial carcinoma,EC)是最常见的妇科恶性肿瘤之一,其发病率和死亡率仍在持续增加,美国目前大约有727 000例存活、63 230例新发及11 315例死亡的EC 病例[1]。其中,3%~5%的患者具有家族聚集性,是由于错配修复基因遗传性致病突变引起的,又称林奇综合征(Lynch syndrome,LS)或遗传性非息肉病性结直肠癌(hereditary non-polyposis colorectal cancer,HNPCC),主要的基因突变包括MLH1(mutL homolog 1)、MSH2(mutS homolog 2)、MSH6(mutS homolog 6)及PMS2(PMS1 homolog 2)。LS 女性一生患EC 的风险为40%, 患卵巢癌的风险为10%~12%。 对于LS,Eikenboom 等[2]认为,这一疾病的妇科疾病特征差异性很大,需统一的、有循证医学依据的指南。然而,对于大多数散发EC 病例,非遗传因素所致的错配修复基因缺陷(mismatch repair deficiency,MMRd)更为常见,其中,造成MSH2表达缺失的最主要原因是体细胞MLH1基因启动子区高度甲基化[3],占MMRd 的61.8%。遗传性MLH1启动子甲基化非常罕见,故MLH1启动子甲基化是体细胞病变的代表性标志[4]。此外,体细胞错配修复相关致病基因的等位基因双突变也可造成MMRd,其发生率为3.5%[5]。DNA 错配修复可以识别和修复不匹配碱基(如C-T)、重复序列中插入性和缺失性异常。MMR 功能缺失则错配的碱基不能纠正而导致超突变,突变频率增加100~1 000倍。同时由于插入/缺失不能纠正,不可避免造成DNA 复制过程产生错误,导致碱基重复序列的长度存在很大差异,形成微卫星不稳定状态。然而,错配修复基因功能缺失并非修复障碍错配碱基这一方面的问题,更重要的是降低了错配修复通路对受损DNA 的识别能力,使得引起细胞凋亡的敏感性受损[6-7]。MMRd的主要致癌作用是减少细胞凋亡和增加细胞周转率[8],在MMRd 相关的EC 中,临床特征存在显著差异,治疗的方法及治疗效果也显著不同,需要进行仔细的区别,以进行更加精准化的治疗。本文对此进行综述,以供临床参考。
1 MMRd相关子宫内膜癌分型
2014 年美国妇产科医师协会(American College of Obstetricians and Gynecologists,ACOG)和2020 年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)子宫体肿瘤指南均要求对所有EC患者进行MMRd 分子筛查[9-10]。大型meta 分析显示,28%的子宫内膜肿瘤免疫组化提示错配修复基因表达异常,31%表现为微卫星不稳定(microsatellite instability,MSI),但是其中只有15%的免疫组化异常和19%的MSI与LS 相关,其他的异常可能是MLH1启动子区甲基化及体细胞突变造成的[11]。目前筛查的主要方法是肿瘤组织免疫组化/微卫星不稳定检测。如果免疫组化检测发现错配修复基因蛋白表达缺失或存在微卫星不稳定状态,则进一步行MLH1启动子区甲基化检测,根据结果再进一步对MLH1启动子区没有甲基化的患者进行胚系或(胚系检测为阴性时)肿瘤组织错配修复基因外显子或全基因测序(图1)。根据检测的结果,EC-MMRd/MSI-H 至少被分为3 个亚型: ①MLH1高度甲基化型EC (MLH1-hypermethylationged EC,EC-met),是MLH1基因启动子区异常高度甲基化导致MLH1基因转录沉默,通常发生在非遗传性病例。②LS 相关EC (Lynch syndrome associated EC,EC-ls)。LS为常染色体显性遗传疾病,是由于错配修复基因胚系致病突变,导致患者多器官发生MMRd/MSI-H 肿瘤。EC 常是LS 患者除结直肠癌以外的前哨肿瘤。③体细胞错配修复相关致病基因的等位基因双突变型EC (mismatch repair gene double somatic pathogenic variants,EC-dspv),该型EC 的MMRd/MSI-H既不是错配修复基因胚系致病突变引起也不是MLH1 启动子区高度甲基化所致,而是体细胞错配修复基因中的某个基因的等位基因同时失活造成的。另外在基因测序过程中可能会发现一些基因组不明意义的突变,其在EC发生及发展中的作用尚未被完全了解[12]。
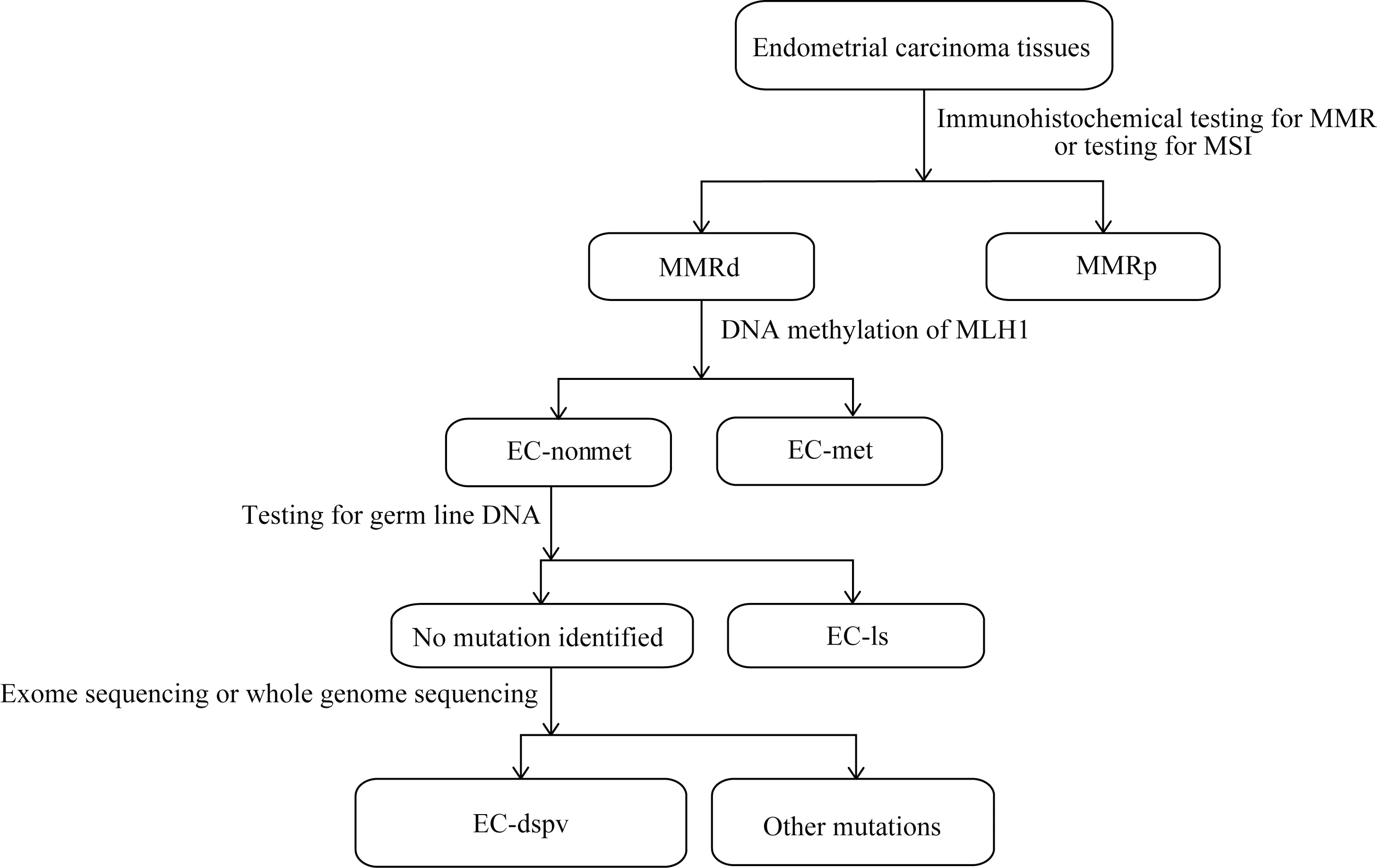
图1 子宫内膜癌MMRd分子筛查Fig 1 MMRd molecular screening for endometrial carcinoma
2 不同类型MMRd子宫内膜癌的临床特征
为探索不同病理及分子类型用于免疫检查点抑制剂治疗的检测靶标的可行性,各种不同病理类型的EC 被深入探究。其中,去分化EC(dedifferentiated endometrial carcinoma,DDEC)作为子宫内膜样癌中少见的具有高度恶性行为的类型被重视,其在EC 中占比约为9%[13]。在EC 标本中去分化成分常与分化较好的成分并存,其预后比分化为G3 子宫内模样癌更差,50%~58%的晚期EC被发现存在未分化成分,且40%的患者在15d~20 个月死亡。在去分化EC 中MMRd 占比高达58%[14]。Ono 等[15]报道在含有去分化成分的EC 中,高于50%的患者存在错配修复基因缺陷,且该错配修复基因缺陷与程序性死亡蛋白-1(programmed death-1,PD-1)的配体PD-L1 的高表达密切相关。此外,对于病理类型为浆液性癌的EC 年轻患者,Colon等[16]建议应进行POLƐ的核酸外切酶域错配修复蛋白的免疫组化检测,这些检测除了可以检测其与LS 的关系并分析其预后外,还可识别其应用免疫检查点抑制剂治疗的可能性。
Pasanen 等[17]发现了无错配修复基因缺陷(mismatch repair proficiency,MMRp) EC 和EC-MMRd的临床特征存在显著差异:相较于EC-MMRp,ECMMRd患者发病年龄较大、病理分级高(G3)、肿瘤分期晚(Ⅱ- Ⅳ)、 瘤体体积大、 淋巴血管侵犯(lymphovascular invasion,LVI)发生率高且淋巴结转移率高。EC-MMRd 与EC-MMRp 复发时侵犯的淋巴结群有所不同,EC-MMRd 患者后腹膜淋巴结复发占比高,而EC-MMRp 患者的盆腔外远处复发占比高。此外,ECMMRd 常表现AT 丰富结构域1A (AT-rich interaction domain 1A,ARID1A)缺失,并与PD-L1 表达水平增加、肿瘤浸润性淋巴细胞增多相关。疾病预后方面,ECMMRd 组的5 年疾病特异性死亡率为19.3%,而ECMMRp 组为10.7%。而对于同为EC-MMRd 的内膜癌患者,MMRd 类型与肌层浸润深度、淋巴结转移、高分期显著相关。错配修复蛋白分别分析发现MLH1/PMS2蛋白缺失与肌层浸润深度相关,而MSH6 蛋白缺失与淋巴结转移显著相关[18],提示不同类型错配修复蛋白可作为疾病侵袭程度的评估。不难看出,相较于EC-MMRp,ECMMRd 恶性程度更高、预后较差。因此,应用免疫组化技术对EC 进行错配修复相关蛋白检测并进行相关的分型诊断十分必要。
在EC-MMRd 的亚组分析中,EC-met 患者的年龄最大[19],而EC-ls发病年龄较广(26~87岁),40~50岁是高发病年龄。病理特征方面,对于EC-ls 的研究较为深入。EC-ls 常发生在子宫下段,多以子宫内膜样癌为主要类型,但病理类型常多样化,其中未分化和去分化成分及透明细胞癌占比较高。肿瘤病理学分级方面,EC-ls 可有低级别和高级别癌混合存在。可见,异质性是LS相关EC的特征。Pasanen 等[17]将EC-MMRd 分为2 个亚组,分别为MLH1高度甲基化型EC(EC-met)及非MLH1高度甲基化型EC(EC-nonmet),其中,EC-met 占比高达76%。EC-met 患者发病年龄较高且血管淋巴间隙浸润和淋巴结转移发生率较高。预后生存方面,EC-met 的5 年疾病特异生存率和总体生存率分别为83.2%和71.3%。而ECnonmet的5 年疾病特异生存率和总体生存率分别为91.7%和83.3%[17]。而在Kim 等[19]的研究中,EC-met的3年无复发生存率为76%,显著低于EC-ls 组的89%;受制于数据量,该研究未能计算在同一条件下的EC-dspv 组的3 年无复发生存率。为明确EC-ls 和EC-dspv 的发生率之间的差异,Hampel 等[5]进行回顾性分析发现,虽然相较于EC-met,EC-ls 和EC-dspv 的发生率都很低,但后两者的发生率相当。可见,EC-MMRd/MSI-H 的3 个亚型中,EC-met 发病率最高,但预后较其他2 种亚型差,EC-ls 和EC-dspv发病率相当。
3 MMRd相关子宫内膜癌的免疫特征
发生在蛋白编码DNA 的非同义点的移码突变,如果不能即时修复,将导致产生移码肽(frame-shift peptides,FSPs)。FSPs是一种新的抗原,触发体液免疫和细胞免疫反应[7]。因此,无论是EC-ls 还是其他EC-MMRd 均可见肿瘤浸润性淋巴细胞围绕在肿瘤细胞巢周围。既然产生免疫反应,那么肿瘤细胞是如何进行免疫逃逸的呢?一般通过3个步骤完成:一是免疫杀灭,主要组织相容性复合物1 类(major histocompatibility complex class I,MHC1)分子把FSPs 递呈到细胞的表面,细胞毒性T 淋巴细胞识别并杀灭这些细胞;二是免疫平衡,肿瘤细胞在被杀灭之前随机性获得PD-L1的激活性突变,控制免疫系统在局部呈静止状态,避免肿瘤细胞被杀灭;三是免疫逃逸,这些暂时没有被杀灭的肿瘤细胞努力获得MHCI或MHCII的失活性突变,比较常见的是B2M(beta-2-microglobulin)突变[20],使得不能把FSPs 递呈到细胞表面,至此肿瘤细胞完成了免疫逃逸[21-22]。而在对于肿瘤浸润性淋巴细胞的进一步研究中,Mariya等[23]发现,与CD8+T 细胞相关的MHC1的表达水平与子宫内膜癌患者中检测到的MMRd 无显著相关。 但在Bohaumilizky 等[24]的研究中,不同亚型的EC-MMRd 却有显著差异,EC-ls 的基质部分CD8+T 细胞数量、PD-L1的表达水平及B2M突变频率均显著高于散发性ECMMRd。Ramchander 等[25]研究了EC-ls(25 例),ECmet(33 例)和EC-MMRp(35 例)的分子表达及免疫细胞浸润情况,发现EC-ls 肿瘤组织边缘的CD3+、CD8+、CD45RO+及PD-1+T 淋巴细胞数量均显著高于EC-met 和EC-MMRp,而在EC-met 和EC-MMRp 2 组间差异无统计学意义。此外,该团队还发现,肿瘤组织中心CD8+T 细胞的数量预测模型可以很好地预测错配修复的状态,其敏感性为70%,特异性为100%。由上述研究结果可知,EC-MMRd 和EC-MMRp 的免疫特征是否存在差异尚无明确定论,但不同EC-MMRd亚型之间的免疫特征差异提示了将免疫检查点抑制剂应用于EC-MMRd 患者治疗的可能。
4 MMRd相关子宫内膜癌的治疗和预后
如临床特征部分所述,EC-MMRd 预后较EC-MMRp差。此外,在EC-MMRd的不同亚型间,疾病预后也有差异。研究[26]发现EC-met 的5 年生存率显著低于ECMMRp及EC-nonmet,尽管根据高危因素进行了化疗、放疗或化疗+放疗,EC-met 的复发率显著高于EC-MMRp,高发生率在后腹膜的复发方面更加显著。对于高危型ECMMRd,与单独采用放疗比较,采用化疗联合放疗并不能使患者的生存获益。这些证据表明MMRd 可能与铂耐药相关,可能是对放射敏感的预测因子。因此对于存在高危因素需要辅助治疗及后腹膜淋巴结复发的EC-met,采用单独放射治疗可能是合适的[27]。
子宫内膜样癌细胞及肿瘤微环境对免疫调节可能有反应。首先是EC 细胞表达的PD-L1、PD-L2 和CD4+、CD8+T 细胞表面的PD-1 受体结合,激活PD-1 信号通路抑制肿瘤微环境的免疫反应。第二是POLƐ高度突变型和EC-MMRd/MSI-H具有更多的肿瘤特异性新抗原,招募更多CD3+及CD8+肿瘤浸润性淋巴细胞到肿瘤组织中,以上调免疫检查点及对肿瘤细胞进行细胞毒性杀灭。这些特性为EC 的免疫治疗提供了最佳靶点。最新研究表明,在初治的EC 中约有30%为MSI-H/MMRd,在复发的EC 中也有13%~30%[28]。Le 等[29]进行的II 期临床试验,为免疫治疗转移复发EC 的有效性提供了最早证据。由于ECMMRd 的免疫学特点,以及基于前期临床试验的结果[30],美国食品与药品监督管理局(Food and Drug Administration,FDA)于2017 年将免疫检查点抑制剂用于MMRd/MSI-H 实体肿瘤的治疗。近来的II 期临床试验KEYNOTE-158 进一步证明针对进展期EC 免疫治疗的有效性。 该研究入组49 例EC 患者, 派姆单抗(pembrolizumab)治疗的总有效率为57%,其中完全缓解率为16%,部分缓解率为41%[31]。2019 年发表的II 期临床试验报道了乐伐替尼(lenvatinib,多靶点靶向药物)结合帕姆单抗用于治疗晚期及复发EC 的结果,总的反应率为38%,无进展生存期达到7.5 个月。其中EC-MMRd的反应率为64%,EC-MMRp 的反应率为36%[32]。据此结果NCCN 2020 年子宫体肿瘤诊治指南推荐派姆单抗治疗MMRd 的晚期和复发EC,而对于MMRp 的EC 推荐使用派姆单抗联合乐伐替尼治疗。此外,Ramos 等[33]证明,在EC-MMRd中除了高表达PD-L1外,也存在着免疫检查点分子TIM-3 (T cell immunoglobulin and mucindomain containing-3)的高水平表达。Sloan 等[34]在此基础上进一步探究,发现TIM-3 较PD-L1 对肿瘤分级起着更重要的作用。
综上所述,基于错配修复基因缺陷与否对EC 进行分类,并进一步对EC-MMRd 归类为3 种亚型,对EC 精准化诊治及预后评估有着极为重要的意义。相较于ECMMRp 患者,EC-MMRd 患者恶性程度较高且预后更差。而同为EC-MMRd患者,不同亚型间的临床特征及免疫特征也不尽相同,这为探索对EC-MMRd患者新的治疗手段提供理论基础。已有的临床试验提示,应用免疫检查点抑制剂治疗EC-MMRd/MSI-H 可有效提高疾病缓解率并延长无进展生存期。此外,对于诊断为LS 相关EC 的患者,需强调进行其他恶性肿瘤如大肠癌的筛查及随访,同时可对其家系展开疾病筛查。
5 展望
目前不同药物组合的临床试验正在进行,如免疫抑制剂联合化疗或联合乐伐替尼的临床试验(KEYNOTE-775、LEAP-001、NRG-GY018)、多腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂单独或联合免疫抑制剂临床试验(NCTO 3951415、NCTO 3572478、NCTO 3604262)和TIM-3检查点抑制剂临床试验(NCT 03489343、 NCT 02817633、 NCT 03680508、NCT 03652077、NCT 0260826)等。这些临床试验结果可能为精准治疗提供更好的依据并提供最佳的药物联合。虽然这些临床试验并没有把EC-MMRd 作为单独的研究组,也没有更进一步的MMRd 的亚组试验,但最终的分层结果分析可为整个子宫内膜癌及MMRd 相关子宫内膜癌的精准治疗提供更加充分的证据和更加合理的治疗方案。
