异鼠李素抗肿瘤作用机制的研究进展
2021-12-30赵方舒侯林杨颖尹怡铭王晓晴倪雯婷孙允红李保宏田景振
赵方舒 侯林 杨颖 尹怡铭 王晓晴 倪雯婷 孙允红 李保宏 田景振

中图分类号 R979.1 文献标志码 A 文章编号 1001-0408(2021)24-3054-06
DOI 10.6039/j.issn.1001-0408.2021.24.19
摘 要 目的:为异鼠李素的进一步研究和新药开发提供依据。方法:收集文献,就近年来异鼠李素抗肿瘤活性相关作用机制的研究进展进行综述。结果与结论:异鼠李素是一种黄酮类化合物,其抗肿瘤作用机制主要包括阻断肿瘤细胞的细胞周期(S期阻滞、G2/M期阻滞及G0/G1期阻滞)、诱导肿瘤细胞凋亡、抑制肿瘤细胞迁移和侵袭、诱导活性氧的产生、增强抗肿瘤药物活性、抑制致癌基因表达或增加抑癌基因表达等,可通过调控磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白、Ras/丝裂原激活蛋白激酶、Wnt/β-联蛋白等信号通路发挥抗肿瘤作用。但目前大部分研究还停留在体外细胞实验阶段,研究人员应尽快建立动物模型对相关作用机制进行体内实验验证,同时需对异鼠李素的成药性进行分析,以加快该化合物的新药开发进程。
关键词 异鼠李素;抗肿瘤;作用机制;进展
基金项目:山东省自然科学基金资助项目(No.ZR2019QH- 007);山东省重点研发计划(重大科技创新工程)项目(No.2020- CXGC010505);山东省中医药科技项目(No.2020M009)
硕士研究生。研究方向:中药新药研发。E-mail:zfs13176019640@ 163.com
通信作者:教授,博士生导师。研究方向:中药新药研发与中药抗病毒。E-mail:tianjingzhen@163.com
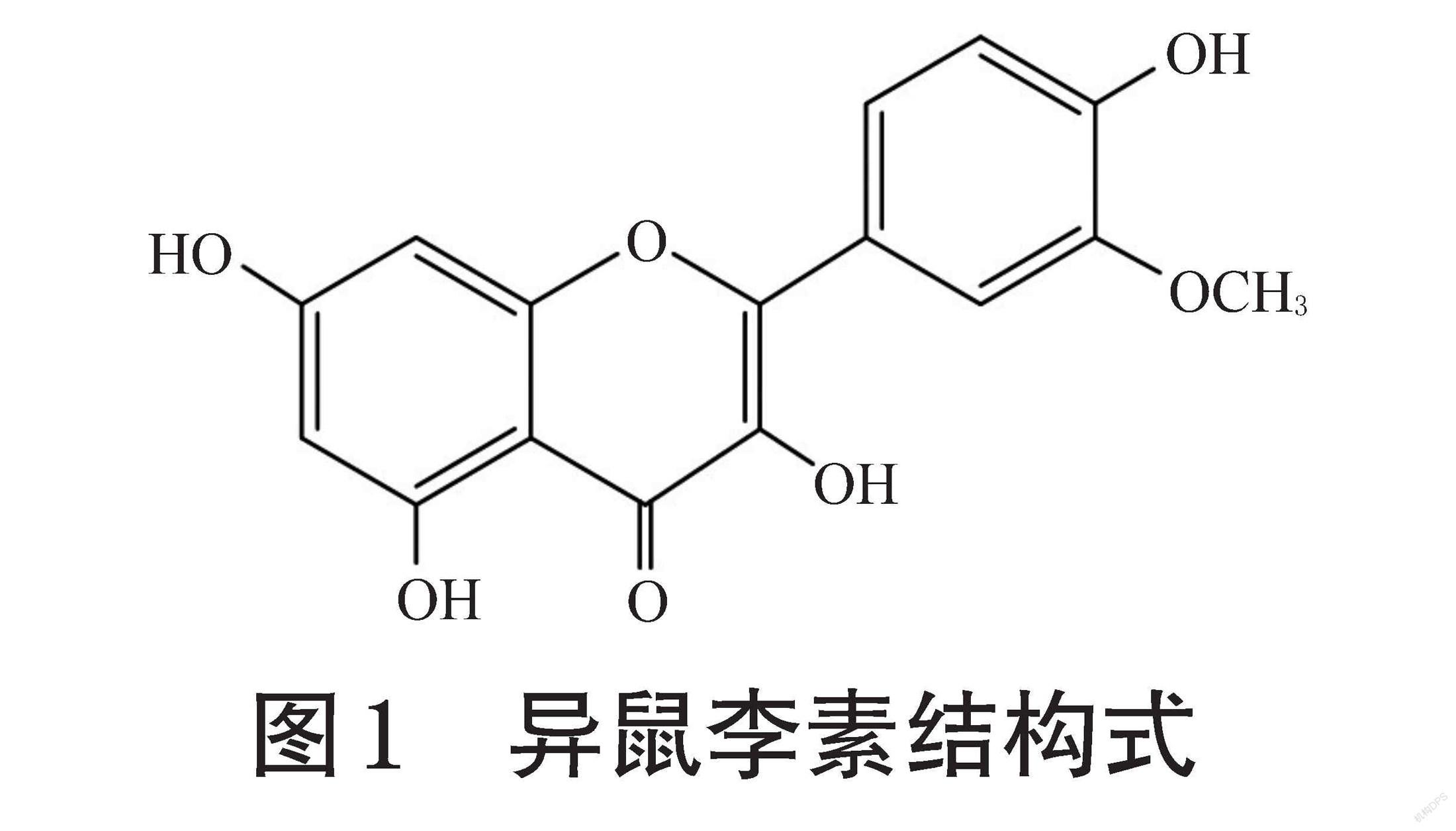
恶性肿瘤是世界各国普遍关注的一项公共卫生问题。近年来,我国的恶性肿瘤防治负担较重,亟需探索更为有效、安全的抗肿瘤药物[1]。目前,多种黄酮类成分已被证实可在体内外发挥抗肿瘤活性,如芦丁[2]、槲皮素[3]、山柰酚[4]等。异鼠李素即3,5,7-三羥基-2-(4-羟基-3-甲氧基苯基)苯并吡喃-4-酮(结构式见图1),也称为3′-O-甲基槲皮素,是一种黄酮类化合物,是槲皮素的直接代谢物,其大量存在于水果、蔬菜和茶中,也广泛存在于沙棘、银杏叶和槐米等多种中药材中[5-7]。研究表明,异鼠李素能抑制各种类型的肿瘤,包括宫颈癌、胃癌、皮肤癌、结肠癌、肺癌等[8-12]。基于此,笔者收集相关文献,就近年来异鼠李素抗肿瘤活性相关作用机制的研究进展进行了综述,以期为该成分的进一步研究和新药开发提供依据。
1 阻滞肿瘤细胞的细胞周期
1.1 S期阻滞
研究表明,周期蛋白依赖性激酶(Cdks)可与周期蛋白(cyclin)结合形成异二聚体,该异二聚体可推动细胞周期的进展。其中,Cdk2/cyclin E复合物对驱动细胞从G1期向S期跃迁起着关键作用。cyclin A是DNA复制所必需的蛋白,主要在S期和G2期表达[13]。Wang等[14]使用异鼠李素处理人晚期胰腺癌PANC-1细胞后,发现处于S期的细胞显著增多,处于G1期的细胞显著减少,其机制可能是由于异鼠李素增加了PANC-1细胞中Cdk2蛋白的表达,促进了S期的启动,同时降低了细胞内cyclin A的表达,抑制了DNA的复制,进而抑制S期的进展,最终将细胞阻滞在S期。在这一过程中,Ras/丝裂原激活蛋白激酶(MAPK)信号通路下游级联蛋白丝裂原激活蛋白激酶激酶(MEK)和细胞外调节蛋白激酶(ERK)的磷酸化水平明显降低,而Ras蛋白的表达水平无变化,说明异鼠李素可能通过调控Ras/MAPK信号通路来实现PANC-1细胞的S期阻滞。Luan等[11]将含异鼠李素的小鼠血清作用于人HCT116和SW480两种结肠癌细胞后发现,异鼠李素可通过诱导细胞S期阻滞来抑制这两种结肠癌细胞的生长。此外,Wu等[15]研究了异鼠李素和异鼠李素-3-葡萄糖醛酸苷对人乳腺癌MCF-7细胞的抑制活性,结果发现,二者均可通过S期阻滞、减少处于G2/M期和G0/G1期的细胞数量来抑制肿瘤细胞的增殖,且异鼠李素的阻滞作用强于异鼠李素-3-葡萄糖醛酸苷。
1.2 G2/M期阻滞
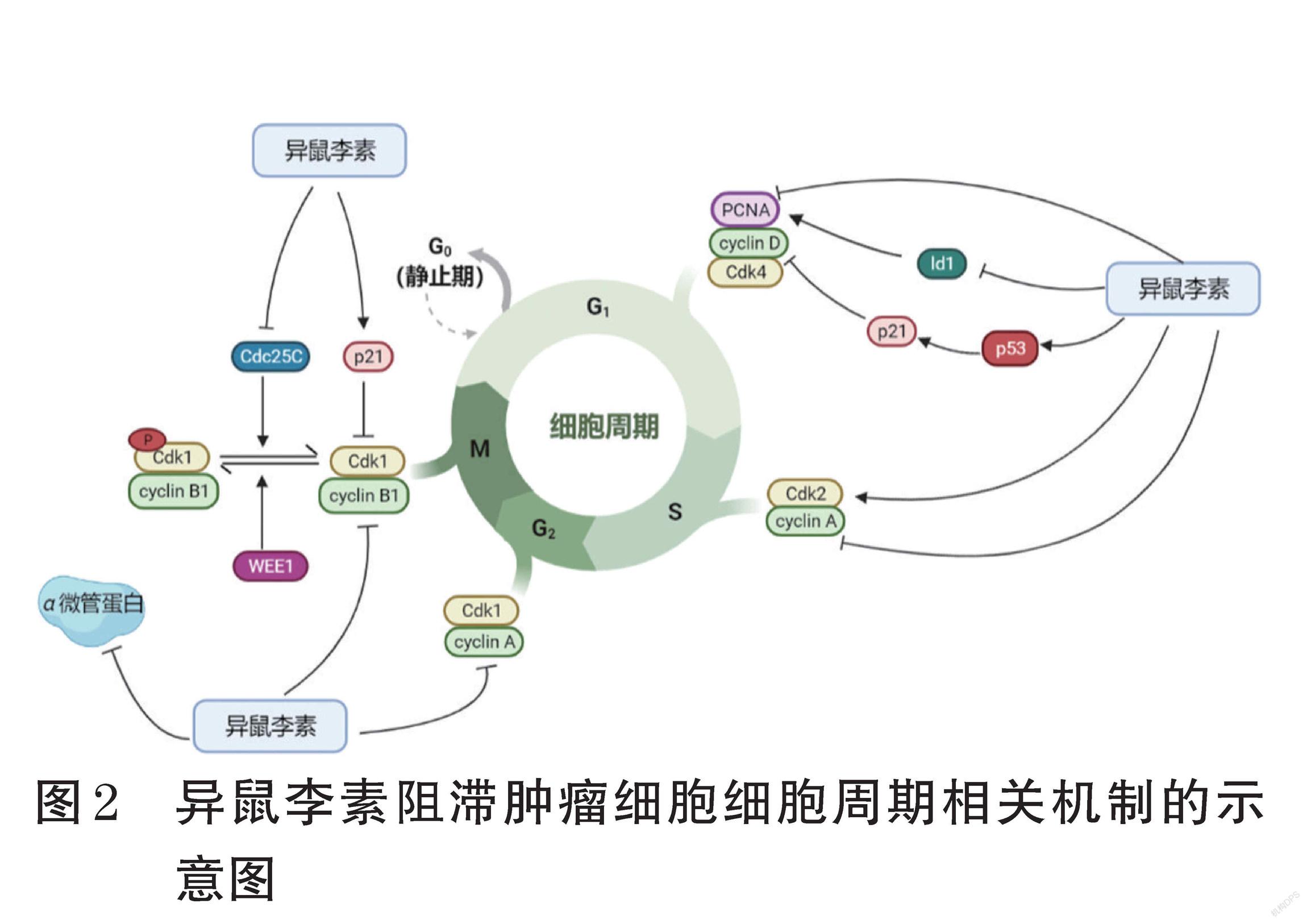
研究表明,异鼠李素对多种肿瘤细胞有G2/M期阻滞的作用[16-21]。与G2/M期有关的蛋白有cyclin A、cyc- lin B1、Cdk1、Cdk2、细胞分裂周期蛋白25同源蛋白C(Cdc25C)、酪氨酸激酶Wee1等,其中Wee1可催化Cdk1上Y15位点的特异性磷酸化,使Cdk1失活;而Cdc25C可使该位点去磷酸化,从而抵消Wee1对Cdk1的抑制作用[16];Cdc25C还可在M期启动阶段进入细胞核,激活Cdk1/cyclin B1异二聚体,进而启动有丝分裂[17]。Choi等[18]研究表明,用异鼠李素处理人肝癌Hep3B细胞后,细胞内cyclin A、cyclin B1的表达显著减少,Cdks抑制因子p21蛋白的表达显著增加,且通过免疫共沉淀实验发现p21可分别与Cdk2、细胞分裂周期蛋白2(Cdc2)结合形成蛋白复合物,从而抑制后二者的活性,表明异鼠李素可通过诱导p21蛋白的表达抑制Cdk2 和Cdc2在细胞周期进程中的作用,由此抑制G2/M期进展。Park等[19]研究也发现,异鼠李素可增加人膀胱癌T24细胞中p21蛋白的表达,进而抑制Cdk1的活性,使细胞从G2期过渡到M期受阻;该研究还发现,在此过程中,调节细胞增殖的腺苷一磷酸活化蛋白激酶(AMPK)的下游分子——哺乳动物雷帕霉素靶蛋白(mTOR)、p70核糖体S6蛋白激酶(p70S6K)和UNC-51样激酶1(ULK1)的表达水平也显著降低,推测异鼠李素还可通过抑制AMPK/mTOR信号通路而发挥G2/M期阻滞作用;此外,该研究还指出,具有抑制细胞周期作用的Wee1蛋白的表达水平也显著降低,推测可能是由异鼠李素激活了某种负反馈调节途径所导致的。Wei等[8]用异鼠李素处理人宫颈癌HeLa细胞后发现,其可造成细胞G2/M期阻滞;蛋白质印迹法分析结果表明,细胞内Cdc25C、Cdk1、cyclin B1和作为微管组成蛋白之一的α微管蛋白的表达均显著下降,但细胞周期检测点激酶2(Chk2)、Cdc25C和Cdk1的磷酸化水平有所升高。另外,Li等[20]和Jaramillo等[21]的研究结果也表明,异鼠李素可通过阻滞G2/M期而抑制人SW480、HCT116、HT-29等3种结直肠癌细胞的增殖,与其他研究不同的是,这两项研究认为异鼠李素增强了细胞中cyclin B1的表达、降低了蛋白激酶B(PKB,又称Akt)的磷酸化水平,提示异鼠李素可能是通过抑制磷脂酰肌醇3激酶(PI3K)/Akt/mTOR信号通路而阻滞细胞周期。
1.3 G0/G1期阻滞
异鼠李素在人食管癌Eca-109细胞、人胃癌MKN28细胞、人肺癌A549细胞和小鼠肺癌Lewis细胞的体内实验中均表现出G0/G1期阻滞作用,这与异鼠李素可造成DNA结合抑制剂1(Id1)、cyclin D1和增殖细胞核抗原(PCNA)表达减弱,而p53和p21蛋白表达增强有关[22]。其中,Id1可以提高cyclin D1的表达水平,cyclin D1与Cdk4结合成二聚体后可促进细胞从G1期进入S期,若Id1的表达受到抑制,则cyclin D1的水平会下调,进而使细胞周期进程受到阻滞[23-25]。有研究指出,PCNA在细胞增殖的启动中起重要作用,其表达减少将会使DNA合成受阻,导致细胞无法进入S期而停留在G1期[26]。
异鼠李素阻滞肿瘤细胞细胞周期相关机制的示意图见图2。
2 诱导肿瘤细胞凋亡
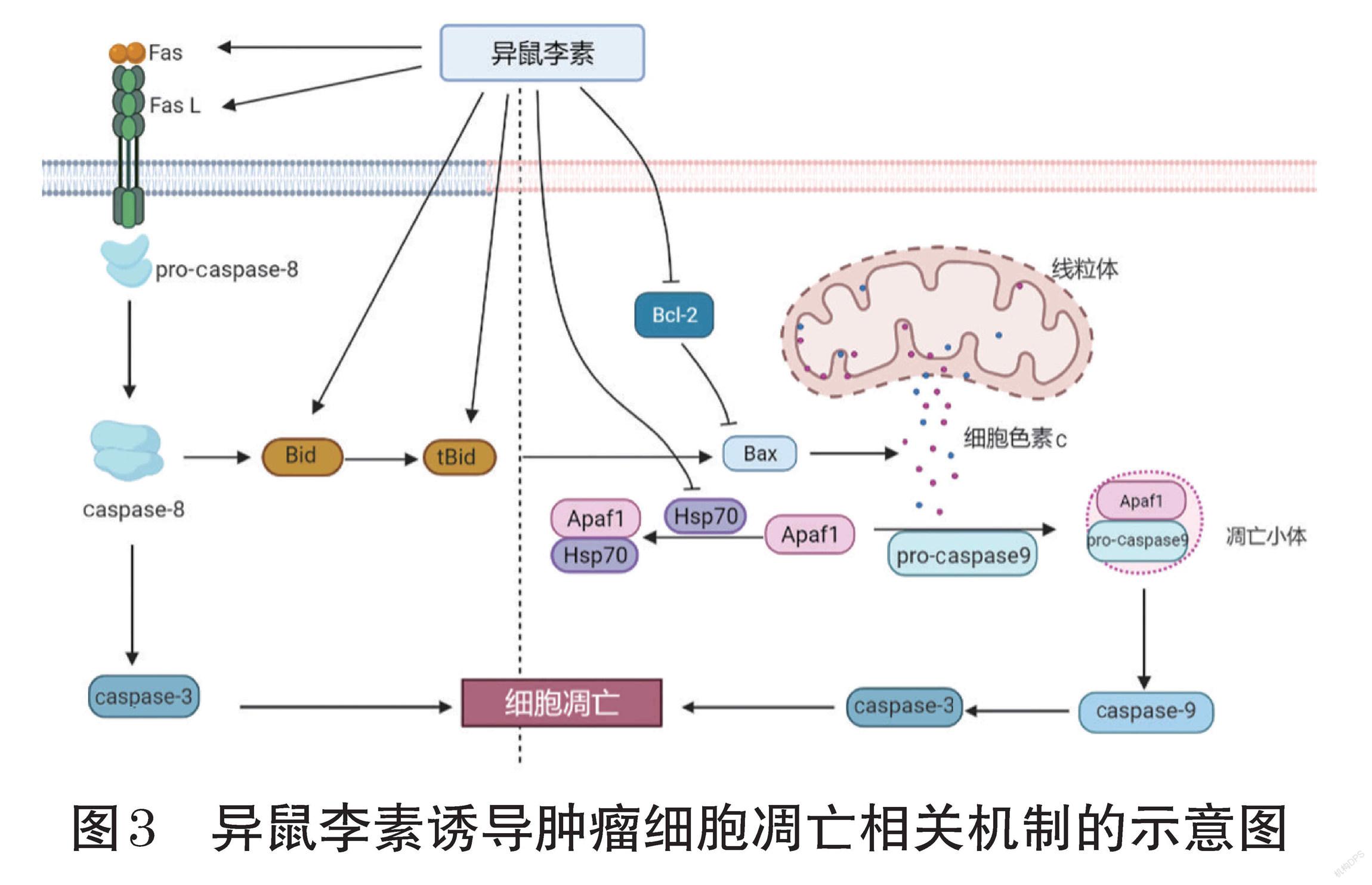
胱天蛋白酶(caspase)是细胞凋亡机制的核心,其既是凋亡的起始者,又是凋亡的执行者[27]。有研究指出,异鼠李素既可以激活与caspase-8有关的外源性凋亡途径,也可以通过激活caspase-9启动线粒体内源性凋亡途径。外源性凋亡发生于死亡受体Fas及其配体FasL结合时[28]。相关研究表明,异鼠李素可增加Fas和FasL的表达,使之形成死亡诱导信号复合体(DISC),促进caspase-8前体(pro-caspase-8)的组装并激活生成caspase-8,最终启动外源性细胞凋亡[18-19]。线粒体通透性增加、细胞色素c等分子释放到细胞质可导致细胞内源性凋亡,这一过程与B细胞淋巴瘤2(Bcl-2)家族蛋白中促凋亡蛋白和抗凋亡蛋白表达的失衡有关[27]。异鼠李素可以降低人膀胱癌T24细胞、人肝癌Hep3B细胞中抗凋亡蛋白Bcl-2的表达,增加促凋亡蛋白Bcl-2关联X蛋白(Bax)、BH3结构域凋亡诱导蛋白(Bid)和截短型Bid蛋白(tBid)的表达,增强caspase-8活性[18-19]。线粒体膜电位是衡量线粒体功能的重要指标,有研究表明,异鼠李素可以降低线粒体膜电位,引起线粒体去极化,使线粒体膜通透性增加,促进细胞色素c从线粒体内被释放[29]。发动蛋白相关蛋白1(Drp1)是一种与线粒体分解有关的膜分解蛋白,当Drp1在S616位点发生磷酸化后,其磷酸化产物可以促进线粒体分解,而在S637位点的磷酸化产物则会抑制线粒体分解。研究表明,异鼠李素联合氯喹可以促进钙调蛋白依賴性蛋白激酶Ⅱ(CaMKⅡ)在T286位点的磷酸化,并促使Drp1在S616位点发生磷酸化并向线粒体转移,从而加速细胞色素c的释放,进而启动线粒体凋亡途径[30]。
细胞色素c释放到细胞质后可形成细胞色素c-凋亡蛋白酶活化因子1(Apaf1)-caspase-9凋亡体复合物,进而促进caspase的激活。热休克蛋白(HSP)可在肿瘤细胞中与Apaf1结合,使Apaf1无法与细胞色素c结合形成凋亡小体,从而影响caspase-9在细胞质内的级联反应,最终抑制肿瘤细胞凋亡。Luan等[11]发现,结肠癌细胞中HSPa1a、HSPa1b、HSPa8等3种HSP70家族蛋白的表达水平均有所升高,而经异鼠李素处理后,上述3种蛋白的表达水平均明显下降,表明异鼠李素可通过抑制上述3种蛋白的表达而阻止肿瘤细胞的生长。
caspase-3是内源性和外源性凋亡途径中共同的下游因子。多腺苷二磷酸核糖聚合酶(PARP)是caspase-3的底物,PARP被剪切是caspase-3激活的指标,也是细胞凋亡的重要标志。相关研究表明,在经异鼠李素处理的人肝癌Hep3B细胞、膀胱癌T24细胞和肺癌A549细胞中,激活的caspase-3与被剪切的PARP数量均显著增加,表明异鼠李素可通过诱导肿瘤细胞凋亡来发挥抗肿瘤作用[29]。
异鼠李素诱导肿瘤细胞凋亡相关机制的示意图见图3。
3 抑制肿瘤细胞迁移、侵袭
高度侵袭性肿瘤的特征之一是肿瘤组织具有较强的向正常组织迁移的能力,肿瘤细胞侵入邻近组织和脉管系统是肿瘤转移的第一步。抑制细胞迁移是治疗肿瘤转移的一种有前景的治疗方法。研究表明,异鼠李素可通过抑制上皮-间质转化(EMT)过程和减少基质金属蛋白酶(MMPs)的表达来抑制肿瘤细胞的黏附、迁移和侵袭。
EMT与肿瘤细胞增殖、迁移、转化密切相关。肿瘤细胞可在EMT过程中获得间质细胞的特性,失去上皮的特性,增强运动和侵袭能力[31],表现为间质标志物波形蛋白、N-钙黏着蛋白、锌指转录因子Snail等表达增加,上皮标志物E-钙黏着蛋白表达减少。MMPs超家族是调节细胞外基质动态平衡的重要酶系,可使肿瘤细胞获得降解细胞外基质(ECM)及突破ECM屏障的能力,MMP-2、MMP-9是这一蛋白酶家族中与肿瘤最为密切的因子。MMP-2又称明胶酶A,MMP-9又称明胶酶B,二者都可以降解ECM中的明胶,Ⅳ、Ⅳ、Ⅶ、Ⅹ型胶原蛋白和弹性纤维等,破坏基底膜的完整性,使肿瘤细胞沿着被破坏的ECM向周围组织浸润和转移[32],其中MMP-9还与肿瘤细胞的耐药性相关[33-34]。Luo等[35]研究结果表明,异鼠李素作用于人肺癌A549细胞后可以上调E-钙黏着蛋白的表达,下调波形蛋白、N-钙黏着蛋白、锌指转录因子Snail以及MMP-2、MMP-9的表达;同时,异鼠李素可显著抑制该细胞中ERK1/2和Akt的激活,且当Akt或ERK1/2过表达时,异鼠李素抑制EMT的作用将消失,从而证实异鼠李素是通过阻断Akt/ERK1/2信号通路来抑制肿瘤细胞的EMT。相似地,Cai等[36]用不同剂量异鼠李素处理雄激素非依赖型人前列腺癌DU145和PC3细胞后发现,异鼠李素可呈剂量依赖性地增加DU145和PC3细胞中E-钙黏着蛋白的表达,降低波形蛋白、N-钙黏着蛋白、MMP-2和MMP-9的表达;同时该研究还发现,在上述过程中异鼠李素并不改变细胞中PI3K、Akt和mTOR的蛋白表达水平,但却显著抑制了这3种蛋白的磷酸化水平,提示异鼠李素可能通过抑制PI3K/Akt/mTOR信号通路来抑制DU145和PC3细胞的迁移和侵袭。
4 诱导活性氧的产生
异鼠李素还具有增加活性氧(ROS)产生的作用。有研究发现,人肝癌Hep3B细胞经异鼠李素处理后,细胞内产生了大量ROS,使用ROS清除剂N-乙酰-L-半胱氨酸(NAC)后,细胞中的ROS积累有所减少,凋亡细胞数也有所减少,细胞周期阻滞和细胞活力均有所恢复,表明ROS的增加可能是异鼠李素抗肿瘤作用的关键因素[18]。CaMKⅡ的激活会导致ROS的大量产生,Hu等[30]研究发现,在人三阴性乳腺癌MDA-MB-231和BT549细胞中,异鼠李素和氯喹联合使用会激活CaMKⅡ,进而使细胞中的ROS明显增加,且超氧阴离子参与了异鼠李素和氯喹的抗肿瘤作用。Wu等[15]研究也发现,异鼠李素可造成人乳腺癌MCF-7细胞中过氧化氢和超氧阴离子的累积增加,表明其可通过激活ROS依赖性途径而发挥细胞毒性作用。
5 增强抗肿瘤药物活性
异鼠李素可以增强抗肿瘤药物的活性。研究表明,异鼠李素与铂类化合物(卡铂、顺铂)联用可增强铂类化合物抑制人肺癌A549细胞增殖、阻滞其细胞周期、诱导其凋亡等一系列抗肿瘤活性[37],进而有助于减少铂类化合物的用量,达到减少铂类化合物副作用的目的。Ramachandran等[9]研究表明,异鼠李素可以提高5-氟尿嘧啶、多柔比星、卡培他滨等3种化疗药物对人胃癌AGS细胞的生长抑制率。还有研究表明,异鼠李素可以通过降低核因子κB(NF-κB)的表达来显著增强卡培他滨的抗肿瘤作用,其与卡培他滨联合治疗能显著下调多种致癌基因产物的过度表达,如可抑制肿瘤组织中存活蛋白、X连锁凋亡抑制蛋白(XIAP)和细胞间黏附分子1(ICAM-1)的表达[38]。异鼠李素还可增强索拉非尼对小鼠肾癌Renca细胞生长的抑制作用,使后者的半数抑制浓度(IC50)从26.1 μmol/L 降至12.0 μmol/L,这可能与异鼠李素对Akt/mTOR通路以及丝氨酸/苏氨酸蛋白激酶(CRAF)/MEK/ERK通路的抑制作用有关[39]。
6 抑制致癌基因表达或增加抑癌基因表达
p53蛋白是肿瘤抑制因子之一,可通过调节细胞周期或通过参与DNA的修复来抑制肿瘤的形成和发展[40]。有研究发现,异鼠李素作用于人肺癌A549细胞后,可增加细胞内p53蛋白的表达[22]。c-myc是一种常见的原癌基因,可使细胞无限增殖,与多种肿瘤的发生有关。异鼠李素可以抑制人食管癌Eca-109细胞中c-myc的表达,同时可诱导细胞中p53蛋白的积累[23]。已有研究发现,异常激活的Src蛋白可以促进肿瘤细胞的增殖、侵袭、转移,而异鼠李素可以通过激活C-Src酪氨酸激酶(CSK)来抑制Src蛋白在Y529位点的磷酸化,进而抑制Src蛋白的活性,在人结肠癌HT29细胞的相关研究中发现,上述作用可能与异鼠李素抑制Wnt/β-联蛋白(β-catenin)和Akt/MAPK途径有关[41]。过氧化物酶体增殖物激活受体γ(PPARγ)也参与了肿瘤相关的各种代谢紊乱[42]。Ramachandran等[9]研究发现,异鼠李素可增强人胃癌AGS细胞中PPARγ的活性,并增加PPARγ的表达,且当使用PPARγ特异性抑制剂后,异鼠李素对胃癌细胞迁移与侵袭的抑制作用被逆转,说明异鼠李素可能是通过对PPARγ表达的调控来发挥抗肿瘤作用。
7 其他
已有研究表明,炎症和肿瘤的形成有很强的关联,一些炎症反应加速了肿瘤的形成[43],因此靶向抑制炎症和参与炎症过程的分子可能是良好的肿瘤防治策略。环氧合酶2(COX-2)是炎症反应的主要介质之一,其产物前列腺素E2(PGE2)具有一定的致癌作用[44]。Kim等[10]用10 μmol/L的异鼠李素处理人鳞状细胞癌A431细胞后发现,细胞内COX-2的表达几乎完全被抑制;同时,该学者还观察到,异鼠李素可通过抑制COX-2启动子的作用,进而抑制表皮生长因子(EGF)诱导的小鼠表皮JB6细胞癌变。Saud等[41]发现,与模型组小鼠相比,经异鼠李素处理的小鼠能更快地从结肠炎中恢复,其微腺瘤形成率、结直肠增生和鳞状化生程度、最终肿瘤发生率均显著低于模型组(P<0.05),表明异鼠李素可以通过抗炎而发挥肿瘤预防作用。此外,异鼠李素可通过抑制mTOR通路来诱导人肺癌A549、SPC-A1细胞收缩,减少细胞黏附[45];也可通过以腺苷三磷酸(ATP)非竞争性方式直接与MEK1结合,并以ATP竞争性方式与PI3K结合,进而抑制MEK1和PI3K的活性,以此来发挥抗皮肤癌的作用[10]。异鼠李素调控信号通路相关机制的示意图见图4。
8 結语
异鼠李素的抗肿瘤作用涉及多种机制,尤其在阻滞肿瘤细胞的细胞周期和促进肿瘤细胞凋亡方面尤为突出,且可以通过调控PI3K/Akt/mTOR、Ras/MAPK、Wnt/β-catenin等信号通路而发挥作用。笔者曾对上文中提到的蛋白进行网络药理学分析,发现在促凋亡作用涉及的蛋白中,Fas、Bcl-2、Bax、tBid、Apaf1以及细胞色素c均属于p53信号通路;在细胞周期涉及的蛋白中,Cdk1、Cdk2、cyclin B1、cyclin D1以及p53本身也参与了p53信号通路,推测异鼠李素可以通过部分调控p53信号通路而发挥抗肿瘤作用。总而言之,异鼠李素的抗肿瘤作用与抗增殖、促凋亡、抑制肿瘤细胞迁移和侵袭、抑制致癌基因表达或增加抑癌基因表达等途径有关,提示异鼠李素在抗肿瘤方面可能具有一定的预防能力和临床疗效。但目前的研究仍存在不足,如在异鼠李素可增强抗肿瘤药物活性这一方面,二者是如何起到协同作用的尚需研究者进一步探索;与异鼠李素调节肿瘤微环境相关的研究仍较少,如异鼠李素是否能抑制肿瘤血管生成、是否有增强免疫等作用仍有待研究;现阶段关于异鼠李素抗肿瘤机制的研究大部分还停留在体外细胞实验阶段,研究人员应尽快建立动物模型对相关作用机制进行体内实验验证;同时需对异鼠李素的成药性进行分析,如异鼠李素的溶解性、稳定性、生物利用度、半衰期、安全范围等,以加快该化合物的新药开发进程。
參考文献
[ 1 ] FENG R M,ZONG Y N,CAO S M,et al. Current cancer situation in China:good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun(Lond),2019,39(1):22.
[ 2 ] IMRAN M,RAUF A,ABU-IZNEID T,et al. Luteolin,a flavonoid,as an anticancer agent:a review[J]. Biomed Pharmacother,2019,112:108612.
[ 3 ] RAUF A,IMRAN M,KHAN I A,et al. Anticancer potential of quercetin:a comprehensive review[J]. Phytother Res,2018,32(11):2109-2130.
[ 4 ] IMRAN M,SALEHI B,SHARIFI-RAD J,et al. Kaempferol:a key emphasis to its anticancer potential[J]. Molecules,2019,24(12):2277.
[ 5 ] 张东,邬国栋.沙棘黄酮的化学成分及药理作用研究进展[J].中国药房,2019,30(9):1292-1296.
[ 6 ] LIU X G,WU S Q,LI P,et al. Advancement in the chemical analysis and quality control of flavonoid in Ginkgo biloba[J]. J Pharm Biomed Anal,2015,113:212-225.
[ 7 ] 李秋红,栾仲秋,王继坤.中药槐米的化学成分、炮制研究及药理作用研究进展[J]. 中医药学报,2017,45(3):112-116.
[ 8 ] WEI J,SU H L,BI Y,et al. Anti-proliferative effect of isorhamnetin on HeLa cells through inducing G2/M cell cycle arrest[J]. Exp Ther Med,2018,15(4):3917-3923.
[ 9 ] RAMACHANDRAN L,MANU K A,SHANMUGAM M K,et al. Isorhamnetin inhibits proliferation and invasion and induces apoptosis through the modulation of peroxisome proliferator-activated receptor γ activation pathway in ga- stric cancer[J]. J Biol Chem,2012,287(45):38028-38040.
[10] KIM J E,LEE D E,LEE K W,et al. Isorhamnetin suppresses skin cancer through direct inhibition of MEK1 and PI3K[J]. Cancer Prev Res(Phila),2011,4(4):582- 591.
[11] LUAN Y Q,LUAN Y P,ZHAO Y J,et al. Isorhamnetin in Tsoong blocks Hsp70 expression to promote apoptosis of colon cancer cells[J]. Saudi J Biol Sci,2019,26(5):1011-1022.
[12] DU Y R,JIA C,LIU Y,et al. Isorhamnetin enhances the radiosensitivity of A549 cells through interleukin-13 and the NF-κB signaling pathway[J/OL]. Front Pharmacol,2020,11:610772[2021-01-25]. https://doi.org/10.3389/fphar.2020.610772.
[13] PALMER N,KALDIS P. Less-well known functions of cyc- lin/CDK complexes[J]. Semin Cell Dev Biol,2020,107:54-62.
[14] WANG J L,QUAN Q H,JI R F,et al. Isorhamnetin suppresses PANC-1 pancreatic cancer cell proliferation through S phase arrest[J]. Biomed Pharmacother,2018,108:925-933.
[15] WU Q,KROON P A,SHAO H J,et al. Differential effects of quercetin and two of its derivatives,isorhamnetin and isorhamnetin-3-glucuronide,in inhibiting the proliferation of human breast-cancer MCF-7 cells[J]. J Agric Food Chem,2018,66(27):7181-7189.
[16] ELBÆK C R,PETROSIUS V,SØRENSEN C S. WEE1 kinase limits CDK activities to safeguard DNA replication and mitotic entry[J/OL]. Mutat Res,2020,819/820:111694[2020-02-25]. https://doi.org/10.1016/j.mrfmmm.2020.111694.
[17] 彭花,蔣孝华. Cdc25C和cyclin B1在细胞周期调控及肿瘤发生发展中的作用[J].现代医药卫生,2015,31(8):1170-1173.
[18] CHOI Y H. Isorhamnetin induces ROS-dependent cycle arrest at G2/M phase and apoptosis in human hepatocarcinoma Hep3B cells[J]. Gen Physiol Biophys,2019,38(6):473-484.
[19] PARK C,CHA H J,CHOI E O,et al. Isorhamnetin indu- ces cell cycle arrest and apoptosis via reactive oxygen species-mediated AMP-activated protein kinase signaling pathway activation in human bladder cancer cells[J]. Cancers(Basel),2019,11(10):1494.
[20] LI C,YANG X,CHEN C,et al. Isorhamnetin suppresses colon cancer cell growth through the PI3K-Akt-mTOR pathway[J]. Mol Med Rep,2014,9(3):935-940.
[21] JARAMILLO S,LOPEZ S,VARELA L M,et al. The flavonol isorhamnetin exhibits cytotoxic effects on human colon cancer cells[J]. J Agric Food Chem,2010,58(20):10869-10875.
[22] LI Q,REN F Q,YANG C L,et al. Anti-proliferation effects of isorhamnetin on lung cancer cells in vitro and in vivo[J]. Asian Pac J Cancer Prev,2015,16(7):3035-3042.
[23] MA G,YANG C L,QU Y,et al. The flavonoid component isorhamnetin in vitro inhibits proliferation and induces apoptosis in Eca-109 cells[J]. Chem Biol Interact,2007,167(2):153-160.
[24] 朱栋良,尹小平,王芳元.异鼠李素对胃癌细胞增殖及凋亡的影响[J].中国普外基础与临床杂志,2018,25(3):350-353.
[25] XIA X,YU Y,ZHANG L,et al. Inhibitor of DNA binding 1 regulates cell cycle progression of endothelial progenitor cells through induction of Wnt2 expression[J]. Mol Med Rep,2016,14(3):2016-2024.
[26] BOEHM E M,GILDENBERG M S,WASHINGTON M T. The many roles of PCNA in eukaryotic DNA replication[J]. Enzymes,2016,39:231-254.
[27] WONG R S Y. Apoptosis in cancer:from pathogenesis to treatment[J]. J Exp Clin Cancer Res,2011,30(1):87.
[28] GOLDAR S,KHANIANI M S,DERAKHSHAN S M,et al. Molecular mechanisms of apoptosis and roles in cancer development and treatment[J]. Asian Pac J Cancer Prev,2015,16(6):2129-2144.
[29] RUAN Y S,HU K,CHEN H B. Autophagy inhibition enhances isorhamnetin-induced mitochondria-dependent apoptosis in non-small cell lung cancer cells[J]. Mol Med Rep,2015,12(4):5796-5806.
[30] HU J J,ZHANG Y H,JIANG X X,et al. ROS-mediated activation and mitochondrial translocation of CaMKⅡ contributes to Drp1-dependent mitochondrial fission and apoptosis in triple-negative breast cancer cells by isorhamnetin and chloroquine[J]. J Exp Clin Cancer Res,2019,38(1):225-240.
[31] ZHANG Y,WEINBERG R A. Epithelial-to-mesenchymal transition in cancer:complexity and opportunities[J]. Front Med,2018,12(4):361-373.
[32] 袁发焕,王海燕,李惊子. ECM,MMPs/TIMPs及其调节研究进展[J].国外医学:生理、病理科学与临床分册,2000,20(2):93-96.
[33] NAGASE H,VISSE R,MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovasc Res,2006,69(3):562-573.
[34] FIORE E,FUSCO C,ROMERO P,et al. Matrix metalloproteinase 9(MMP-9/gelatinase B)proteolytically cleaves ICAM-1 and participates in tumor cell resistance to na- tural killer cell-mediated cytotoxicity[J]. Oncogene,2002,21(34):5213-5223.
[35] LUO W,LIU Q B,JIANG N,et al. Isorhamnetin inhibited migration and invasion via suppression of Akt/ERK-media- ted epithelial-to-mesenchymal transition(EMT)in A549 human non-small-cell lung cancer cells[J/OL]. Biosci Rep,2019,39(9):BSR20190159[2019-09-20]. https://doi.org/10.1042/BSR20190159.
[36] CAI F Z,ZHANG Y M,LI J W,et al. Isorhamnetin inhibited the proliferation and metastasis of androgen-independent prostate cancer cells by targeting the mitochondrion- dependent intrinsic apoptotic and PI3K/Akt/mTOR pathway[J]. Biosci Rep,2020,40(3):BSR20192826[2020-03-18]. https://doi.org/10.1042/BSR20192826.
[37] ZHANG B Y,WANG Y M,GONG H,et al. Isorhamnetin flavonoid synergistically enhances the anticancer activity and apoptosis induction by cis-platin and carboplatin in non-small cell lung carcinoma(NSCLC)[J]. Int J Clin Exp Pathol,2015,8(1):25-37.
[38] MANU K A,SHANMUGAM M K,RAMACHANDRAN L,et al. Isorhamnetin augments the anti-tumor effect of capecitabine through the negative regulation of NF-κB signaling cascade in gastric cancer[J]. Cancer Lett,2015,363(1):28-36.
[39] 杜倩倩,黄璐璐,刘春霞,等.异鼠李素与索拉非尼联合对肾癌的抑制作用及作用机制[J].药学学报,2019,54(8):1424-1430.
[40] DUFFY M J,SYNNOTT N C,CROWN J. Mutant p53 as a target for cancer treatment[J]. Eur J Cancer,2017,83:258-265.
[41] SAUD S M,YOUNG M R,JONES-HALL Y L,et al. Chemopreventive activity of plant flavonoid isorhamnetin in colorectal cancer is mediated by oncogenic Src and β-catenin[J]. Cancer Res,2013,73(17):5473-5484.
[42] JANANI C,RANJITHA KUMARI B D. PPAR gamma gene:a review[J]. Diabetes Metab Syndr,2015,9(1):46- 50.
[43] COUSSENS L M,WERB Z. Inflammation and cancer[J]. Nature,2002,420(6917):860-867.
[44] NAKANISHI M,ROSENBERG D W. Multifaceted roles of PGE2 in inflammation and cancer[J]. Semin Immunopathol,2013,35(2):123-137.
[45] 陈观平,李明乾,應栩华.异鼠李素通过mTOR通路抑制肺癌增殖、侵袭及其机制研究[J].中药材,2021,44(2):423-428.
(收稿日期:2021-07-12 修回日期:2021-10-28)
