白屈菜红碱固体脂质纳米粒的制备及其体外释放研究
2021-12-30赵义军叶晓楠林春盛孙健车明徽侯立强黑龙江中医药大学附属第二医院哈尔滨150001
赵义军,叶晓楠,林春盛,孙健,车明徽,侯立强(黑龙江中医药大学附属第二医院,哈尔滨 150001)
白屈菜红碱(chelerythrine,CHE)为苯并菲啶型生物碱,当处于常温条件时,其存在形式为浅白色或淡黄色粉末,主要分布在白屈菜、博落回、飞龙掌血与血水草等药用植物的叶、根内。白屈菜红碱在有丝分裂中能够调控肿瘤细胞的分布周期,由此有效阻滞肿瘤细胞增殖周期,抑制肿瘤细胞增殖和促使肿瘤细胞凋亡,如对胃癌、肝癌、肺癌细胞均效果显著[1-2]。但由于该化合物溶解度极低,半衰期短、在体内代谢较快,易出现不良反应,导致其应用存在一定局限性。为了解决上述问题,应合理延长药物的作用时间,减慢药物的释放速度。
经文献检索分析发现,对白屈菜红碱的新型递药系统的研究较为匮乏,有研究人员曾将其制备成为β-环糊精包合物,但包封率较低[3]。也有研究将白屈菜红碱制备成为明胶微球,但成本较高、重现性较差[4]。此外,还有将白屈菜红碱制备成为聚氰基丙烯酸丁酯纳米粒[5]、磁性纳米壳聚糖微球[6]、口服脂质体[7]、复合磁性温敏凝胶[8]、固体分散体[9]、磁性羧甲基壳聚糖纳米粒[10]、磁性多壁碳纳米管纳米粒[11]的报道,但其同样具有包封率低且制备工艺繁琐等缺点。固体脂质纳米粒(solid lipid nanoparticles,SLN)是指粒径在10~1000 nm的固体颗粒,是以固态天然或者合成的多种类脂质材料如脂肪酸、脂肪醇及卵磷脂、单硬脂酸甘油酯等为载体,将药物包裹或夹嵌于类脂核中形成的固态胶体颗粒。固体脂质纳米粒因其被包封在生理相容且耐受性优良的固体骨架之中,与传统剂型相比,具有毒性小,安全性与生物相容性高,可延缓药物释放,增加药物在体内吸收和靶向性,增强药物负载能力,防止药物排出和更灵活地调节药物释放等优点[12-14],被认为是有发展前景的药物载体。它是为数不多的同时具有传统胶体给药系统如乳剂、脂质体及聚合物纳米粒生理相容性好、可生物降解,物理稳定性高,可控制药物释放及有良好缓释性和靶向性的优点,同时又避免了有机溶剂不能完全去除的缺点,且易于大规模生产[15-16]。综上所述,本研究拟通过将药物制备成SLN以提高药物的包封率、载药量[17],并对其进行体外释放行为考察及对肝癌细胞的毒性实验,为白屈菜红碱新型递药系统的研发提供思路。
1 材料
LC-20AT 型岛津高效液相色谱仪(日本岛津公司);Diamonsil C18色谱柱[DIKMA(250 mm×4.6 mm,5 μm];85-2A型恒温磁力搅拌器(荣华仪器制造公司);透射电子显微镜(Tecnai高分辨型)[FEI公司(荷兰)产品];Zetasizer 3000HS型激光粒径分析仪[Malvem公司(英国)];TGL-16c 型高速离心机(上海安亭科学仪器厂);KQ5200DE型超声波清洗机(昆山市超声仪器有限公司);超净工作台[Heal Force公司(香港)];恒温水浴箱、空气浴振荡器(哈尔滨市东联电子技术开发有限公司);多功能酶标仪(美谷分子仪器);高压灭菌锅[ZEALWAY公司(美国)];细胞培养板、细胞培养瓶[Corning公司(上海)]。
白屈菜红碱原料药(美国MCE公司,质量分数:98.56%,货号:26018);白屈菜红碱对照品(中国食品药品检定研究院,含量:98%,批号:110807-201703);泊洛沙姆188(德国BASF公司,含量:95%,批号:WPWA544C);大豆卵磷脂(双旋微生物培养制品厂,批号:S100);纯净水(娃哈哈品牌);色谱甲醇(北京迪科马科技有限公司);RPMI-1640 液体培养基、10%优级胎牛血清、胰蛋白酶、二甲基亚砜(DMSO)(美国 Hyclone 公司);双抗(青霉素/链霉素)(华北制药厂);PBS、MTT 溶液(武汉博士德公司);5-Fu(USP级,含量:98%,上海金穗生物科技有限公司);其他试剂皆为市售分析纯。
2 方法与结果
2.1 白屈菜红碱固体脂质纳米粒的制备
乳化蒸发法[18]制备白屈菜红碱固体脂质纳米粒(CHE-SLN)。首先,向100%乙醇内加入适量的药物与脂质材料(单甘酯,GMC),超声溶解后,将适量大豆卵磷脂添加至该混合液内,微热处理,得到有机相,再将处方量的泊洛沙姆188(F-68)加入到纯水内溶解,得到水相。于1000 r·min-1磁力搅拌下,向水相内低速注入有机相,整个过程操作的温度应高于脂质材料的熔点,经过数小时搅拌,浓缩至1/4,再将此半透明体系迅速移至另一低温水相内混合,同时进行持续搅拌固化处理,制得CHE-SLN。
2.2 CHE-SLN包封率的测定
采用葡聚糖凝胶法,准确吸量1 mL的CHESLN混悬液,上Sepha-dex G-50柱,用蒸馏水洗脱,流速设定1 mL·min-1,用试管收集洗脱液,每管2 mL,合并显示蓝色乳光的部分(含CHE的SLN),之后用100%乙醇超声破乳,并稀释为50 mL,HPLC法测定CHE含量,测定条件为30%甲醇∶70%的三乙胺-乙酸-水(0.3∶2.4∶230)为流动相,进样量0.01 mL,流速1 mL·min-1,柱温30℃,测定波长264 nm[19-23]。精准吸取1 mL的CHE-SLN混悬液,用100%乙醇超声破乳,再稀释为50 mL,HPLC法测定CHE含量,计算包封率(EE),EE(%)=WE/WTotal×100%,WE为包封药物量,WTotal为总的药物量。CHE-SLN包封率为(63.84±3.9)%。空白对照、对照品及供试品色谱图见图1。
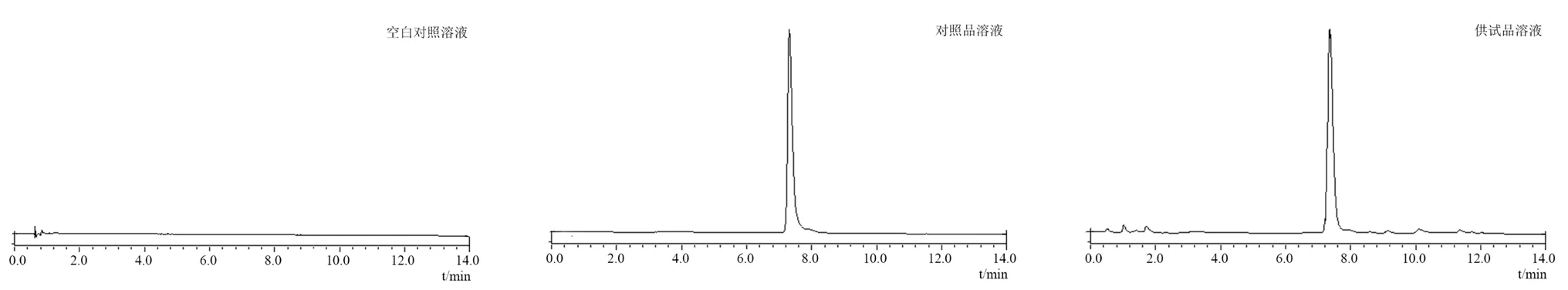
图1 白屈菜红碱固体脂质纳米粒高效液相色谱图Fig 1 HPLC chromatogram of CHE-SLN
2.3 正交设计优化CHE-SLN的处方和工艺
基于前期单因素分析所得结果,选择F-68浓度(A)、lecithin/单甘酯(GMC)之比(B)、主药/GMC之比(C)、GMC用量(D),通过L9(34)设计正交试验。具体因素和水平见表1,结果见表2、3。
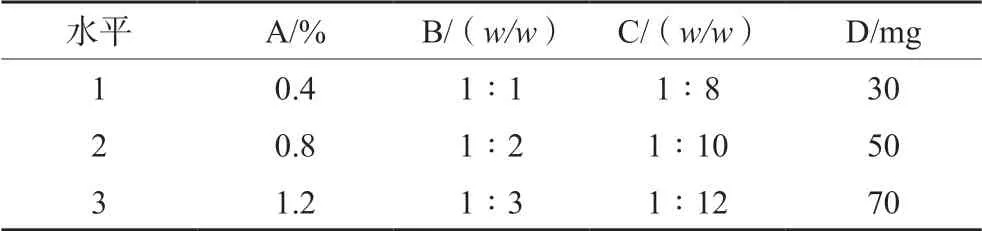
表1 因素和水平 Tab 1 Factor and level
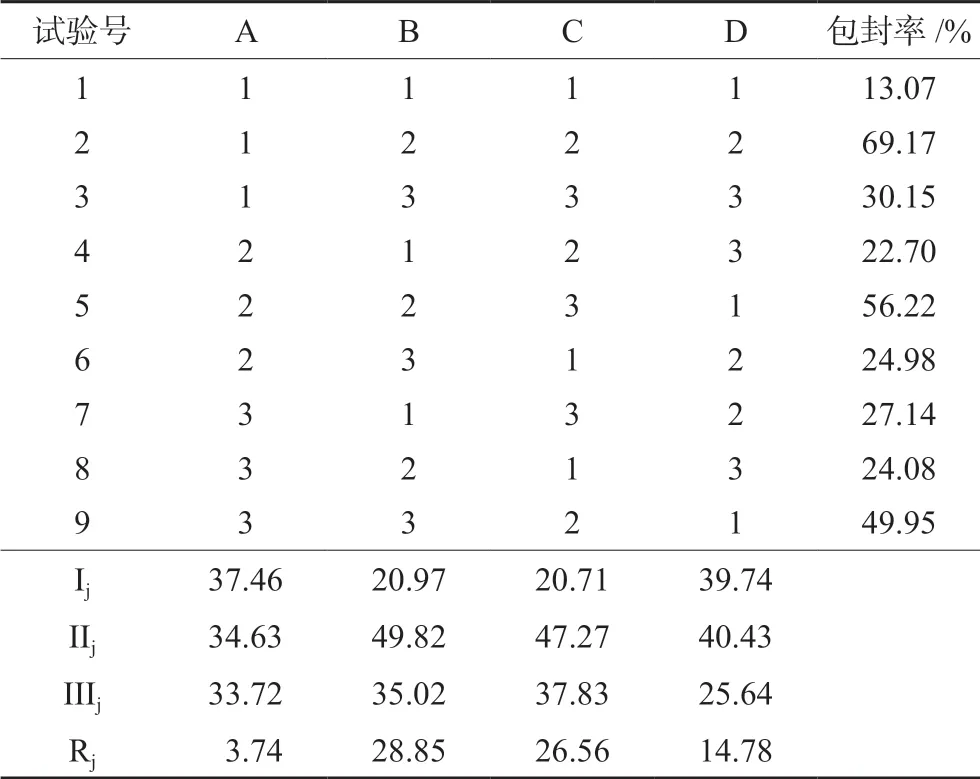
表2 正交实验结果 Tab 2 Orthogonal experiment results
直观分析结果极差R值顺序为B>C>D>A;B、C差异存在统计学意义。明确最优处方构成为A1B2C2D2:即F-68为0.4%浓度,lecithin/GMC之比为1∶2,药物/GMC之比为1∶10,GMC质量为0.05 g。
2.4 最优处方验证
根据确定的最优处方条件平行制备3批CHE-SLN,测定其包封率。结果最佳工艺条件下制备所得平均包封率为69.88%,RSD均小于2%,重现性强。
2.5 CHE-SLN的理化性质
2.5.1 形态观察 取1滴已稀释的CHE-SLN混悬液,借助覆支持膜的铜网进行蘸取,通过磷钨酸钠(1.2%)负染,于室温中静置干燥,透射电镜下观察,大小均匀,显示为规则球状(见图2)。
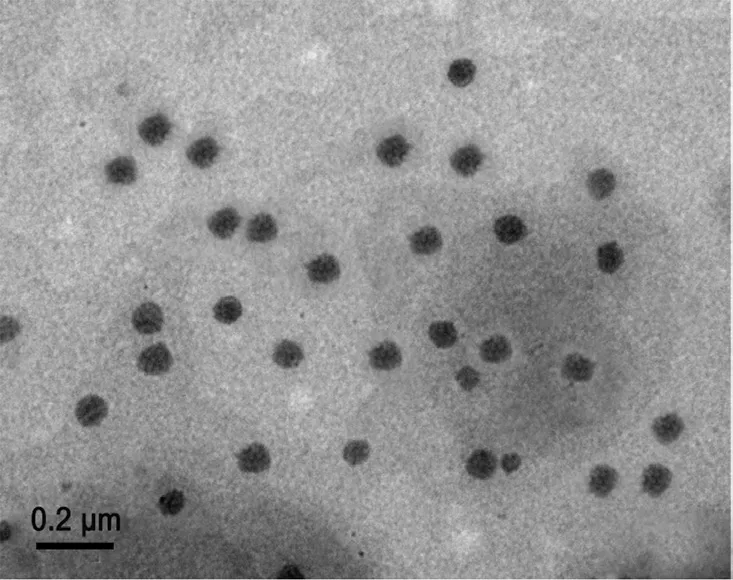
图2 CHE-SLN 透射电镜图Fig 2 Transmission electron micrograph of CHE-SLN
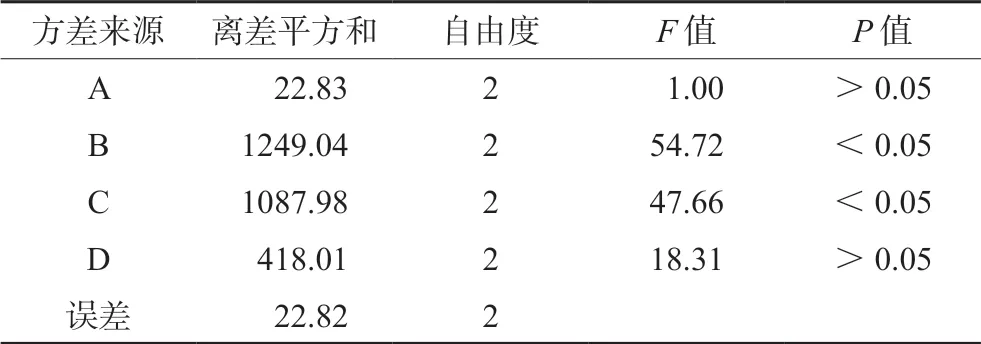
表3 方差分析结果 Tab 3 Analysis of variance
2.5.2 粒径与zeta电位 结果发现,CHE-SLN粒径均值为106.1 nm,粒径分布见图3,zeta电位为-21.4 mV(见图4),多分散系数为0.23。
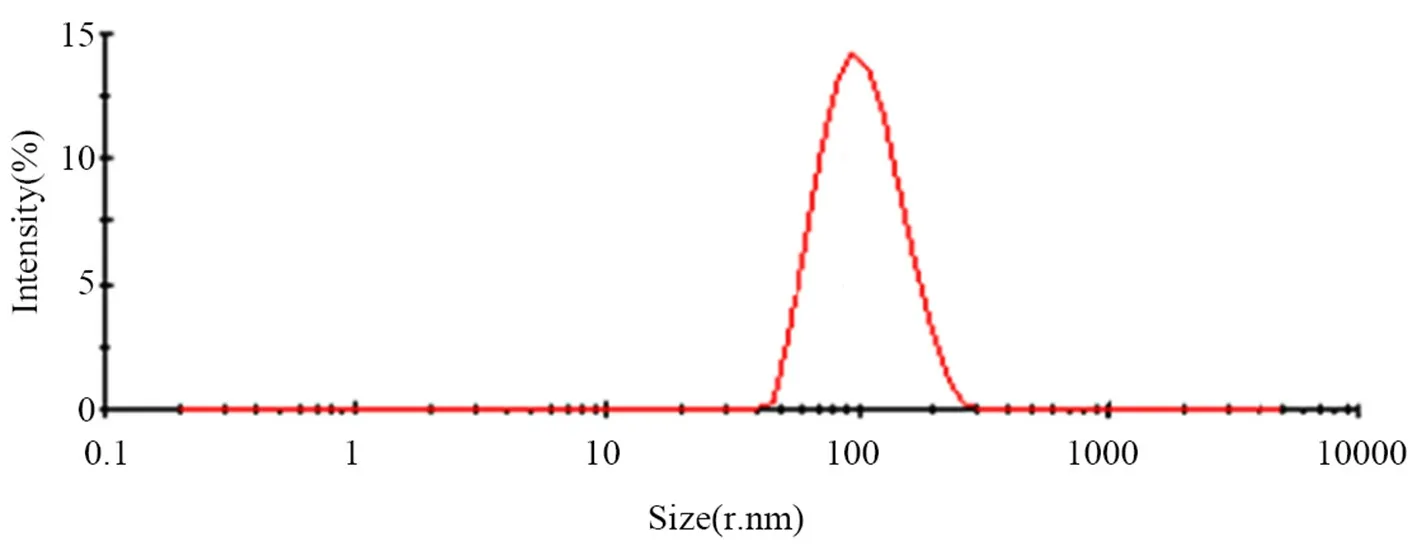
图3 白屈菜红碱固体脂质纳米粒粒径分布图Fig 3 Particle size distribution of CHE-SLN
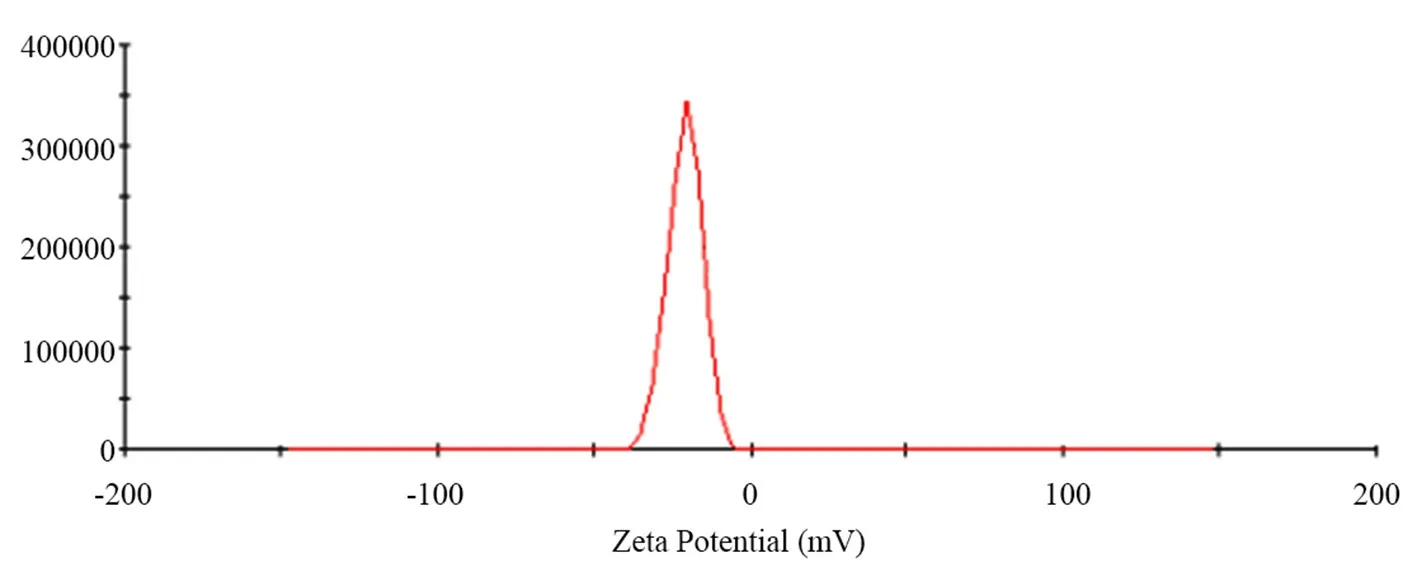
图4 白屈菜红碱固体脂质纳米粒的zeta 电位图Fig 4 Zeta potential distribution map of CHE-SLN
2.5.3 稳定性考察 制备的CHE-SLN为均一、稳定的混悬体系,有明显的丁达尔现象。为初步考察混悬体系的稳定性,将新制备的5份CHE-SLN分别放置于4℃和室温下,于不同时间点取样,测定纳米制剂的包封率,并观察其外观形态[24]。CHESLN在4℃条件下,连续放置1周,外观和包封率变化不大,稳定性较好。室温下的CHE-SLN,最开始的3 d内外观和包封率无明显变化,第4日出现乳光减弱现象,1周后出现沉淀。说明CHESLN在4℃条件下保存更理想,见表4。
表4 不同时间CHE-SLN稳定性考察(±s,n=5) Fig 4 Stability of CHE-SLN at different time (±s,n=5)
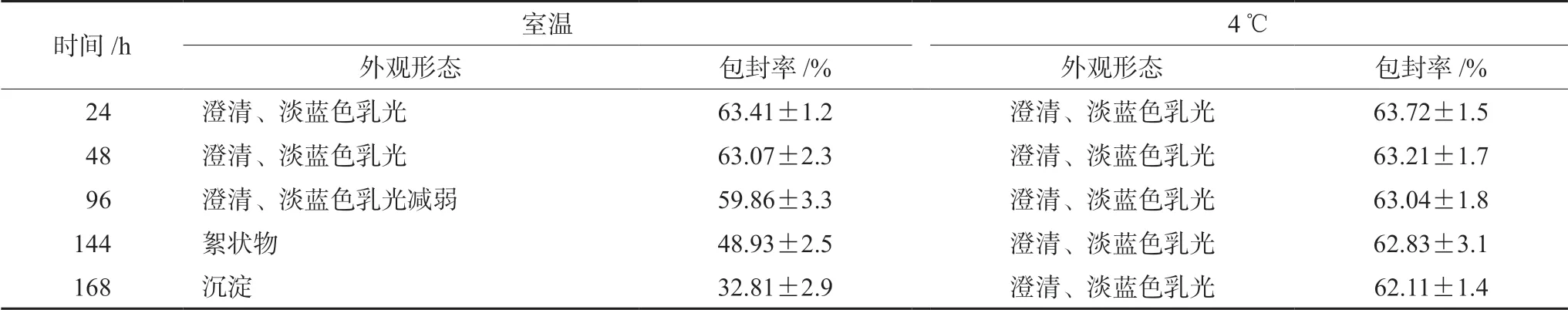
表4 不同时间CHE-SLN稳定性考察(±s,n=5) Fig 4 Stability of CHE-SLN at different time (±s,n=5)
时间/h 室温 4℃外观形态 包封率/% 外观形态 包封率/% 24 澄清、淡蓝色乳光 63.41±1.2 澄清、淡蓝色乳光 63.72±1.5 48 澄清、淡蓝色乳光 63.07±2.3 澄清、淡蓝色乳光 63.21±1.7 96 澄清、淡蓝色乳光减弱 59.86±3.3 澄清、淡蓝色乳光 63.04±1.8 144 絮状物 48.93±2.5 澄清、淡蓝色乳光 62.83±3.1 168 沉淀 32.81±2.9 澄清、淡蓝色乳光 62.11±1.4
2.6 CHE-SLN的体外释放性质考察
精密量取CHE-SLN混悬液10 mL(3.0 mg)于透析袋中(分子量为8000~12 000),两端密封,100 mL放到锥形瓶内,加入50 mL释放介质(pH 7.4 PBS,40%乙醇),置于恒温震荡器内,于(37±0.5)℃、100 r·min-1震荡,分别在0.5、1、3、5、7、9、11、15、19、24、28、32、36、48、60、72、84、96、108,120 h取释放液2 mL(并补加释放介质2 mL),0.22 μm微孔滤膜过滤,留存续滤液,HPLC对释放介质含药物量测定,由药物累积释药百分率(Q)、时间绘图。

式中Ct为每个时间点测量的释放介质中的药物质量浓度(mg·mL-1),另W(mg)、V0、V依次代表投入药物的总质量、释放介质的总量、每个样品的体积。
CHE和CHE-SLN的释药曲线见图5。前期释药较快,在30 min药物释放率13.24%,2 h释放率为19.89%。可能的原因是CHE-SLN表面附着了游离药物,导致前期药物的释放比较快,随后释药曲线趋于平稳,32 h内累计释放率为69.07%,表现出明显的缓释效应。
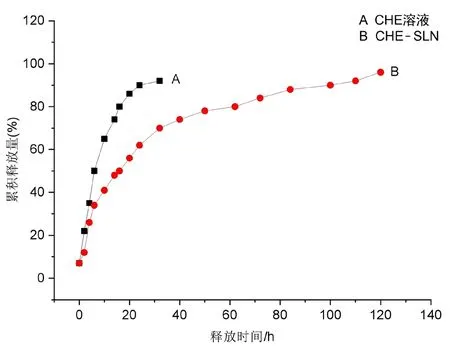
图5 白屈菜红碱固体脂质纳米粒在介质中的释放曲线Fig 5 Release curve of CHE-SLN in the medium
对CHE-SLN的释放曲线进行药动学拟合,具体见表5。
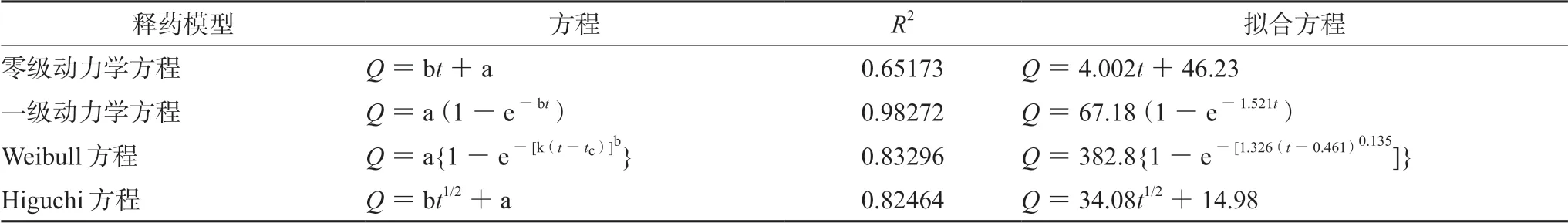
表5 不同方程拟合CHE-SLN的体外释放度(n=3) Tab 5 Fitting equation for the in vitro release rate of CHE-SLN (n=3)
通过对零级、一级、Higuchi、Weibull释药模型的拟合,发现一级释药模型的R2最高,因此,CHE-SLN的体外释放行为符合一级动力学过程。
2.7 CHE-SLN对HepG2细胞毒性实验
MTT法检测CHE-SLN对HepG2细胞毒性,取对数生长期浓度为0.5×104个·mL-1的HepG2细胞悬液,按照每孔200 μL 滴于96孔细胞培养板内,培养24 h后弃掉培养液,再分别加入含不同 浓 度CHE-SLN(15、30、60、120、240、480、960 μg·mL-1)的RPMI-1640 培养基,其中对照组细胞为不加药物的RPMI-1640培养基,继续孵育48 h后取出,每孔加MTT(5 mg·mL-1)20 μL后继续孵育4 h后弃上清液,每孔加入DMSO150 μL。通过酶标490 nm处测得光度值OD。运用SPSS 26.0软件计算IC50值。
SLN对HepG2细胞毒性实验结果如图6A所示,即使在高脂质浓度下,载体也是无毒的,表明SLN是一种安全的给药系统。与对照组比较,CHE-SLN和游离CHE有显著的细胞毒性,游离CHE和CHE-SLN对HepG2细胞,IC50分别为249.29 μg·mL-1与38.67 μg·mL-1,以上结果表明SLN递药系统无毒且对肝癌细胞有明显的抑制作用,效果较为理想。

图6 SLN(A),游离CHE和CHE-SLN(B)对HepG2的细胞毒性(±s,n=5)Fig 6 Cytotoxicity of SLN(A),CHE and CHE-SLN(B)to HepG2(±s,n=5)
3 讨论
本研究通过单因素试验以包封率为指标对超声时间、加热温度、卵磷脂、硬脂酸、单硬脂酸甘油酯进行了考察,发现超声时间和加热温度对制备的固体脂质纳米粒影响较小,当硬脂酸作为药物载体时,CHE-SLN的粒径较为饱满均一,且稳定性良好,最终选择GMC当作载体材料。随着GMC浓度的增加,SLN的粒径不断增加,为了防止对药物包封率产生影响,需将GMC质量减至最低。对于SLN的性能,表面活性剂类型与用量也存在很大影响,若复配应用多种乳化剂,可释放协同效能,有效提升SLN的体系稳定性,所得SLN具备良好形态。所以,最后将lecithin与F-68当作复配乳化剂,实验证实,随着lecithin质量的增加,制备所得SLN的稳定性随之提高。
在测定包封率方面,要先分离载药纳米粒和游离药物,主要采取凝胶层析法、透析法、离心法,其中离心法对设备要求致高,且若高速离心,纳米粒存在凝聚而受损风险;关于透析法,花费时间多,内外不等渗可导致纳米粒受损,故此研究选择凝胶层析法。
考察CHE-SLN各项理化性质与稳定性,结果显示,通过高温乳化-低温固化法制备出的CHE-SLN粒径与要求相符,具备较好的包封率与稳定性,同时制备工艺简单。由释放曲线发现CHE-SLN开始阶段有药物突释现象,随后释药曲线逐渐趋于缓和。前期释放速度较快,主要源于未包裹至脂质材料内的游离药物以及在表面上吸附的药物,后期释放缓慢,是因为被包埋药物经由纳米粒微孔扩散难度较大,药物的释放主要由坚硬的固体脂质溶蚀决定。尽管纳米粒在体外释药情况与体内存在差别,但体外释药情况仍在一定程度可以反映体内释药情况。采用MTT法检测CHE-SLN对HepG2细胞毒性,结果发现相比于单纯的CHE原料药溶液,CHE-SLN由于自身的性质,容易被HepG2细胞的吞噬作用摄取,增加药物在细胞内的蓄积量,因此细胞毒性更强,说明CHE经SLN包载后对肝癌细胞的杀伤力明显提高,SLN给药系统显著提高白屈菜的对抗肝癌细胞的活性。因此SLN是一种很有前景的提高抗白屈菜抗肿瘤活性的纳米给药系统。
