基于生物打印3D细胞微流控芯片的常用中药 注射液肝脏安全性再评价
2021-12-30朱丽颖杜宏英何宇涵于明星张丹丹杨剑贺爽董鹏志廖园洪廖玲妮张俊华关一民朱彦天津中医药大学组分中药国家重点实验室天津30093上海微技术工业研究院上海0800天津国际生物医药联合研究院中药新药研发中心天津300457
朱丽颖,杜宏英,何宇涵,于明星,张丹丹,杨剑,贺爽,董鹏志,廖园洪,廖玲妮,张俊华,关一民,朱彦*(.天津中医药大学,组分中药国家重点实验室,天津 30093;.上海微技术工业研究院,上海 0800;3.天津国际生物医药联合研究院,中药新药研发中心,天津 300457)
3D生物打印是一项新兴技术,由于其可高度精确快速按照设定堆叠目标物,在再生医学、诊断、人工组织和器官方面被寄予厚望,在构建人工组织和器官时通常把细胞和生物相容性的细胞培养胶作为生物墨水进行打印[1]。生物打印的原理大致基于光刻法、喷墨式、微挤压、激光辅助打印4种[2-4]。3D生物打印的组织模型在中药研究中的可期应用已有报道[5]。微流控芯片技术也已用于中药抗肿瘤活性成分筛选[6]。
类器官微流控芯片是集生物学、微工程技术、材料学、药学、医学、力学、机械等为一体的多学科交叉技术,目前的微流控芯片共性主要是材料、区域划分和制作方法,聚二甲基硅氧烷(PDMS)膜经常被用于芯片制作,功能区划分基本一致:进出口、流道、细胞培养区[7],制作方法包括3D打印、光刻法等[8]。微流控技术与水凝胶应用结合可定制随时间变化的生化微环境和氧气浓度等因素[2,9]。基质胶和甲基丙烯酸酐化明胶(GelMA)经常被用于3D培养胶;多种细胞可用于类器官构建,如原代细胞、多能干细胞[包括胚胎干细胞和诱导多能干细胞(iPSCs),其中iPSCs尤为多用]、癌细胞系等[10]。已报道的类器官芯片多种多样,包括肝脏、心脏、类血管、肾脏、血脑屏障、脾脏、肺、肠道及血管与各种类器官的组合、多器官组合研究。其中肝脏类器官芯片、心脏类器官芯片、小肠类器官芯片、类血管芯片研究最多。类器官微流控芯片模型用于药物发现和筛选,器官的生长发育,病变的体外建模研究,再生医学,药物毒性研究等多个领域[11]。
微流控技术和细胞共培养可使模型更接近于实际器官,从而使实验结果更准确,且更有利于机制研究。Wang等[12]通过软光刻技术在PDMS上制作了毫米级可容纳3D细胞的微流控芯片,注入iPSCs细胞增殖培养成微球,先分化成内胚体,再进一步诱导分化为肝类器官。在灌流培养条件下,显示出细胞活力的提高和成熟肝基因[白蛋白(ALB)和细胞色素P4503A4酶(CYP3A4)]的高表达。Ortega-Prieto等[13]用原代肝细胞和非实质细胞构建了可培养至40 d的3D微流控系统,在该模型中再现了乙型肝炎病毒生命周期的所有步骤,原代肝细胞与其他非实质细胞的共培养能够识别免疫效应物的细胞来源。
中药安全性的研究不充分、不明确是中药走向国际的重大障碍之一。近年来中药不良事件受到越来越多的关注,中药安全性评价的标准化和国际化亟待解决。2019年中药不良反应/事件报告显示,从给药途径看注射给药占比45.5%,从药品类别上看活血化瘀药报告数量仍居首位,在不良反应/事件中占比28.4%,严重不良反应/事件中占比39.8%[14]。而现有常用模型对药物肝毒性预测缺乏灵敏性、准确性,动物实验涉及到伦理和种属差异问题使其应用受到限制,二维细胞缺乏长期培养的可能性,且缺少细胞-细胞相互作用及细胞-胞外基质相互作用而与人体实际状况存在较大差异。比如曲伐沙星在临床前研究中常用模型未得出肝毒性结论,随后在上市一年后因导致肝衰竭和少数患者死亡而撤市[15]。而Nguyen等[16]将患者来源的肝细胞和非实质细胞共同打印成类肝组织,并利用其检测到曲伐沙星的毒性。另有抗病毒核苷药物非阿尿苷(Fialuridin)因在Ⅱ期临床试验中导致肝衰竭而被叫停, 它在动物实验中没有观察到影响脂质积累或肝细胞功能损伤,但在肝脏芯片中发现其剂量依赖性地减少白蛋白分泌[17]。目前,中药中特别存在的蓄积毒性不能在现有模型中得到较准确预测。本实验室前期建立了活血化瘀类复方中成药组分库并提出了类器官在中药安全药理学应用的潜力[18-19]。在应用多维度高内涵2D细胞表型对中药注射剂肝毒性评价方法[20]的基础上,笔者将3D细胞打印和微流控芯片技术结合起来,构建三维动态类器官模型,用于中药注射液安全性检测。
1 材料
1.1 细胞系
HepG2细胞、EA.hy926细胞(中国科学院上海生命科学研究院细胞资源中心)。
1.2 试药
GelMA-60(苏州EFL公司),DMEM基础培养基、胎牛血清、胰蛋白酶(含EDTA)(美国Gibco公司),青链霉素(美国HyClone公司),Hoechst 33342、Calcein AM/PI(美 国Invitrogen公 司),D-山梨醇、甘油、4%多聚甲醛、TritonX-100、牛血清白蛋白Ⅴ(索莱宝生物科技有限公司),小鼠抗人白蛋白(ALB)抗体ab10241、兔抗人细胞色素P450 3A4(CYP3A4)抗体ab3572、山羊抗兔二抗 IgG H&L(AlexaFluor® 647)ab6721、驴抗小鼠二抗 IgG H&L(Alexa Fluor® 488)ab150105(英国Abcam 公司),雷公藤甲素(triptolide,TP)(天津中新药业集团股份有限公司),阿司匹林(aspirin,ASP)(美国Sigma公司),香丹注射液(福建古田药业有限公司,批号:2003093),冠心宁注射液(河北神威药业有限公司,批号:Z13020780),参附注射液[华润三九(雅安)药业有限公司,批号:200705AK02]。
1.3 仪器
芯片主要部件由上海微技术工业研究院研制并提供,生物打印机与打印头由上海傲睿流体科技有限公司研制并提供,打印机型号:BP4000,步进式蠕动泵(联合众为科技有限公司),Operetta高内涵筛选系统(美国PerkinElmer公司)。
2 方法
2.1 细胞打印
细胞传代前调试Biot打印机与打印头,使喷孔通畅,设置打印机x、y、z轴参数。将细胞稀释至密度为1×106个·mL-1,离心并用磷酸盐缓冲液(PBS)重悬。打印方法为:电压11.5 V,聚集打印(单点),打印次数1次,循环次数5 circle(或打印次数5次,循环次数1 circle)。
2.2 微流控芯片小杯包被和铺胶
2.2.1 包被 小杯即芯片内的细胞接种孔,将小杯倒置,用纤连蛋白(100 μL/孔)包被小杯孔背面的PET膜3 h,通过表面张力使其停留在PET膜上。
2.2.2 铺胶 内皮细胞贴壁后,将小杯正向放置于完全培养基中,铺Gel-MA 3D细胞培养胶(45 μL/孔),UV照射30 s使胶固化。芯片灌流速度通过步进式蠕动泵控制。
2.3 蛋白表达的免疫荧光检测
培养14 d后,弃去旧培养液,PBS洗两次,每次5 min;4%多聚甲醛室温固定15 min,100 μL/孔;PBS洗两次,每次5 min;scaleviwer透化液透化16 h(参考文献自配[21]);PBS洗两次,每次5 min;2%BSA室温封闭1~2 h,100 μL/孔;PBS洗两次,每次5 min;适当稀释比例一抗4℃孵育过夜,50 μL/孔;PBST洗两次,每次5 min;适当稀释比例二抗加Hoechst室温孵育1~2 h;PBST洗两次,每次5 min。1∶500稀释的小鼠抗人白蛋白抗体,1∶1000稀释的兔抗人细胞色素P450 3A4抗体共同4℃孵育过夜,50 μL/孔;PBST洗两次,每次5 min;1∶1000稀释的两种二抗加Hoechst室温孵育1~2 h;设置不加一抗的对照组,以去除假阳性结果。
2.4 细胞给药
取基础培养基稀释药液备用,类器官培养7~14 d后,弃去旧培养液,用基础培养基洗两次,加入稀释好的药液,每药设3个复孔,37℃,5% CO2恒温培养箱中继续培养24 h。
2.5 荧光染色
用基础培养基将每种荧光染料稀释至终浓度为0.1 μg·mL-1的 Hoechst 33342,0.8 μmol·L-1的Calcein AM,1.5 μmol·L-1的PI染 液 备 用,弃去细胞培养板中的完全培养基,PBS洗两次,加入荧光染料50 μL/孔,37℃避光孵育30 min,用基础培养基洗板3次,每次5 min。
2.6 高内涵(HCA)检测
根据各染料的吸收发射波长,对应浓度的曝光时间,在Operetta二代高内涵筛选系统中设置扫描方法,将板放入后,进行全自动细胞成像。用Harmony 4.9软件对Operetta 成像进行分析,读取细胞核荧光强度/细胞质荧光强度等数据。
2.7 数据统计分析
实验数据均以均数±标准差(±s)表示,采用SPSS 21.0数据统计软件,对数据进行正态性检验,多组间比较采用单因素方差分析方法(One-Way ANOVA),数据按α=0.05为检验水准,其中P<0.05表示差异有统计学意义。所有数据作图均由GraphPad Prism 6.0软件生成。
3 结果
以人脐静脉内皮细胞EA.hy926模拟血管,通过微流控技术流速控制的完全培养基,模拟血液流动过程中的力学微环境,营养供给和废料排出,与3D培养的肝微球组合,构建人源肝脏类器官(见图1A),并选取3种常用市售中药注射剂进行肝脏安全性再评价。
3.1 微流控芯片条件优化
通过流速梯度实验考察该体系中最合适的流速,通过包被方法改进延长灌流时间实现长期培养的目的。测试了33、99、297 μL·min-13个流速下未包被和采用包被纤连蛋白EA.hy 926的状态,在两组实验中EA.hy926的状态均不与流速成反相关,而是有一个适宜的区间范围,其中流速为99 μL·min-1时EA.hy926保持贴壁时间最久,细胞延展性最好,状态最佳。未包被情况下,33 μL·min-1和297 μL·min-1只能灌流培养到第2日,99 μL·min-1可灌流培养3 d(见图1B)。此实验证明99 μL·min-1处于最佳流速区间范围,但未包被情况下细胞贴壁培养时间过短。
经过测试最有效的方法为10 μg·mL-1纤连蛋白包被3 h,完全培养基浸润0.5 h后接种EA.hy926,贴壁24 h后以99 μL·min-1的流速灌流,过程中若遇细胞脱落较多时先暂停灌流,恢复8~24 h继续灌流。结果EA.hy926连续贴壁培养时间达到14 d,其中灌流总时长达9~10 d(见图1C)。其流速梯度测试的实验结果与未包被一致,99 μL·min-1处于最佳流速区间,明显 优 于33、297 μL·min-1。33 μL·min-1和297 μL·min-1流速下,一周内贴壁细胞逐渐掉落,细胞状态差形状回圆,高倍镜下细胞轮廓不规则(见图1C)。在灌流培养过程中观察到细胞受到剪切力的作用而舒展狭长(见图2B)并随着液体流向排布(见图2A)。结束灌流培养后对EA.hy926细胞进行紧密连接蛋白(ZO-1)和肌动蛋白(F-actin)免疫荧光染色(见图2C),并与静态培养14 d的EA.hy926细胞进行宽长比和细胞面积的比较,以证实剪切力的作用,动态灌流培养的细胞宽长比小于静态培养细胞(见图2D),面积大于静态培养细胞(见图2E)。

图1 内皮细胞成功灌流培养14 d(50×)Fig 1 Endothelial cells were successfully perfused up to 14 days(50×)
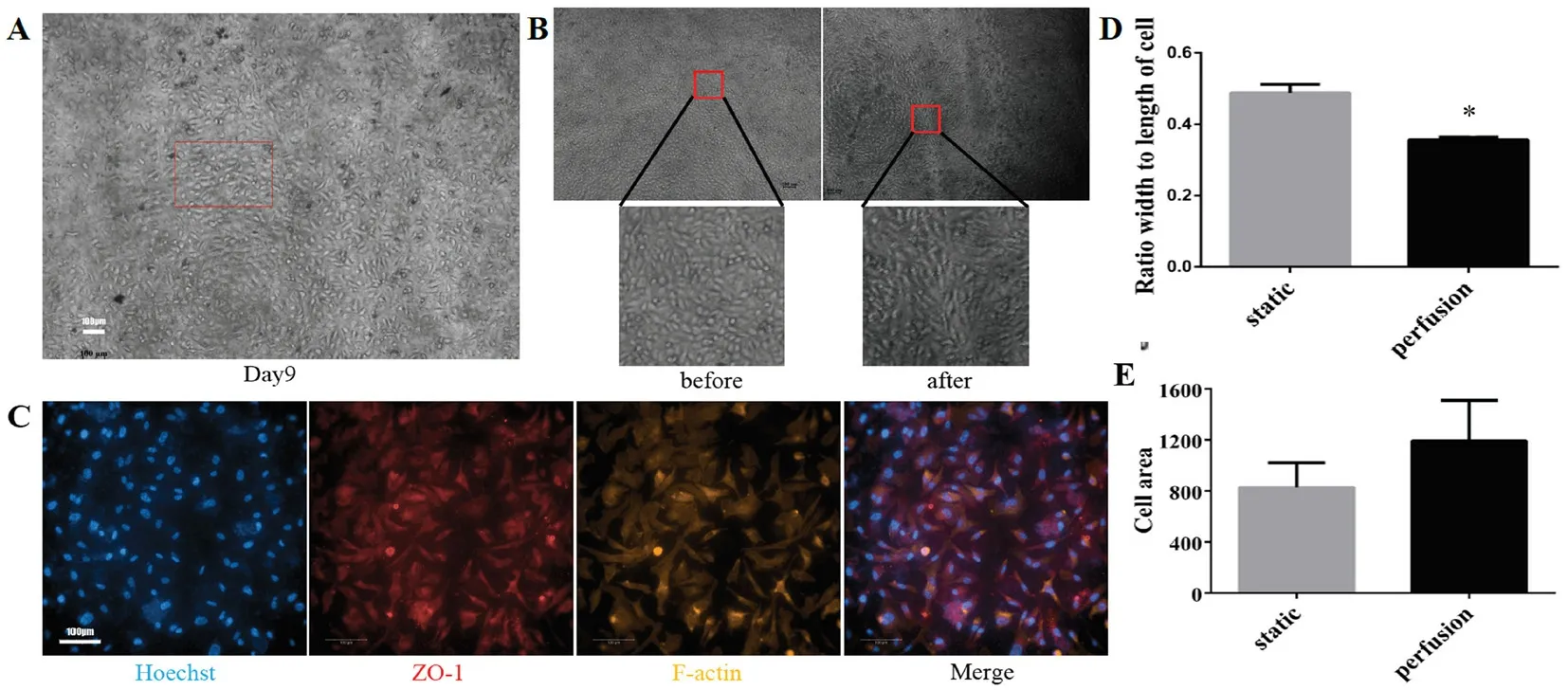
图2 剪切力对内皮细胞的影响(200×)Fig 2 Effect of shear force on the endothelial cells(200×)
3.2 3D打印细胞构建肝微球
采用图3A所示3D生物打印机构建肝微球。将HepG2细胞重悬于PBS中进行打印,打印过程在0.5 h以内,此过程不影响细胞活性(见图3D)。细胞3D打印成球后球体不断增殖(见图3E),HepG2打印成球后与EA.hy926灌流共培养14 d后,进行活死染色检测肝实质细胞的存活率在70%左右(见图3F)。肝类器官培养14 d后,通过免疫荧光法在肝实质细胞侧检测到ALB和CYP3A4的表达(见图3G),在肝类器官上再现了部分肝功能性蛋白的表达。
图3 3D生物打印的肝微球培养、细胞活/死、肝功能表达(200×)Fig 3 3D bio-printed cell culture,life and death and liver function expression(200×)
3.3 该模型用于评价中药安全性
TP为已知具有肝毒性的中药单体,故作为本实验阳性药,ASP作为阴性对照[22],基于二代高内涵三维检测成像细胞表型技术,共染Hoechst/Calcein AM/PI 3种染料,对3种常用市售活血化瘀中药注射液进行肝毒性风险再评价。冠心宁注射液(GXNI)、参附注射液(SFI)、香丹注射液(XDI)浓度均为原药的1/100。对照组(control,未处理)的细胞存活率为73.14%,各组药物处理后的细胞存活率分别为:TP组53.32%,ASP组65%,XDI组58%,GXNI组71.13%,SFI组66%(见图4B)。另仅TP有减小微球面积的趋势(见图4F)。核(Hoechst)染色显示,SFI能增加核荧光强度(见图4E)。内酯酶钙黄绿素(Calcein-AM)染色显示,TP显著降低细胞活性,而XDI虽有降低细胞活性的趋势,但与对照组相比差异无统计学意义。3种注射液与有明确肝毒性的TP比较,仅XDI组无明显差异(见图4C)。死细胞或凋亡晚期细胞PI染色显示,TP显著增加PI荧光强度,而XDI虽有增加PI强度的趋势,但与对照组、TP组相比差异均无统计学意义,其他两种注射液与TP组差异均有统计学意义(见图4D)。 对3种市售活血化瘀中药注射液的检测提示XDI对细胞活性可能有一定抑制作用,可能通过促进细胞凋亡来实现;XDI在肝类器官芯片上单次给药出现毒性趋势,提示XDI在长时间、大剂量使用下对肝脏可能有一定影响,这需要进一步实验验证。
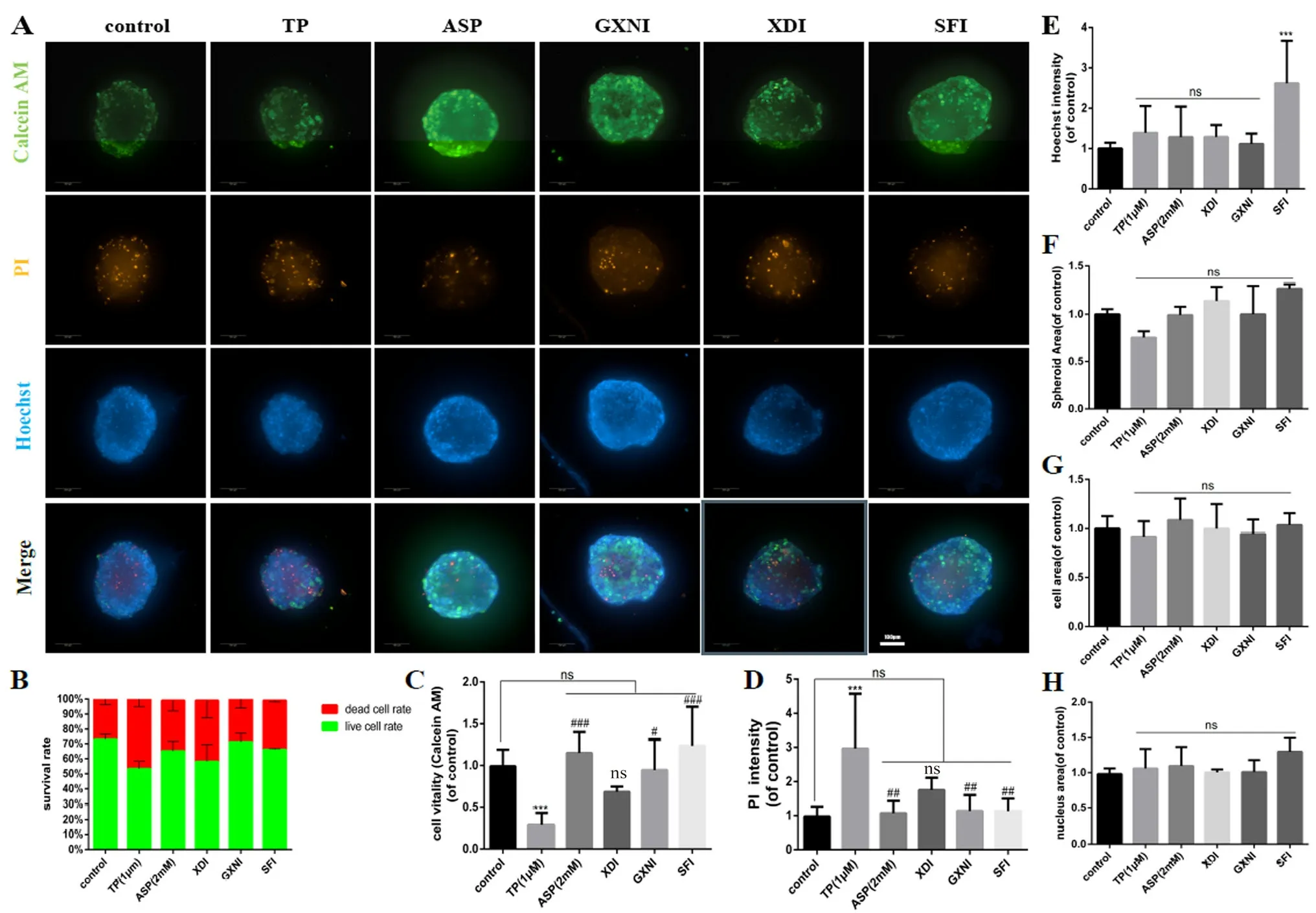
图4 肝类器官用于中药注射液肝毒性评价的代表图像和定量结果(200×)Fig 4 Representative images and quantitation of hepatotoxicity risk assessment of hepatic organs with TCM injection(200×)
4 讨论
本文首次在中药安全性评价领域将3D生物打印与微流控两种新兴技术结合,构建更先进的模型。微流控技术营造力学微环境,输送营养物质,对模拟人体器官生理状态至关重要,大量文献表明,灌流培养可促进细胞因子分泌,增强功能表达[12,23]。本文使用蠕动泵,定时更换培养基,简单模拟血液循环和废料排出,确立最佳流速为99 μL·min-1,为内皮细胞提供了更接近实际血管的剪切力,使内皮细胞延展,沿液体流向排列,贴壁细胞面积大于静态培养的细胞。蠕动泵使培养基循环流动,节省培养基。包被纤连蛋白和提前完全培养基浸润的操作,使内皮细胞贴壁更加牢固,在较大的流速灌流下(99 μL·min-1)也能保持14 d的贴壁培养。芯片中设计了4个独立的流道,可实现不同流速同时灌流,即可同时模拟血液流速较高的大血管和血液流速低的毛细血管,以及不同血管周边的组织情况。芯片与高内涵配适,可实现高通量筛选和数据处理。3D生物打印具有快速、精准、经济的优势,在构建复杂精确的组织器官方面具有广阔的应用前景。本课题组通过软件设计的打印方法,打印肝细胞成微球,与内皮细胞共培养。内皮细胞、肝星状细胞、Kupffer细胞这些非实质细胞与肝实质细胞共培养,有利于肝功能的发挥[24]。本文中肝功能相关的ALB和CYP3A4蛋白可正常表达,肝细胞培养14 d可保持70%活性。
本文运用微流控芯片和细胞3D打印摸索而来的最优条件组合,构建肝类器官并用于中药注射液肝毒性再评价,结果提示该模型评价肝毒性比2D细胞模型更准确;XDI有潜在肝风险。TP的肝毒性来源于原形化合物,代谢是其解毒途径[25-27],研究表明CYP450系列酶在三维细胞中的表达远高于二维细胞[28-29],因此TP在三维细胞的毒性弱于二维细胞。本文结果符合这一预期,与文献中2D HepG2 细胞达到相同损伤程度[30],本文所构建的肝类器官所需TP 浓度更高(2D 细胞为630 nmol·L-1,本文模型为1 μmol·L-1)。同样的,对XDI的肝毒性评价中,2D HepG2细胞与该肝类器官相比,相同浓度下2D细胞活性明显被抑制[19],该模型细胞活性无明显抑制,但显示抑制趋势。XDI的不良反应多见于呼吸系统、皮肤、胃肠系统,偶发肝炎、肝硬化[31-33]。在本课题组前期动物实验中[19],XDI在经典肝毒性生化指标上(超氧化物歧化酶、丙二醛、谷氨转氨酶、天冬氨酸转氨酶)也表现为毒性趋势。综上,临床报告、动物实验中XDI的肝毒性并非普遍存在,但有偶发风险。可能与剂量、用药时长有关,需要进一步验证。因而,从TP和XDI的结果来看,该肝类器官模型比2D细胞模型更准确。该模型可长期培养、重复给药,准确度高,有拓展通量的潜力,对动物的需求少,适用于具有复杂化学成分、蓄积毒性的中药制剂。可用于经由2D细胞初筛后,进一步肝毒筛选检测和毒性机制研究。
为了使肝类器官更完善,本课题组下一步将按比例加入星状细胞和免疫细胞;根据打印机特点设计多细胞打印图案。类器官芯片的现阶段作用通常是弥补动物实验和2D细胞实验之间的鸿沟,代替并超越动物实验的人体芯片时代值得我们期待。随着生物打印机设计、材料学、生物学等相关学科的进步,尤其是与AI/机器学习领域的结合,类器官芯片可能会取得突破性进展,也必然会为药物研发领域带来新的机遇。材料学和AI/机器学习应用到类器官领域的长足发展可能会使类器官形似人体器官更容易,而形似这一带着整体论色彩的研究方法或许会给神似(功能性)带来意想不到的进步。
