基于网络药理学和分子对接探讨太白楤木皂苷治疗缺血性 脑卒中的药效物质及作用机制
2021-12-30陶星茹刘珂娣赵石李伟红陈海霞董泰玮卫培峰段佳林奚苗苗陕西中医药大学药学院陕西咸阳72046空军军医大学西京医院药剂科西安7002陕西中医药大学第二附属医院国家药物临床试验机构陕西咸阳72000西北工业大学医学研究院西安70072西安天工生物医药研究所西安7002
陶星茹,刘珂娣,赵石,李伟红,陈海霞,2,董泰玮,卫培峰,段佳林,奚苗苗,5*(.陕西中医药大学药学院,陕西 咸阳 72046;2.空军军医大学西京医院药剂科,西安 7002;.陕西中医药大学第二附属医院国家药物临床试验机构,陕西 咸阳 72000;4.西北工业大学医学研究院,西安 70072;5.西安天工生物医药研究所,西安 7002)
脑卒中在全球范围已成为仅次于心血管疾病和癌症的第三大致死病因,其发病率、致残率、死亡率及复发率持续上升,严重危害人类健康[1]。脑卒中主要分为缺血性脑卒中(IS)和出血性脑卒中,缺血性脑卒中占临床病例的70%~80%[2]。临床上对于缺血性脑卒中的有效治疗药物只有重组组织型纤溶酶原激活剂(rt-PA),但由于治疗时间窗的限制,大多数患者无法得到及时有效的治疗[3-6]。研究显示,恢复缺血半暗带血流量,恢复血供及氧供,促进血管新生,增加脑组织缺血区氧供,可以挽救缺血导致的组织损伤,进而改善神经功能[7]。 中药太白楤木是五加科楤木属(Aralia)的落叶灌木或小乔木,太白楤木皂苷(saponins fromAralia Taibaiensis,sAT)提取自太白楤木根皮,具有心脑血管保护、降血脂、降血糖等药理作用[8]。课题组前期研究结果表明,太白楤木皂苷可降低大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠脑梗死体积,改善MCAO大鼠神经功能学评分,表现出良好的神经保护作用[9]。但是,sAT治疗IS的药效物质、生物过程及分子机制尚不清楚。
网络药理学广泛用于中药药效物质及作用机制的研究,与中医学整体观念、辨证论治的思想相契合,同时与中药多途径、多靶标的治疗原理一致[10],分子对接技术广泛用于中药及中药复方作用药效物质预测及验证[11],因此,本研究拟通过网络药理学的研究策略,寻找 sAT治疗IS的药效物质,揭示sAT治疗IS的生物学过程及分子机制,并通过半柔性对接方法及细胞实验进行初步验证。
氧糖剥夺/复氧复糖(oxygen and glucose deprivation/reperfusion,OGD/R)模型为IS研究的常用细胞模型[12],氧糖剥夺模拟脑缺血病程,复氧复糖模拟再灌注病程,人脐静脉内皮细胞(HUVECs)是用于研究血管新生的经典细胞[13],因此,本研究构建HUVECs OGD/R模型,阐明sAT促进血管新生治疗IS的药效物质基础和具体作用机制,为sAT的临床应用及二次开发提供理论依据。
1 材料
1.1 仪器
371型CO2培养箱(美 国Thermo公 司),YQX-Ⅱ型厌氧培养箱(上海跃进医疗器械有限公司),MultiskanSky型酶标仪(美国Thermo公司),生物显微镜(奥林巴斯有限公司),BSC-1100ⅡA2-X型生物安全柜(山东博科生物产业有限公司),TD4型台式离心机(湖南湘仪实验室仪器开发有限公司),BSA124S型分析天平[赛多利斯科学仪器(北京)有限公司],THZ-100型恒温摇床(上海一恒仪器有限公司),QL901型涡旋仪(海门市其林贝尔仪器有限公司),电泳仪(北京凯元信瑞仪器有限公司),凝胶成像系统(北京赛智创业科技有限公司)。
1.2 试药
去葡萄糖竹节参皂苷Ⅳa对照品(辰光生物科技有限公司,批号:26020-14-4,纯度>98%);胎牛血清(FBS,以色列BI公司,批号:1928625);青霉素-链霉素双抗溶液(批号:20210331)、胰蛋白酶消化液(批号:CR2103040)、杜氏磷酸盐缓冲液(D-PBS,pH 7.4,批号:21031022)(武汉塞维尔生物科技有限公司);DMEM/F-12高糖培养基(美国Corning公司,批号:10092013);DMEM无糖培养基(大连美仑生物科技有限公司,批号:MA0582-Jul-03F);二甲基亚砜(DMSO,美国MP公司,批号:Y181007);CCK-8试剂盒(兰杰柯科技有限公司,批号:70120258);人血管内皮生长因子酶联免疫吸附检测试剂盒(武汉伊莱特生物科技有限公司,批号:VIXCFZ2X4W);SDS-PAGE凝胶制备试剂盒(陕西中晖赫彩生物医药科技有限公司,批号:BG1103);VEGF抗体(Servicebio,批 号:AC2102017D);GAPDH抗 体(Servicebio,批号:LS194236);其余试剂均为分析纯或实验室常用规格;水为超纯水。
1.3 细胞
HUVECs由空军军医大学西京医院药剂科赠予。
2 方法
2.1 网络药理学研究
2.1.1 sAT化学成分收集及其治疗IS的靶标获取 通过查阅中国知网(CNKI)及PubMed数据库,全面收集sAT化学成分,并对sAT化学成分治疗所有疾病的靶标进行预测。在GeneCards和OMIM数据库中以“stroke”为关键词,在CTD数据库中以“stroke”“cerebral infarction”和“middle cerebral artery”为关键词进行检索,获得的靶标取与sAT化学成分预测靶标的交集,即sAT化学成分治疗IS的靶标。将获得的靶标导入STRING数据库,限定物种为人类,置信分数设置为0.400,获得各靶标互作信息。
2.1.2 sAT化学成分治疗IS的靶标的GO富集分析及KEGG富集分析 将获得的sAT化学成分治疗IS的靶标导入DAVID数据库,以“P<0.05”为筛选条件,对sAT化学成分治疗IS的靶标进行GO富集分析。以“P<0.05”及“count≥5”为筛选条件,对sAT化学成分治疗IS的靶标进行KEGG通路富集分析。
2.1.3 核心靶标预测 核心靶标是基于蛋白质相互作用网络得到的,在信号通路中具有重要调控作用的靶标。最大团体中心性算法(maximal clique centrality,MCC)能够从网络中的高连接度靶标与低连接度靶标中捕获到网络中的核心靶标,MCC值越大代表靶标在网络中越重要[14]。故本研究将STRING数据库中获得的靶标互作信息导入Cytoscape 3.7.6软件中,采用CytoHubba插件中的MCC算法,筛选sAT化学成分治疗IS的核心靶标。
2.2 分子对接验证
将sAT化学成分与部分核心靶标进行半柔性对接,以探究sAT化学成分治疗IS的分子机制。靶标蛋白结构全部来源于RCSB蛋白数据库(http://www.rcsb.org/),选取结构相似且分辨率较高的人源受体晶体结构[15]。利用ChemBio Draw Ultra14.0绘制sAT化学成分的结构并保存为Mol2格式。运行Autodock Vina程序对接来验证sAT化学成分与部分核心靶标的结合效果,根据结合能小于-7.0 kcal·mol-1筛选得到潜在的药效物质[16],并用Discovery Studio软件对结合模式进行可视化。
2.3 细胞实验验证
2.3.1 细胞培养 HUVECs使用完全培养基(即含10%FBS、1%青霉素-链霉素双抗的DMEM/F-12高糖培养基),置于37℃、5%CO2恒温培养箱中培养,每2日更换一次培养基,待细胞融合至90%左右时,用0.25%胰蛋白酶消化并进行传代。
2.3.2 细胞分组及造模 将HUVECs分为6组,正常组:完全培养基培养;OGD/R模型组:给予DMEM无糖培养基放于厌氧培养箱中培养5 h,取出换成含药的完全培养基放于CO2培养箱中培养24 h;溶剂组:给予DMEM无糖培养基放于厌氧培养箱中培养5 h,再换成含0.1%DMSO的完全培养基放于CO2培养箱中培养24 h;去葡萄糖竹节参皂苷Ⅳa低、中、高剂量组:给予DMEM无糖培养基放于厌氧培养箱中培养5 h,再取出换成含10、20、40 μmol·L-1去葡萄糖竹节参皂苷Ⅳa(溶剂为0.1%DMSO,浓度根据前期预实验结果设置)的完全培养基于CO2培养箱中培养24 h。
2.3.3 CCK-8法检测细胞活性 以5×104个/孔将HUVECs接种于96孔板中,待细胞贴壁后,按“2.3.2”项下方法分组处理,同时设置不含细胞和药物的空白对照组,每组设置3个复孔。造模给药完成后,更换含10%CCK-8液的完全培养基,于37℃、5%CO2细胞培养箱中孵育2 h,使用酶标仪在450 nm波长处检测各孔的光密度(OD)值并计算细胞活性,实验重复3次。
2.3.4 试剂盒检测细胞VEGF水平 以2×105个/孔将HUVECs接种于6孔板中,待细胞贴壁后,按“2.3.2”项下方法分组处理,每组设置3个复孔。造模给药完成后,细胞消化离心后,加入300 μL含蛋白酶抑制剂的RIPA裂解液放于冰上裂解,离心,取上清液,根据试剂盒说明书进行检测。实验重复3次。
2.3.5 蛋白免疫印迹法(Western blot)检测细胞VEGF蛋白表达 以5×105个/孔将HUVECs接种于培养瓶中,待细胞融合至90%左右时,按“2.3.2”项下方法分组处理。造模给药完成后细胞消化离心,每管加入400 μL含蛋白酶抑制剂的RIPA裂解液放于冰上裂解,离心,取上清液,用BCA蛋白检测试剂盒检测蛋白浓度,加入5×蛋白上样缓冲液试剂后,加热变性。10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的蛋白质(20 μg),电泳后转移到PVDF膜上。5%脱脂牛奶在TBST缓冲液中室温下封闭2 h,随后加入VEGF及GAPDH抗体,4℃摇床孵育过夜。TBST洗膜30 min后,加入二抗羊抗兔IgG孵育2 h后,再用TBST缓冲液洗膜30 min后,用凝胶成像系统成像并用Lane 1D软件进行蛋白半定量分析。实验重复3次。
2.3.6 统计分析 采用SPSS 20.0软件对数据进行统计分析。组间比较采用方差分析,两两比较采用Tukey检验。P<0.05表示差异有统计学意义。
3 结果
3.1 sAT的化学成分收集与靶标预测
从CNKI及PubMed数据库收录的文献中共收集31个sAT化学成分(见表1)。对31种化学成分进行靶标预测,将预测的靶标导入UniProt数据库,限定研究物种为人类,进行校正和剔重,共获得416个靶标。

表1 sAT中31种化学成分的基本信息 Tab 1 Basic information of the 31 ingredients from sAT
3.2 IS发病机制靶标收集及sAT化学成分治疗IS的靶标获取
通过CTD、GeneCards、OMIM 3个数据库,共获得383个无重复的IS发病机制相关靶标。将sAT中31个化学成分对应的416个预测靶标与IS相关的383个靶标导入Venn在线绘图工具,取交集共获取71个共同靶标即sAT化学成分治疗IS的靶标,其Uniprot ID、蛋白质及基因名信息见表2。
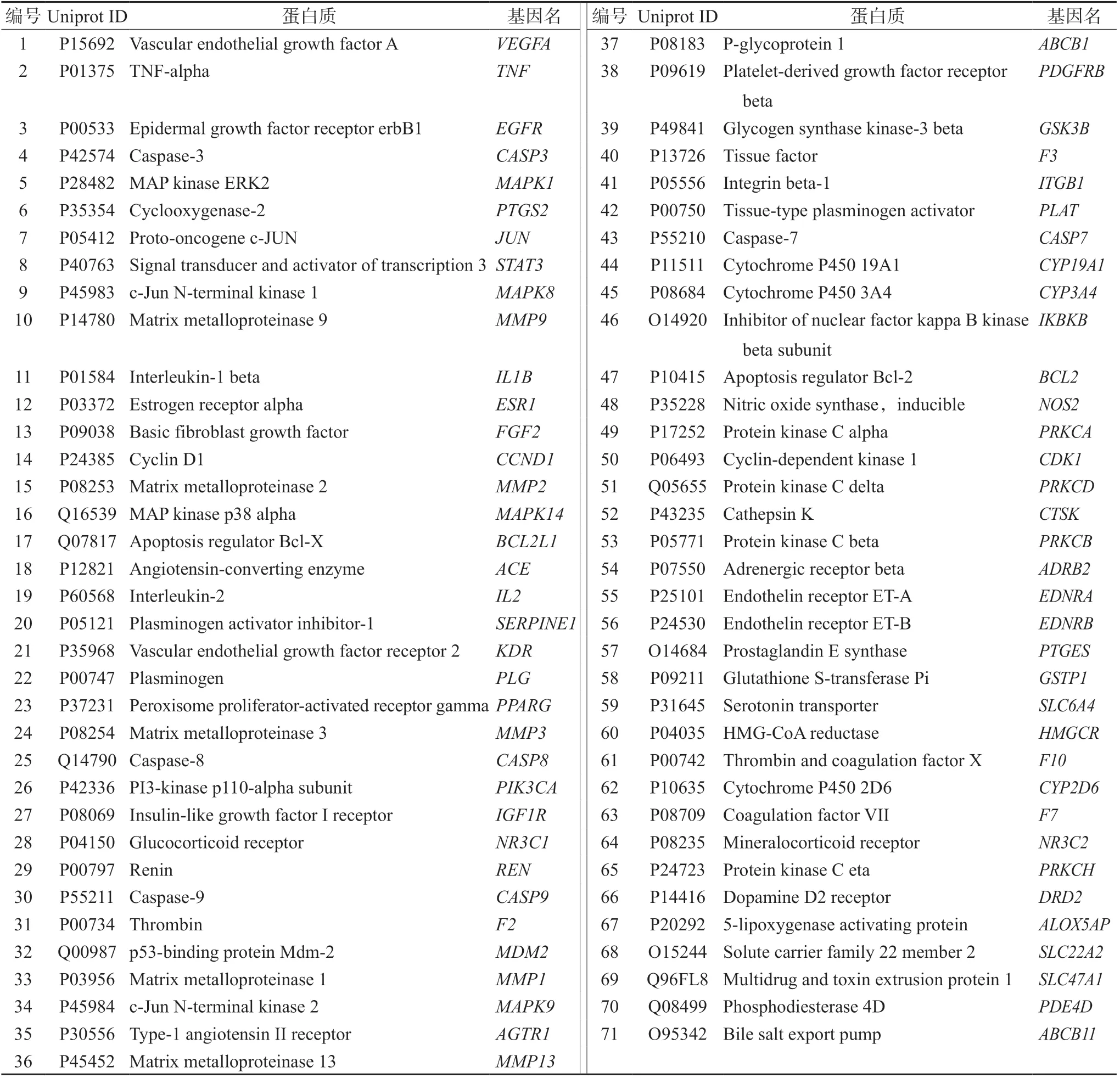
表2 71个sAT化学成分治疗IS靶标的基本信息 Tab 2 Basic information of 71 targets from sAT for IS
3.3 sAT化学成分治疗IS靶标的GO及KEGG富集分析
对71个sAT化学成分治疗IS的靶标进行GO富集分析,以P<0.05为筛选条件,共得到241个生物过程(BPs)、30个细胞成分(CCs)与66个分子功能(MFs)。富集的生物过程结果表明,sAT化学成分治疗IS的靶标主要参与凋亡过程的负调控、缺少配体的外源性凋亡信号通路、细胞增殖的正向调控、对缺氧的反应、ERK1和ERK2级联正向调控、细胞迁移正向调控、血管生成正向调控;富集的细胞成分结果表明,sAT化学成分治疗IS的靶标主要分布在细胞外间隙、细胞膜、膜筏、细胞外区域、胞浆;富集的分子功能结果表明,sAT化学成分治疗IS的靶标主要参与酶结合位点、丝氨酸型酶内切酶活性、蛋白结合、相同的蛋白结合、蛋白激酶活性、蛋白丝氨酸/苏氨酸激酶活性。
对71个sAT化学成分治疗IS的靶标进行KEGG富集分析,以P<0.05为筛选条件,共得到104条KEGG通路,根据count值≥5筛选与IS相关的前20条信号通路,结果表明,sAT化学成分主要通过黏着斑、PI3K-Akt、HIF-1、VEGF、Toll样受体、凋亡等信号通路治疗IS(见表3)。
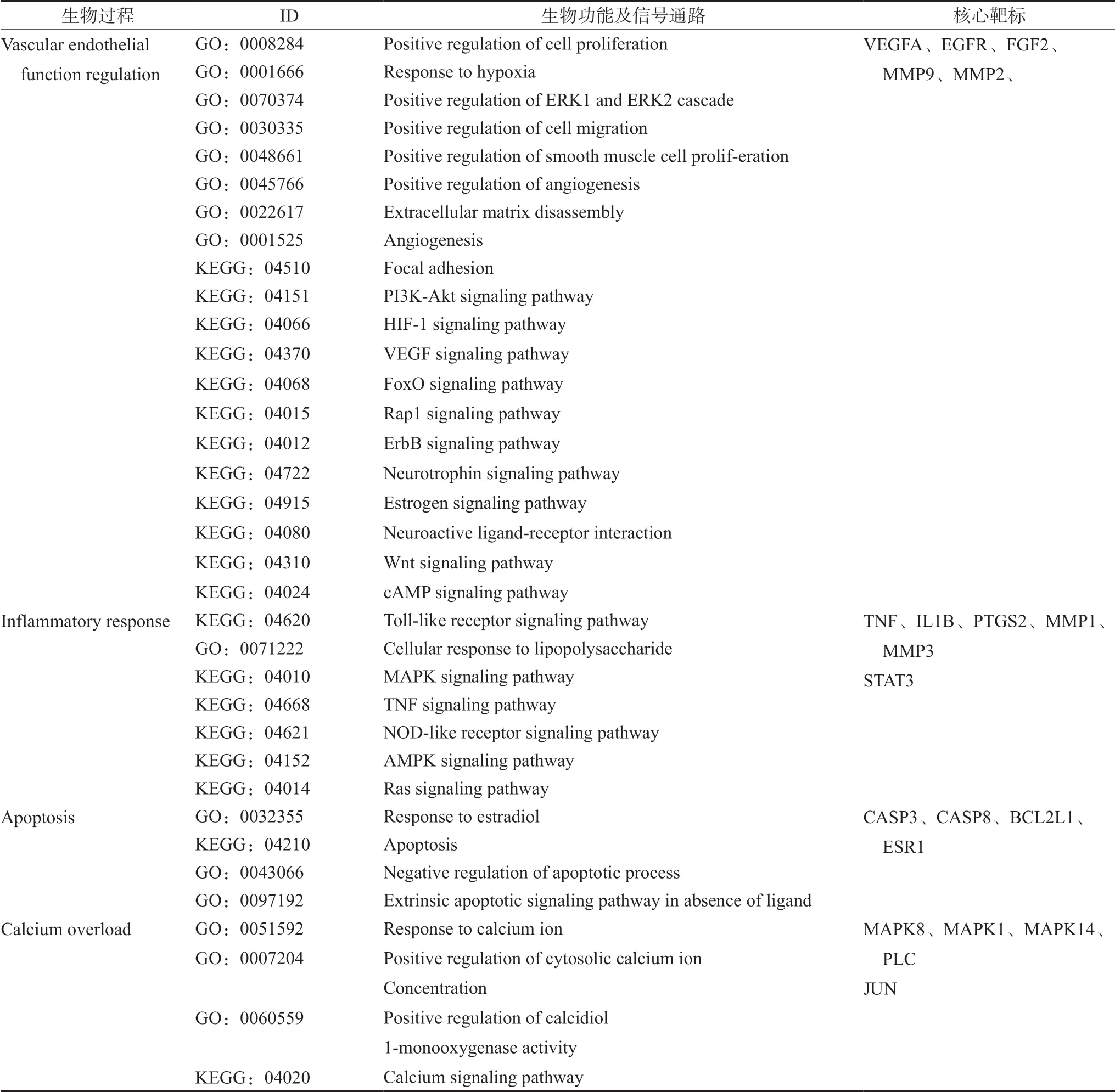
表3 71个sAT化学成分治疗IS靶标涉及的生物过程、信号通路以及参与调控的核心靶标 Tab 3 Target of 71 sAT ingredients for IS included biological process,signaling pathway,and core target involved in regulation
3.4 核心靶标预测
STRING中保存获得的蛋白质相互作用关系数据库作为TSV文件,导入Cytoscape 3.7.6软件。利用CytoHubba插件筛选得到前20个核心靶标,即TNF、CASP3、VEGFA、PTGS2、EGFR、JUN、STAT3、MAPK1、MMP9、MMP2、ESR1、MAPK8、MAPK14、FGF2、IL1B、MMP3、MMP1、PLG、BCL2L1、CASP8。
3.5 分子对接结果
根据GO及KEGG富集分析结果,发现sAT化学成分治疗IS靶标多参与血管内皮功能调节。因此本研究将sAT中31种化学成分与核心靶标中与血管新生相关靶标进行对接,即VEGFA、MMP9、MMP2、FGF2、EGFR,将其作为对接蛋白,由于KDR为VEGFA的主要受体,与血管新生过程息息相关,因此,将其纳入对接蛋白,对接蛋白基本信息见表4。对接结果提示,31种化学成分都与多个靶标有不同程度的有效结合。结合能小于-7.0 kcal·mol-1,同时作用于5个靶标的有3个化学成分,分别为楤木皂苷D、去葡萄糖竹节参皂苷Ⅳa、竹节参皂苷Ⅰb;同时作用于4个靶标的有12个化学成分。选择与6个靶标结合最好的5种化学成分深入分析,结果见图1~6。
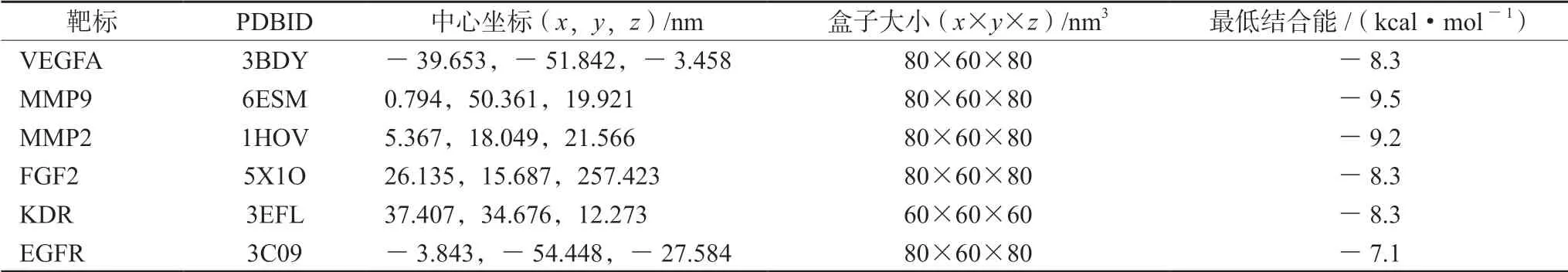
表4 AutoDock Vina计算中6个靶标的参数设置及对应结果 Tab 4 Parameters setting and corresponding results of 6 targets by AutoDock Vina calculation
3.5.1 去葡萄糖竹节参皂苷Ⅳa与VEGFA相互作用 去葡萄糖竹节参皂苷Ⅳa与VEGFA对接结果如图1,去葡萄糖竹节参皂苷Ⅳa羟基的氢与TRP105及LEU4形成2个氢键作用,母核与TYR104形成Pi-σ键,与LYS45、VAL58、LEU47和PRO59形成烷基及Pi-烷基键。
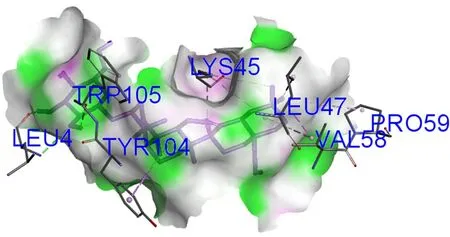
图1 去葡萄糖竹节参皂苷Ⅳa与VEGFA对接结果图Fig 1 Docking diagram of deglucose-chikusetsu saponin Ⅳa with VEGFA
3.5.2 去葡萄糖竹节参皂苷Ⅳa与FGF2相互作用 去葡萄糖竹节参皂苷Ⅳa与FGF2对接结果如图2,去葡萄糖竹节参皂苷Ⅳa羟基的氢与GLY122形成氢键,与ARG33及ARG81氨基酸残基形成2个氢键作用,此外,母核与ARG39形成烷基键,甲基与TYR124形成Pi-烷基键。
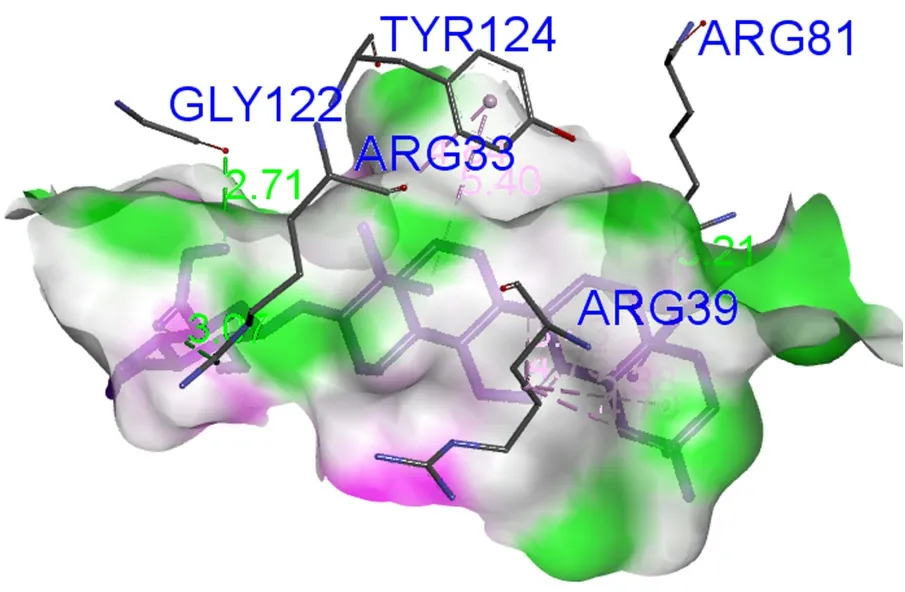
图2 去葡萄糖竹节参皂苷Ⅳa与FGF2对接结果图Fig 2 Docking diagram of deglucose-chikusetsu Saponin Ⅳa with FGF2
3.5.3 竹节参皂苷Ⅰb与EGFR相互作用 竹节参皂苷Ⅰb与EGFR对接结果如图3,竹节参皂苷Ib与ASP323、BMA3283氨基酸残基形成2个氢键作用,此外,母核与ALA122及LEU178形成烷基键。
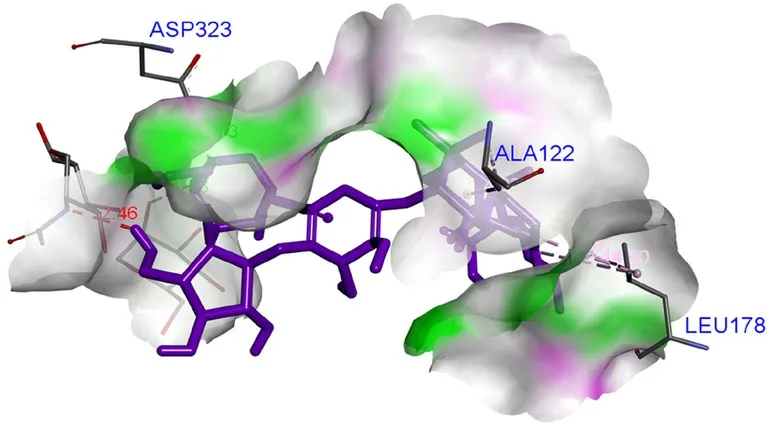
图3 竹节参皂苷Ⅰb与EGFR对接结果图Fig 3 Docking diagram of chikusetsu saponin Ⅰb with EGFR
3.5.4 蓣知子皂苷Ⅳ与MMP2相互作用 蓣知子皂苷Ⅳ与MMP2对接结果如图4,蓣知子皂苷Ⅳ与GLY81、ASP80、ASP77、TYR74、LEU82、ALA84分别形成6个氢键作用,母核与TYR142、LEU83、HIS130形成烷基及Pi-烷基键。

图4 蓣知子皂苷Ⅳ与MMP2对接结果图Fig 4 Docking diagram of yuzhizioside Ⅳ with MMP2
3.5.5 太白楤木皂苷Ⅸ与MMP9相互作用 太白楤木皂苷Ⅸ与MMP9对接结果如图5,太白楤木皂苷Ⅸ与ASP235、TYR248、TYR245、LEU188、ALA191、MET247、GLY186形成7个氢键作用,母核与HIS236、LEU187、HIS230形成烷基及Pi-烷基键。
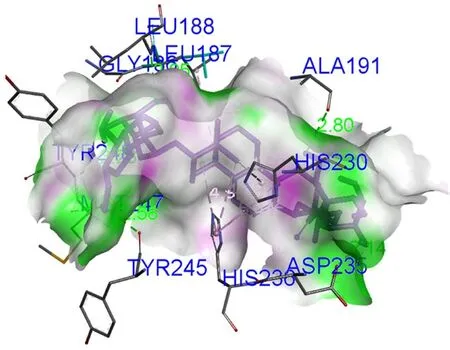
图5 太白楤木皂苷Ⅸ与MMP9对接结果图Fig 5 Docking diagram of taibaienoside Ⅸ with MMP9
3.5.6 楤木皂苷D与KDR相互作用 楤木皂苷D与KDR对接结果如图6,楤木皂苷D与GUL885形成1个氢键作用,母核与HIS1026、LEU889、ILE1044、VAL899、CYS1024、ILE888、CYS1045形成烷基及Pi-烷基键。
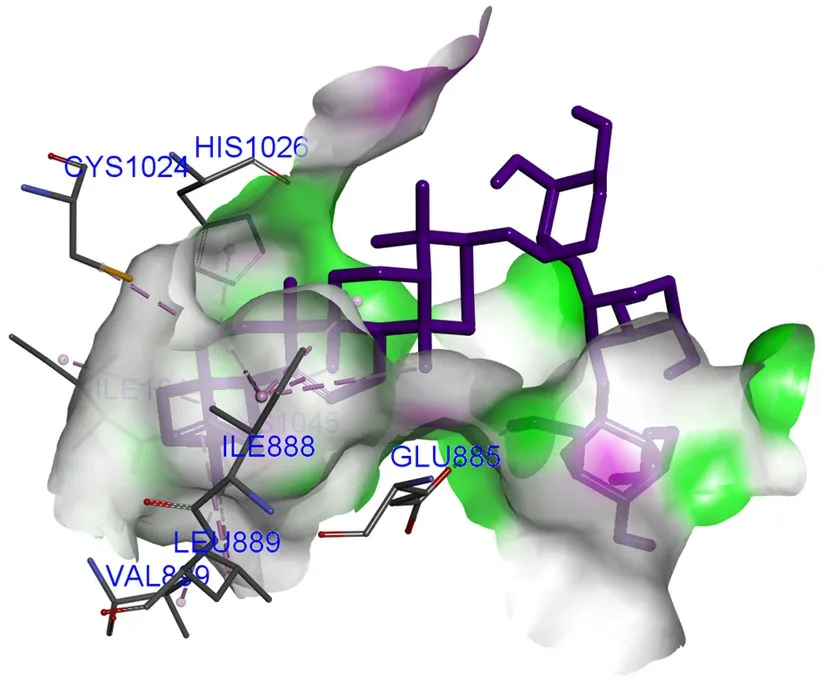
图6 楤木皂苷D与KDR相互作用对接结果图Fig 6 Docking diagram of araloside D with KDR
3.6 体外细胞实验
3.6.1 细胞活性 与正常组比较,模型组细胞活性显著降低(P<0.01),提示OGD/R模型引起HUVECs活性下降。与模型组比较,溶剂组细胞活性无明显变化,去葡萄糖竹节参皂苷Ⅳa各浓度组细胞活性均显著升高(P<0.05或P<0.01),提示其可提高HUVECs OGD/R损伤后的活性且呈剂量-效应依赖关系,结果见图7。
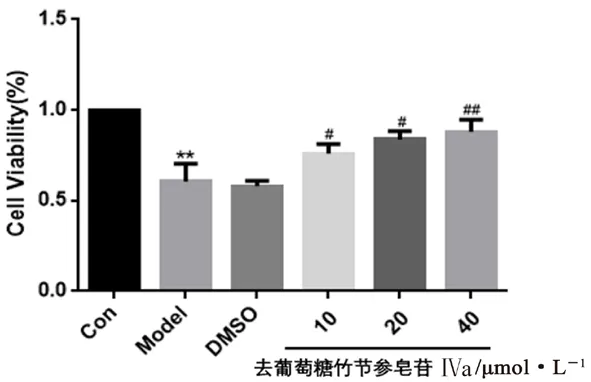
图7 各组细胞活性检测结果(±s,n=3)Fig 7 Survival rate of cells in each group(±s,n=3)
3.6.2 细胞中VEGF水平测定结果 与正常组比较,模型组细胞VEGF水平显著降低(P<0.01),提示OGD/R模型引起HUVECs中VEGF水平下降。与模型组比较,溶剂组细胞VEGF水平无明显变化,去葡萄糖竹节参皂苷Ⅳa中、高浓度组细胞VEGF水平均显著升高(P<0.05或P<0.01),提示其可提高HUVECs OGD/R损伤后的VEGF水平且呈剂量-效应依赖关系,结果见图8。
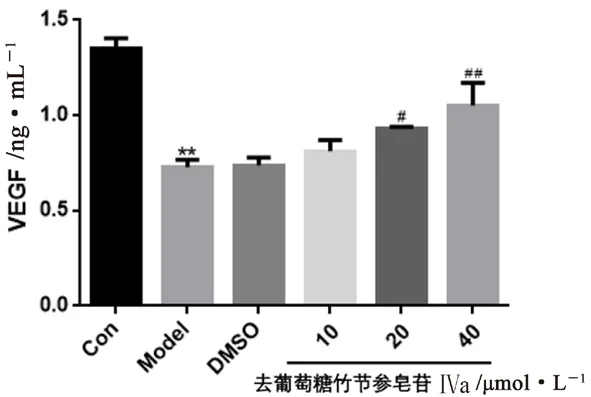
图8 各组细胞中VEGF水平测定结果(±s,n=3)Fig 8 VEGF content of cells in each group(±s,n=3)
3.6.3 细胞中VEGF蛋白表达结果 与正常组比较,模型组细胞蛋白表达显著降低(P<0.01),提示OGD/R模型引起HUVECs中VEGF蛋白表达下降。与模型组比较,溶剂组细胞VEGF蛋白表达无明显变化,去葡萄糖竹节参皂苷Ⅳa中、高浓度组细胞VEGF蛋白表达均显著升高(P<0.05或P<0.01),提示其可提高HUVECs OGD/R损伤后的VEGF蛋白表达且呈剂量-效应依赖关系,结果见图9。
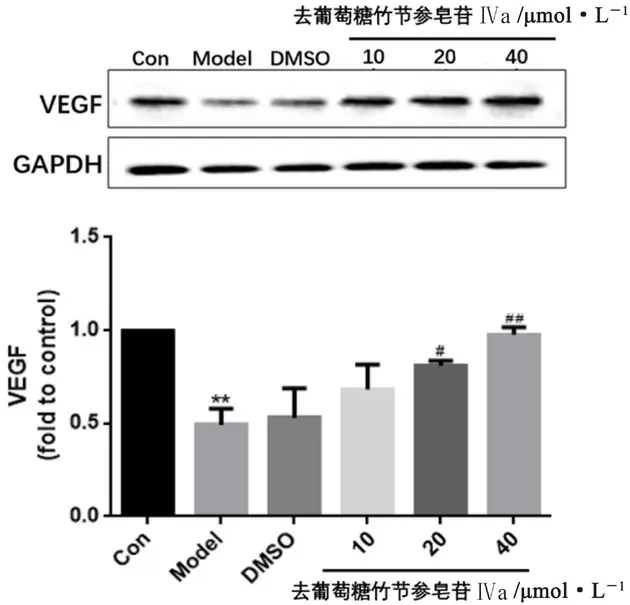
图9 各组细胞中VEGF蛋白表达结果(±s,n=3)Fig 9 VEGF protein expression of cells in each group(±s,n=3)
4 讨论
中药所含化学成分复杂,其药理作用是中药所含多种药效物质通过多途经、多环节和多靶标所表现出来的综合或整合作用[29],作用机制复杂,中药药效物质的研究是目前中医药研究面临的最重要、最关键的问题。中药治疗脑卒中历史悠久,大量体内外研究已证明多种中药制剂或其单体成分可通过促进血管新生,发挥神经保护作用[30]。中药多成分作用于多靶标的药用特点与疾病复杂的作用机制相对应,但其主要药效成分的研究仍不明确,为阐明其作用药效物质,本文采用网络
药理学及分子对接技术筛选,节约了大量人力、物力和财力,为新药的研发提供了一定的参考。
通过网络药理学研究,收集了31种sAT化学成分及其治疗IS靶标71个。GO和KEGG富集分析提示sAT化学成分治疗IS主要与血管内皮功能调节、细胞凋亡、炎症反应、钙离子超载生物过程相关。血管内皮功能调节是治疗IS的关键环节[31],sAT化学成分通过作用于VEGFA、EGFR、FGF2等核心靶标调控VEGF、PI3KAkt、HIF-1等信号通路,进而影响细胞增殖、迁移、血管生成正向调控和细胞外基质分解等生物过程。细胞凋亡贯穿IS发生、发展的整个过程,sAT化学成分通过作用于CASP3、BCL2L1等核心靶标调控Apoptosis、FOXO、MAPK等信号通路,进而影响细胞凋亡过程。研究表明,通过上调OGD VECs细胞和MCAO大鼠PI3K/AKT蛋白表达,促进Bcl-2表达,减少ROS的生成,减少细胞凋亡,可发挥脑保护作用[32]。炎症级联反应是IS发展过程中的一个关键因素,sAT化学成分可通过作用于TNF、PTGS2、IL1B等核心靶标,调控TNF、toll样受体、NOD样受体等信号通路,进而影响炎症过程。研究表明,在脑缺血早期阶段,促炎因子TNF-α的分泌或合成增加是导致脑梗死的主要原因[33]。钙信号通过激活内源性神经保护机制在保护脑缺血-再灌注损伤中发挥作用,sAT化学成分通过作用于MAPK1、MAPK8、PLC等核心靶标,调控钙信号通路,进而影响胞质钙离子正调控等生物过程。钙信号通路系统可以和其他信号通路调节细胞应激后的适应性,通过阻止胞外钙离子过度内流,避免细胞内钙离子超载对缺氧神经元进行保护[34]。
根据GO及KEGG富集分析结果,我们发现sAT化学成分治疗IS靶标多参与血管内皮功能调节,分子对接结果显示去葡萄糖竹节参皂苷Ⅳa、楤木皂苷D、竹节参皂苷Ib与血管新生靶标结合较好,很有可能是其治疗IS的药效物质。
VEGF是现公认最重要的也是最有效的一种高度特异性促血管内皮生长的细胞因子,直接参与缺血缺氧组织或器官的血管生成[35]。VEGF家族有许多成员,其中VEGFA是VEGF家族中最重要的成员,KDR是VEGF特异性结合高亲和力的受体,激活下游蛋白发挥生物功能,对于血管修复具有重要作用[36]。分子对接结果显示去葡萄糖竹节参皂苷Ⅳa和楤木皂苷D与VEGFA/KDR强烈结合,很可能是太白楤木皂苷治疗IS作用于VEGFA/KDR靶标的药效物质。MMPs是一组依赖钙离子和锌离子的蛋白内切酶,其中MMP2、MMP9与血管新生关系最为密切。分子对接结果显示,楤木皂苷D、去葡萄糖竹节参皂苷Ⅳa及竹节参皂苷Ib都能与MMP2及MMP9很好地结合。FGFs是由FGF基因家族编码的结构相关的一组蛋白质多肽,FGF家族在促进血管生长、改善神经功能缺损等方面发挥重要作用,FGF2是其家族中的一种,能间接促进VEGF生成,对于脑卒中后神经发生和血管生成至关重要。EGFR是一种具有酪氨酸激酶活性的跨膜糖蛋白,EGF与其受体EGFR结合后,磷酸化激活下游信号分子ERK和Elk-1,从而促进细胞生存,在细胞增殖及血管新生方面起重要作用。分子对接结果显示去葡萄糖竹节参皂苷Ⅳa和FGF2结合最好,竹节参皂苷Ib与EGFR结合最好。
基于VEGFA与血管新生过程密切相关并且与去葡萄糖竹节参皂苷Ⅳa对接效果最好,因此本研究选取去葡萄糖竹节参皂苷Ⅳa与对接靶标VEGFA,验证去葡萄糖竹节参皂苷Ⅳa是否通过作用于VEGFA靶标促进血管新生,发挥脑保护作用。通过复制HUVECs OGD/R模型,观察不同剂量去葡萄糖竹节参皂苷Ⅳa对HUVECs活性及VEGF的释放和蛋白表达的影响。结果显示,去葡萄糖竹节参皂苷Ⅳa能够提高细胞活性,促进VEGF的释放和蛋白表达且呈剂量-效应依赖关系。
综上所述,本研究通过网络药理学初步阐明了sAT化学成分治疗IS的可能作用机制,并利用分子对接技术对sAT化学成分促进血管新生治疗IS的药效物质及作用机制进行了初步探讨,共筛选出15种同时与多个血管新生相关靶标结合的化学成分,其中最具潜力的为去葡萄糖竹节参皂苷Ⅳa、楤木皂苷D及竹节参皂苷Ib,通过细胞实验验证了去葡萄糖竹节参皂苷Ⅳa促进血管新生,发挥脑保护作用的可能机制为上调HUVECs VEGF蛋白表达,促进VEGF释放,提高细胞活性,与分子对接预测结果一致,提示网络药理学结合分子对接技术可用于中药治疗疾病的药效物质及作用机制研究。
