中药一致性评价关键技术
——中药溶出-系统指纹定量法 评价溶出曲线相似性
2021-12-30张凡杨婷兰丽丽张沁怡迟晗笑孙万阳孙国祥沈阳药科大学药学院沈阳006药都本溪一致科技有限公司辽宁本溪7004暨南大学药学院广州5063
张凡,杨婷,兰丽丽,张沁怡,迟晗笑,孙万阳,孙国祥,*(.沈阳药科大学药学院,沈阳 006;.药都(本溪)一致科技有限公司,辽宁 本溪 7004;3.暨南大学药学院,广州 5063)
溶出度是指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下的溶出速率和程度[1]。固体制剂只有溶出才能被机体吸收,所以溶出度能反映药物在体内的吸收和利用,是评价药物工艺的重要指标。药物溶出曲线评价方法主要有差异因子(f1)法、相似因子(f2)法、溶出模型依赖法、Kalman滤波法、组分权重系数法和自身对照法等[2-3]。根据《普通口服固体制剂溶出曲线测定与比较指导原则》及相关文献[4-9],多采用f2法对中药固体制剂中单一组分或多组分进行溶出度测定,但是中药成分复杂多样,多组分协同发挥作用,测定单一或数个指标成分溶出行为不能充分体现制剂整体药效成分的溶出特性。在中药质量控制中应体现“整体观”,而f2法对差异限度要求过高,有1~2点相差10%则导致f2不合格。f2无溶出总量差异的简捷描述,因此不适合中药固体制剂溶出度评价。鉴于此,本文提出中药溶出-系统指纹定量法用于溶出曲线评价。 复方甘草片是常用镇咳祛痰药,收录于2020年版《中国药典》,其质量按照化学药控制方法对吗啡和甘草酸含量进行测定,无溶出度测定[10]。主要成分为甘草浸膏粉112.5 mg、罂粟果提取物粉4 mg、八角茴香油2 mg、樟脑2 mg和苯甲酸钠2 mg,这5种原料质量约占片重的90%。中药提取物成分约占片重的88%,因此复方甘草片实质是中药复方制剂,但因含吗啡和磷酸可待因等麻醉物质而被列入麻醉品管控,按化学药质量控制管理。2016年它被列入一致性评价289目录第97号,为国内特有品种,有36个药厂生产。孙国祥教授参与主持该药一致性评价时,鉴于中药固体制剂溶出曲线无统一的、被广泛认可的评价方法,从中药特殊性出发对11个厂家共39批复方甘草片紫外全指纹溶出曲线用Sm和Pm评价并与f2对比,找到了中药溶出曲线一致性评价的新方法。
1 中药溶出-系统指纹定量法原理
中药系统指纹定量法广泛用于HPLC指纹图谱评价和紫外全指纹溶出度法的累计溶出度计算,本文首次将其用于中药溶出曲线相似性评价。
1.1 中药溶出-系统指纹定量法[11-13]
把中药供试制剂溶出曲线各点溶出度值按时间顺序排列定义为供试溶出指纹向量,=(x1,x2,…,xn),把参比制剂溶出曲线各溶出度值按时间顺序排列定义为参比溶出指纹向量,=(y1,y2,…,yn),则与之间的夹角余弦即为定性相似度SF,但其受溶出度大值影响。为消除其影响,将作=(1,1,…,1),作=(x1/y1,x2/y2,…,xn/yn),则和之间的夹角余弦即比率定性相似度SF',将SF与SF'的均值Sm称为溶出-宏定性相似度,见式(1);用其整体监测供试溶出曲线指纹大小分布比例与参比制剂溶出曲线指纹大小分布比例的相似程度,一般Sm≥0.90时供试制剂溶出曲线与参比溶出曲线很相似。投影含量相似度C用来揭示两制剂溶出曲线对应指纹溶出度的投影含量相似程度(大溶出指纹权重大,掩蔽小指纹),定量相似度P是宏观含量相似度R经SF校正所得(大小指纹等权且消除溶出度大小交叠效应),将C和P的均值Pm称为溶出-宏定量相似度,用来表征两制剂溶出曲线中全部对应指纹总量百分比,就是供试制剂溶出曲线下面积相当于参比制剂溶出曲线下面积百分比,是以参比制剂溶出曲线面积为标准来定量描述供试制剂溶出曲线下面积百分数,见式(2)。利用溶出-宏定性相似度和溶出-宏定量相似度来定性定量评价溶出曲线相似性方法,称为溶出-系统指纹定量法,见图1,据此将药物溶出曲线相似性划分为8级,见表1。

表1 中药溶出-系统指纹定量法划分中药溶出曲线相似性标准 Tab 1 Similarity grades standard of TCM dissolution curve divided by DSQFM
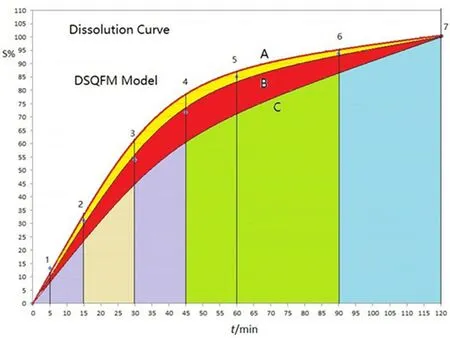
图1 三种类型中药溶出定量指纹曲线Fig 1 Three types of quantitative fingerprint dissolution curves of TCM
1.2 f2因子评价法[14-16]
f2因子是一种简单的非模型依赖方法,是用来评价相同溶出条件下受试与参比制剂溶出曲线相似性。f2越接近100,则两条曲线越完全一致;f2大于50,认为两条曲线相似。根据公式(3)计算f2,其中Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。f2会放大Rt与Tt差异值,其数值和溶出量对应差异不够简单明确。一般受试制剂溶出曲线指纹与参比制剂溶出曲线指纹相似度满足①Sm≥0.9和② 90%≤Pm≤110%时则f2大于50。但对中药复杂体系要适当放宽标准,满足①Sm≥0.9和② 70%≤Pm≤130%即认为受试制剂溶出曲线相似性合格,此时f2可能会低于50,但不影响中药溶出-系统指纹定量法对溶出曲线相似性的定量判断。
1.3 中药紫外全指纹溶出度测定法[13,17-21]
中药紫外光谱突出反映中药主组分化学物质对紫外光的吸收信息,由不饱和双键、三键、长共轭体系结构及少量特殊饱和键产生(由π→π*,n→π*,n→σ*跃迁产生)。中药紫外全指纹溶出度测定采用HPLC-DAD法,以空心PEEK管代替色谱柱测定样品的非分离色谱图(所有组分在同一色谱峰内),通过记录中药全部混合主组分化学指纹的在线紫外光谱来获得整体化学物质在190~400 nm紫外光谱指纹图谱。有两种测定方法:① 2 h溶出标准谱法:以2 h点作为全溶出紫外标准指纹图谱来定量测定其他取样点的溶出度,这种方法会出现2 h组分存在未全溶出情况;② 全溶出标准谱法:取本品10片,精密称定,研细,精密称取细粉适量(约相当于1片重),置900 mL溶出介质中,超声10~30 min至完全溶解(时间通过预试验测定),测定该溶出点为全溶出紫外标准图谱来定量测定其他取样点紫外指纹的溶出度(装置图见图2)。第二种方法由于采用非样品溶出环境常会导致组分过度溶出,因此对于不同厂家同一种制剂和不同批次采用第2种方法评价为佳。此两种方法均监控190~400 nm紫外光谱的221个紫外波长下的指纹点,采用中药系统指纹定量法计算,实际仍然使用公式1~2。用【中药主组分一致性数字化评价系统2.0】软件(带审计追踪)计算溶出紫外指纹谱的Sm和Pm,以Pm计算累积溶出度(溶出介质900 mL,每次取样2.5 mL,补液体积为2.5 mL),按公式(4)计算;不补液时按公式(5)计算。

图2 紫外全波段(190~400 nm)监测中药全化学指纹成分的溶出度装置图Fig 2 Dissolution apparatus for monitoring the overall chemical fingerprints of TCM components with UV full-band(190~400 nm)
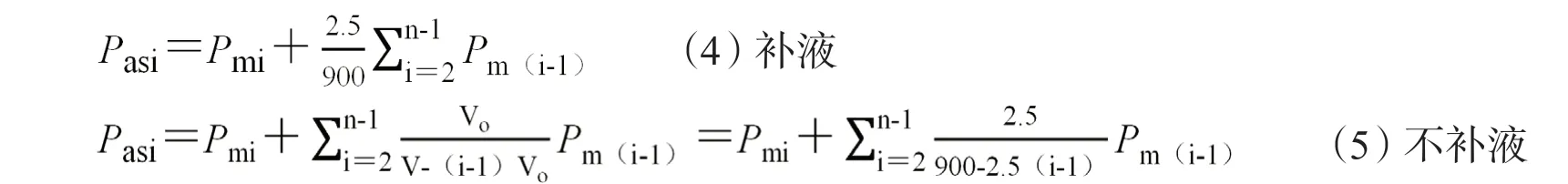
复方甘草片质量一致性评价中有12个药厂采用紫外全指纹溶出度测定法评价复方甘草片体外溶出度差异。经过多年应用试验证明该法能有效区分复方甘草片工艺中存在的问题,为复方甘草片制剂工艺一致性控制提供了有效监测方法[13]。但是文献[13]仍使用f2评价溶出曲线,本文使用中药溶出-系统指纹定量法评价溶出曲线相似性。紫外全指纹溶出度测定法和中药溶出-系统指纹定量法是使用同一套计算公式,只是前者是计算各溶出取样点的溶出度,后者是对整条溶出曲线计算供试制剂与参比制剂间的两条溶出曲线相似性。
2 仪器与试药
Agilent 科技有限公司Agilent 1100型液相色谱仪(配有二极管阵列检测器、四元梯度泵、在线脱气机、自 动 进 样 器)、Agilent OpenLAB CDS Chemstation(Edition C.01.07)网络工作站、ZRS-8G溶出度测定仪(天津新天光分析仪器技术有限公司)、ESE120BⅡ电子分析天平(天津市德安特传感技术有限公司)、JP-040S超声波清洗器(深圳市洁盟清洗设备有限公司)。磷酸(色谱纯,天津市科密欧化学试剂有限公司)、盐酸(色谱纯,天津市凯信化学工业有限公司)、乙腈(色谱纯,山东禹王实业有限公司化工分公司)、纯净水(沈阳娃哈哈启力食品有限公司)。复方甘草片共39批,由厂家A(S1~S3)、B(S4~S6)、C(S7~S9)、D(S10~S12)、E(S13~S15)、F(S16~S20)、G(S21~S23)、H(S24~S26)、I(S27~S29)、J(S30~S34)、K(S35~S39)生产。
3 方法
3.1 色谱条件
聚醚醚酮空心管替换色谱柱(PEEK Tube,5000 mm×0.18 mm);柱温:35.0℃;流动相:乙 腈-水-磷 酸(40∶60∶0.2);流 速:0.7 mL·min-1;进样量:5 μL;检测波长:190~ 400 nm(DAD)。
3.2 紫外全指纹溶出度测定时不同点取样溶液
3.2.1 溶出介质为pH 1.0盐酸溶液 采用桨法测定样品溶出度。取同一厂家同一批号样品6片分别投入溶出杯中,pH 1.0盐酸(精密量取盐酸9 mL,用水稀释至1000 mL,摇匀,即得)。体积为900 mL,温度为37℃,转速50 r·min-1,溶出时间取样点分别为5、30、60、90、120、180、240、300 min,取样体积为2.5 mL,仪器自动取液并补充相同体积及温度的溶出介质。
3.2.2 溶出介质为纯化水 采用桨法测定样品溶出度。取同一批样品6片分别投入溶出杯中,溶出介质体积为900 mL,温度为37℃,转速50 r·min-1,溶出取样时间点分别为5、15、30、45、60、90、120 min,取样体积2.5 mL,仪器自动取液并补充相同体积及温度的溶出介质。
3.2.3 全溶出溶液制备 取复方甘草片(S1)10片,精密称定,研细,精密称取1片量,置于900 mL的溶出介质(纯化水)中,超声15 min至完全溶解,摇匀,用0.45 μm水系微孔滤膜滤过,即得。
3.3 紫外全指纹溶出度测定法
每个企业取3~5批不同批复方甘草片,每批6片,制备供试品溶液,进样检测。将测得非分离色谱图导出在线紫外光谱*.csv文件,再导入【中药主组分一致性数字化评价系统2.0】软件(带审计追踪),分别以全溶出点或120 min、300 min紫外指纹图谱做标准计算各点溶出液的Pm,其中Pasi即为各时间点相对累积溶出度。
4 结果与讨论
4.1 方法学验证
4.1.1 精密度试验 取全溶出供试品溶液适量,连续测定6次,按平均值法生成紫外对照指纹图谱,结果平均Sm=1.00(RSD=0.0%);平均Pm=100.0%(RSD=0.7%),结果表明仪器精密度良好。
4.1.2 稳定性试验 取全溶出供试品溶液适量,分别于室温下放置0、3、6、9、12、24 h后进样测定,以0时测定的紫外指纹图谱为标准,评价其他5次测定紫外指纹图谱,结果Sm、Pm的RSD均小于2.0%,表明供试品溶液在24 h内稳定。
4.1.3 重复性试验 取厂家A样品(S1),平行制备供试品溶液6份,再进样测定,按平均值法生成紫外对照指纹图谱,结果Sm、Pm的RSD均小于2.0%,表明方法重复性良好。
4.2 不同溶出介质中溶出情况比较
以不同时间相对累积溶出度为纵坐标,溶出时间为横坐标绘制累积溶出曲线,不同企业样品在水和pH 1.0盐酸溶液中的溶出曲线见图3。
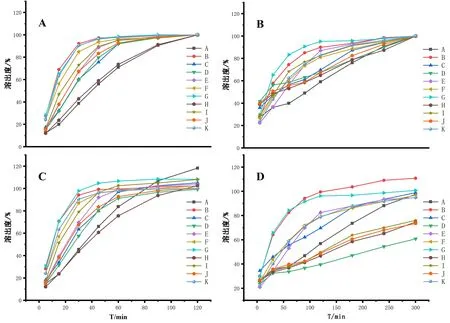
图3 复方甘草片在水介质和 pH 1.0盐酸介质中的溶出曲线Fig 3 Dissolution curve of compound liquorice tablet in water and HCl(pH 1.0)
4.3 用两种方法评价同一厂家批内溶出曲线相似性
同一厂家内,选择各厂家溶出曲线均值为参比,分别采用f2法和中药溶出-系统指纹定量法,对同一厂家内不同批次的样品进行溶出曲线相似性比较。以最末点为标准,在水介质和pH 1.0盐酸介质中39批复方甘草片批内除S33(pH 1.0盐酸为介质时f2=43)外其他38批复方甘草片的溶出曲线相似性都合格(f2都>50)。以全溶出为标准,S2、S20和S27等3批制剂在水介质中溶出曲线相似性不合格(f2<50)。以全溶出为标准时,在pH 1.0盐酸介质中有13批复方甘草片(S16、S18~19、S22、S25~26、S28~29、S31~36)批内溶出曲线相似性都不合格(f2均<50),总计有16批结果的f2不合格,见表2。把39批复方甘草片的f2作为纵坐标,Pm作为横坐标作图(见图4A),图中底部方框内按照中药溶出-系统指纹定量法只要满足①Sm≥0.9和② 70%≤Pm≤130%即可认为中药溶出度合格,这个标准会把部分f2值低的制剂的溶出曲线纳入合格范围,比如上述16个不合格的f2对应复方甘草片溶出曲线按新方法评价只有3个数据(S26、S29和S33)逸出。当溶出曲线满足①Sm≥0.9和② 90%≤Pm≤110%时f2值都>50,因此中药溶出-系统指纹定量法规定在以上标准范围内其评价结果与f2评价结果完全一致。
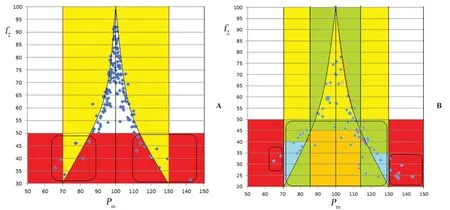
图4 复方甘草片批内(A)及批间(B)溶出曲线一致性评价时f2与溶出-宏定量相似度关系Fig 4 Quality consistency of compound liquorice tablet dissolution curves intro (A)or inter(B)different batches of f2 versus dissolution-macro quantitative similarity

表2 在两种不同介质中用溶出-系统指纹定量法和f2法评价11厂家批内溶出曲线相似性 Tab 2 Similarity of dissolution curve of 11 manufacturers in two media (DSQFM and f2)
4.4 用两种方法评价厂家之间的溶出曲线相似性
4.4.1 选择厂家A为参比制剂评价溶出曲线相似性 不同厂家之间溶出曲线评价时,首先选择厂家A为参比制剂,其余生产企业的复方甘草片作为受试制剂,分别采用f2法和溶出系统指纹定量法评价。对生产工艺不同和辅料不尽相同的11家企业进行溶出曲线相似性评价结果见表3。结果对于不同厂家溶出曲线,两种评价方法结果差异较大:例如厂家D在以末点为标准,溶出介质为水时选择厂家A为参比制剂,f2<50为不合格。用Sm>0.90和Pm=118.4%,厂家D制剂相当于厂家A制剂118.4%,用新方法制订的标准评价是合格的,新方法优点在于明确给出了被评制剂溶出度相当于参比制剂溶出曲线的具体百分值。若f2<50,新给出Pm可判断供试制剂溶出总量,对于指导提高工艺具有明确判定指标值。根据中药特殊性把Pm>70%认为是合格。用Sm和Pm评价溶出曲线时选择不同溶出介质和不同参比制剂时,评价结果显著不同。这可清晰反映不同厂家生产的复方甘草片的体外溶出差别,说明其工艺存在差异。选择厂家A为参比制剂只有厂家H的溶出曲线相似性合格,其他均不相似。当以全溶出为标准时只有在水中厂家H的溶出曲线与A相似性合格。
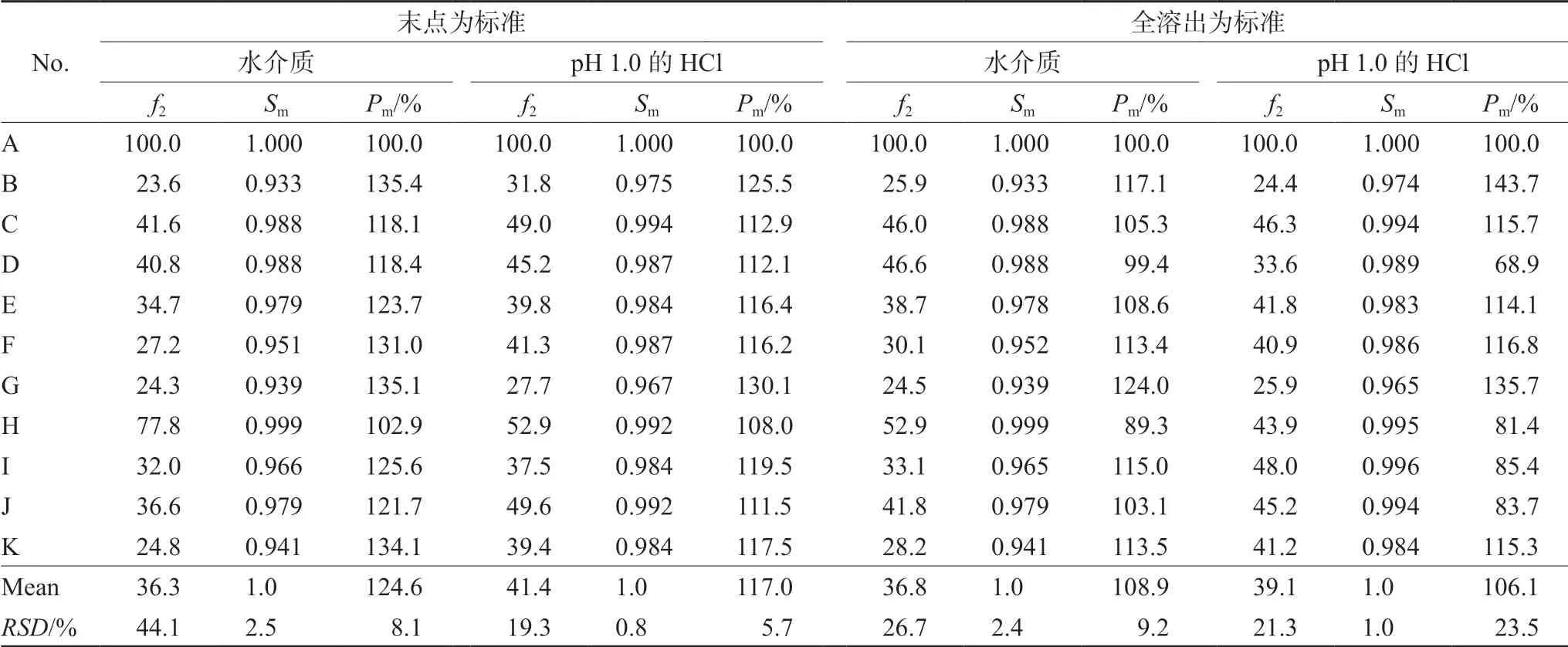
表3 以厂家A为参比制剂评价11个厂家间复方甘草片溶出曲线相似性结果 Tab 3 Similarity of dissolution curve of compound liquorice tablet from 11 manufacturers evaluated by reference preparation manufacturer A
4.4.2 以11厂家溶出曲线均值为参比评价溶出曲线相似性 选择11个厂家的均值为标准溶出曲线,分别采用f2法和溶出-系统指纹定量法评价。对生产工艺不同和辅料不尽相同的11家企业进行溶出曲线相似性评价结果见表4。无论采用末点法,还是全溶出为标准,在水介质中厂家C、D、E、F、I、J复方甘草片的溶出曲线f2均大于50。但在pH 1.0的HCl介质中,末点法为标准B、C、D、E、F、H、I、J、K的f2均 大 于50;但以全溶出为标准时,在pH 1.0的HCl介质中A、C、E、F、K的f2均大于50。选择标准不同则评价结果有差异。把11个厂家的复方甘草片的f2作为纵坐标,溶出-宏定量相似度作为横坐标作图(见图4B),图中底部三个方框内按照中药溶出-系统指纹定量法只要满足①Sm≥0.9和② 70%≤Pm≤130%即可认为中药溶出度合格,但f2低于50,此时只有10个数据不合格。一般溶出曲线是DG1、DG2时对应f2基本大于50,部分DG3溶出曲线的f2也合格(与制剂溶出规律有关)。通过本文数据可知如果溶出曲线相似度落在DG1和DG2区间则f2基本合格。对于DG3区间需要具体计算。因此溶出系统指纹定量法,当溶出曲线满足①Sm≥0.9和② 90%≤Pm≤110%时f2大于50,因此对于溶出效果好的制剂可以定在此范围。如果中药制剂溶出度较差可以考虑定在DG3。特殊情况可以把溶出标准定在DG5即满足①Sm≥0.9和② 70%≤Pm≤130%。中药制剂的溶出曲线相似性标准要根据制剂的复杂程度来确定。

表4 以均值为标准评价11个厂家复方甘草片溶出曲线相似性结果 Tab 4 Similarity of dissolution curve of compound liquorice tablet from 11 manufacturers evaluated by the mean value
5 结论
本文提出中药溶出曲线相似性评价法——中药溶出-系统指纹定量法,将溶出曲线相似性等级划分为8级,通过11个厂家复方甘草片溶出曲线数据,找到f2与溶出-宏定量相似度关系,当溶出曲线满足①Sm≥0.9和② 90%≤Pm≤110%时f2>50,因此对溶出效果好的中药制剂可把标准定在此范围;如果中药制剂溶出度较差可考虑定在85%≤Pm≤115%;特殊情况可把溶出标准定为Sm≥0.9和70%≤Pm≤130%。中药制剂溶出曲线相似性标准要根据制剂复杂程度和制剂工艺来确定。
