一株洱海来源产尿酸氧化酶菌株的分离、鉴定及其酶学性质研究
2021-12-30杨润芬杨力权刘红艳李馨伟尹以瑞
杨润芬, 杨力权, 刘红艳, 李 蕾, 李馨伟, 桑 鹏, 尹以瑞
(大理大学农学与生物科学学院,云南大理 671003)
尿酸为三氧基嘌呤(C5H4N4O3),是生物体嘌呤代谢的产物,微溶于水,易形成晶体,过高的血尿酸浓度对机体来说是有害的, 尿酸代谢不平衡会导致痛风、 肾结石和血管类等疾病 (孙泽锐等,2021) 。 尿酸氧化酶作为生物体内嘌呤降解代谢途径的关键酶, 能催化尿酸氧化为尿囊素和过氧化氢。 许多生物,如狒狒、猪等,都能利用尿酸氧化酶将其分解为易溶于水的尿囊素(熊润松等,2012),尿囊素在体内具有良好的溶解性, 溶解度是尿酸(0.5 mmol/L,37 ℃) 的 5 ~ 10 倍, 约为 5 mmol/L(37 ℃),不发生积累而直接排出体外(Bosly 等,2003;章茹等,1997)。
尿酸氧化酶在自然界广泛存在,动物、植物、真菌和细菌中均有发现(张金龙等,2010;刘劲等,2008)。 目前上市的尿酸氧化酶药物有猪-狒狒尿酸氧化酶嵌合体和重组黄曲霉尿酸氧化酶两种, 而国内还鲜见有进入临床的尿酸氧化酶类药(张荣欣等,2008)。 有研究表明,微生物如鼠李糖乳酸杆菌(L.rhamnosus)经过诱导后具有较强的尿酸降解能力(黄琳秋等,2016),植物乳杆菌(Lactobacillus plantarum)基因组中含有尿酸氧化酶基因(张晓晖,2019;白运焕等,2018)。 其中, 微生物来源的尿酸氧化酶如Aspergillus flavus (叶泽,2019) 和 Bacillus fastidiosus(Roda等,2006),活性均在 10 U/mg 以上,而来自豆类植物的尿酸氧化酶活性为2 ~ 6 U/mg ( Montalbini 等,1999),来自哺乳动物的尿酸氧化酶如猪和狒狒的活性分别为5 U/mg 和1 U/mg(陈劲春等,2015;Kelly 等,2001)。 微生物来源的尿酸氧化酶活性明显高于其他来源,因此,微生物成为了新的尿酸氧化酶的重要来源。
本研究以云南大理洱海底泥为试验材料,经过富集培养、筛选分离出尿酸降解菌,并对所获得的一株尿酸降解菌进行发酵培养, 获得胞内的酶进行酶学性质研究, 旨在为今后洱海尿酸氧化酶的研究和利用奠定基础。
1 材料与方法
1.1 试验材料 本次试验样品来自大理洱海,在采样点 (N25°36′ ~ 25°58 ′,E100°06′ ~ 100°18′)采集20 g 底泥作为试验材料。
1.2 培养基及试剂
1.2.1 培养基 尿酸基础培养基(g/L):MgSO40.5,NaCl 0.1,K2HPO4·3H2O 0.5,KH2PO20.5,尿酸2,pH 7.0;固体分离培养基添加 2% 的琼脂。
产尿酸氧化酶发酵培养基(g/L):蛋白胨10,蔗 糖 20,NaCl 0.5,MgSO41,KH2PO41,FeSO4·7H2O 0.01,尿酸 1.5,pH 7.0。
1.2.2 试验仪器 电子分析天平、 高压蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司);艾柯超纯水生成仪、紫外可见光分光光度计(上海菁华仪器公司);高速冷冻离心机(上海安亭科学仪器公司);SPX-250B-D 型恒温振荡培养箱 (上海一恒科学仪器有限公司);Eppendorf PCR 仪、BIORAD 电泳仪(北京六一生物科技有限公司)。
1.3 试验方法
1.3.1 产尿酸氧化酶菌株的富集与筛选 取10 g洱海底泥样品,加入到尿酸基础培养基中,振荡富集培养3 d。 梯度稀释分别做5 个稀释梯度,分别稀释 10-1、10-2、10-3、10-4、10-5后涂布于含有尿酸基础培养基上培养,挑选单菌落,转接到尿酸氧化酶发酵平板中进一步纯化, 获得一株纯培养菌株保存于甘油管冻存,待用。
1.3.2 菌株生长和胞内、 胞外尿酸氧化酶活性检测 挑取上述产尿酸氧化酶菌株单菌落接种于200 mL 的尿酸发酵培养基中,25 ℃、180 r/min振荡培养, 每隔12 h 取发酵液检测菌体浓度(OD600nm)和发酵液中尿酸的残余量(OD290nm)。 每次检测取1 mL 发酵液用于测菌体浓度, 取50 mL发酵液8000 g,室温离心20 min 取上清发酵液为胞外酶,并测发酵液尿酸含量,收集菌体加50 mL PBS 缓冲液(pH 8.0)悬浮后超声波破碎 20 min,裂解液在4 ℃、12000 g,离心 20 min,取裂解上清液为胞内酶。 以浓度为0.06 mmol/L 的尿酸为底物,加入50 μL 粗酶液,反应 15 min 后使用紫外光分光光度计测定OD290nm吸光值。酶活力计算公式如下:
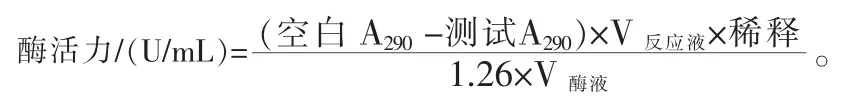
1.3.3 产酶菌株16S rRNA 基因测序及鉴定 收集尿酸降解菌纯培养菌体,根据北京天根生化科技有限公司提供的试剂盒以及说明书进行DNA 的提取。 使用通用引物 27F:5’ -AGAGTTTGATCCTGGCTCAG-3’和 1492R:5 ’ -GGTTACCTTGTTACGACTT-3’扩增细菌 16S rDNA。PCR 扩增条件为:预变性 94 ℃,4 min;变性 94 ℃,30 s;退火55 ℃,35 s;延伸 72 ℃,90 s;32 个循环后,最后延伸 72 ℃,5 min。 PCR 产物在1.0%琼脂糖凝胶电泳鉴定, 使用胶回收试剂盒进行PCR 产物回收。 将PCR 回收产物送至昆明擎科生物科技有限责任公司进行测序, 测序结果上传至 GenBank (http://www.ncbi.nlm.nih.gov/genbank), 并在 BLAST 数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行比对, 根据细菌 16S rRNA 基因序列相似性, 利用MEGA 7.1 软件进行系统进化分析。
1.3.4 最适反应温度的测定 以0.06 mmol/L 的尿酸为底物,加 50 μL 粗酶液,分别在 20、25、30、35、40、45、50、55 ℃下测该酶的活性,每组试验设置 3个平行试验组,一个对照组(加入100 ℃高温酶活酶),反应15 min 后分别测定在OD290nm的吸光度值。
1.3.5 最适反应pH 用不同的pH 缓冲液(pH 3~8 磷酸氢二钠-柠檬酸缓冲液,pH 8 ~ 9 甘氨酸-NaOH 缓冲液) 溶解尿酸至浓度为0.06 mmol/L,在最适温度下反应15 min 后,测OD290nm的吸光度值。
1.3.6 温度和pH 对粗酶液稳定性的影响 将1 mL粗酶液分别置于不同的温度(30、35、40 ℃)下保温, 在保温 20、40、60、80、100、120 min 时测定酶活。以保温0 min 温度下所测得的酶活为对照组,其余温度下所测得的酶活与其相比, 并计算相对酶活,用相对酶活绘制出酶的热稳定性曲线。每组试验设置3 个平行。
取适量0.5 mL 粗酶液分别加入1.5 mL 不同pH 缓冲液(pH 3 ~ 10)孵育 12 h 或 24 h 后作为反应的酶液加入反应体系中, 以生理盐水(0.9%NaCl)稀释的粗酶液作为对照组。在最适温度下反应15 min,测吸光度值。
2 结果
2.1 菌株生长与发酵液中尿酸的降解 在发酵培养基中培养,DLEH-68 的生长情况(OD600nm)和对尿酸的降解情况(OD290nm)如图1 所示。 结果表明,随着菌体量增加,尿酸逐渐被降解;培养前36 h 菌株DLEH-68 处于对数生长期, 尿酸含量迅速下降;至48 h 时,菌株进入稳定期,尿酸含量趋于稳定。 这说明菌株DLEH-68 能产生尿酸降解相关酶,利用尿酸提供生长所需碳源和氮源。
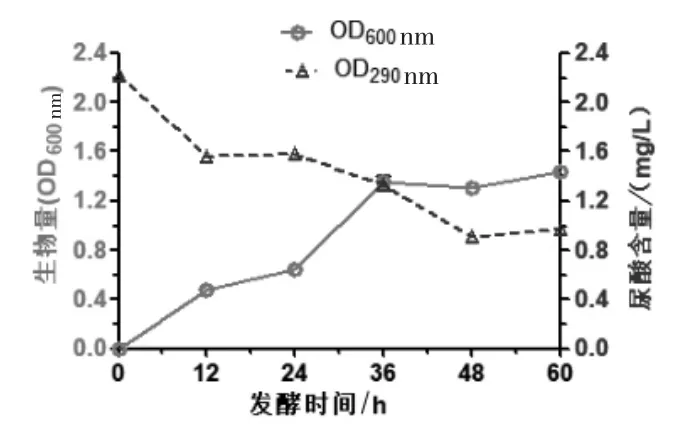
图1 菌体生长与尿酸降解
2.2 胞内、 胞外尿酸氧化酶活性测定 如图2 所示,胞内的活性无论在各个培养时间段(12~48 h)都高于胞外,胞内的活性在培养12 h 时最高,由此确定该菌株所产尿酸氧化酶以胞内酶为主,12 h时活性达到最高。

图2 不同培养时间胞内和胞外尿酸氧化酶活性
2.3 菌株DLEH-68 分子生物学鉴定 通过16S rRNA 序列通用引物PCR 和测序, 获得1437 bp 16S rRNA 基因核苷酸序列, 序列在线上传至GenBank, 登录号:NO.MW090727, 与菌株 Klebsiella oxytoca N8 (登录号:KM349413.1)亲缘关系最近,同源性为 99.65%(图 3),基于 16S rRNA 序列同源性构建系统进化树, 菌株DLEH-68 与Klebsiella 属聚在一枝,故通过分子生物学鉴定该菌株为克雷伯氏菌属菌株, 命名为Klebsiella sp.DLEH-68。
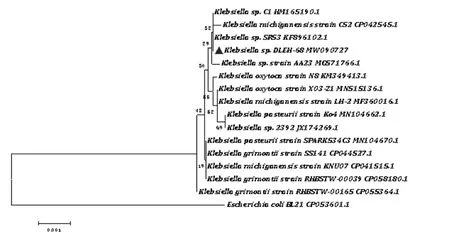
图3 基于16S rRNA 序列同源性构建菌株DLEH-68 的系统进化树
2.4 最适温度和pH 如图4a 所示, 菌株DLEH-68 来源尿酸氧化酶的最适温度为35 ℃。 在20 ℃时基本无活性,随着温度升高活性渐渐的增长,在35 ℃时达到最高, 随后逐渐降低直至55 ℃彻底失去活性。 如图4b 所示,其最适反应pH 为7.0,在pH 3.6 开始有活性,越接近中性pH 活性越高,在pH 7.0 时达到最高,pH>7.0,活性逐渐降低,在pH 6.6 ~ 7.6 保持60%以上。
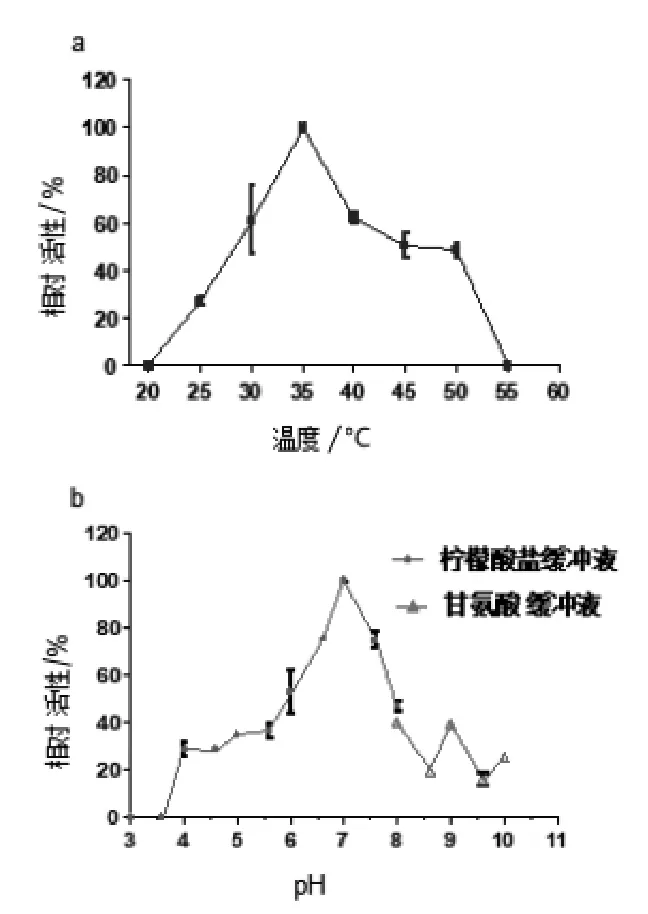
图4 温度(a)和 pH(b)对菌株 DLEH-68来源尿酸氧化酶活性的影响
2.5 温度对酶稳定性的影响 在30、35、40 ℃三个温度下热处理, 结果如图5 所示,35 ℃下处理20 min 后达到最高, 随着热处理时间的延长,活性逐渐降低,在处理80 min 时降低至60%并处于稳定至100 min, 在处理120 min 后急剧下降至13%。 在温度为30 ℃和40 ℃下热处理酶丧失活性的速度较快, 在处理60 min 后均下降至75%,随着处理时间的延长,40 ℃下下降的最快,30 ℃下降速率较慢,当处理120 min 后降至30%。

图5 温度对菌株DLEH-68来源尿酸氧化酶稳定性的影响
2.6 pH 对酶稳定性的影响 菌株DLEH-68 来源尿酸氧化酶分别在pH 3 ~ 10 中处理12 h 和24 h,结果如图 6 所示。 在处理 12 h 后,该酶从pH 3 开始有活性,pH 越接近中性活性越高,并在中性pH 7 时达到最大, 有最初的43%升高到92%, 之后随 pH 从 7 升高到 10, 酶活性逐渐降低,在 pH 10 时降至 40%。 在处理 24 h 后,pH 3、pH 3.6 均没有活性,从pH 4 开始有35%的活性,也是随着pH 越接近于中性,酶活性越高,但都低于处理12 h 的活性。 在pH 7 ~ 10, 活性逐渐降低,当pH 到10 时活性降到14%。
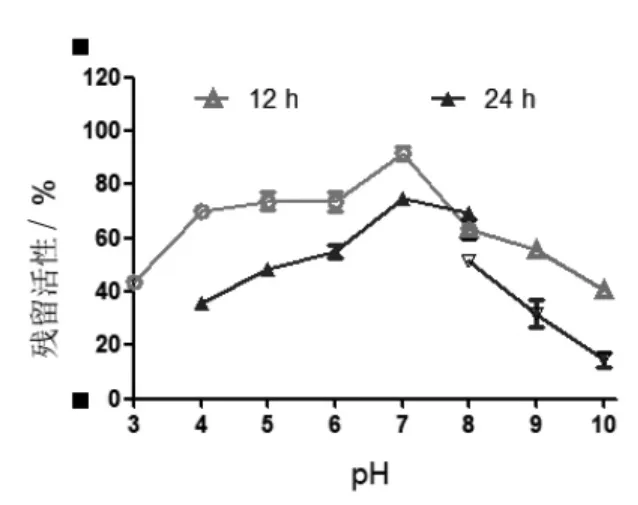
图6 pH 对菌株DLEH-68来源尿酸氧化酶稳定性的影响
3 讨论
尿酸氧化酶作为治疗高尿酸症的最有发展优势和最具有潜力的一类药, 越来越受到人们的重视和关注, 而微生物具有易于培养和代谢类型多样的特点。由此产生很多对人类有益的代谢产物,是尿酸氧化酶的一个重要来源,为现代医药的发展做出了重大贡献。 对现有微生物资源进行高通量筛选, 有可能找到性能上更适合医药应用的酶(咸静女等,2018;张玉然等,2016)。 近年来不断有研究在挖掘和探究产尿酸氧化酶的细菌、真菌,目前已知的产尿酸氧化酶微生物有产朊假丝酵母属,芽孢杆菌属,曲霉属,微杆菌属,节杆菌属等( 薛璟等,2011;程新等,2009)。有报道表明Klebsiella pneumoniae 来源的尿酸氧化酶是一种新型的黄素腺嘌呤二核甘酸(FDA)依赖的尿酸氧化酶 (Hpxo)(Hicks 等,2013;Katherine等,2009)。 这预示着菌株 Klebsiella sp. DLEH-68 来源的尿酸氧化酶可能也是一种FAD 依赖的尿酸氧化酶,在检测其活性过程中,所需FAD可能来自细胞裂解液。
本研究从洱海底泥筛选出的这株尿酸降解菌, 通过发酵发现其为产尿酸氧化酶菌株-克雷伯氏菌(Klebsiella sp. DLEH-68),对其活性进行试验测定, 最终确定获得的降解尿酸胞内酶的最适pH 为7, 最适温度为35 ℃, 处于人体体温范围, 对未来开发用于痛风病人的临床诊断与注射治疗有很大的潜力和研究价值。
