基于壳聚糖的磁性吸附水凝胶微球的制备与表征
2021-12-30周卿云朱镕泽吴江渝王大威曾小平
周卿云,柯 雪,朱镕泽,吴江渝,王大威,曾小平
武汉工程大学材料科学与工程学院,湖北 武汉430205
现如今,“快时尚”风潮席卷全球,服装更新换代速度大大加快,导致纺织印染行业的染料废水问题空前严峻,对于染料吸附材料的需求也日益增长。处理染料废水的常见方法有化学处理法、生物处理法以及物理处理法[1-2]。其中,物理处理法与其他两种方法相比具有低活化能甚至无需活化能、吸附速率快、可循环使用等优点而拥有广泛的应用。物理处理法又可细分为离子交换法、吸附法、膜分离法、高能物理法等[3]。其中吸附法因其操作简便、低成本等优点而备受关注[4]。吸附法选用的材料往往需具有存量较大、无毒害、不会造成二次污染等特点。
甲壳素是地球上含量第二大的天然聚合物,经脱乙酰化处理后可得其衍生物—壳聚糖(chitosan,CS)。与甲壳素相比,CS的结构中含有大量的氨基和羟基,从而易于实现功能化改性。其优异的可降解性和抗菌性能也使得它在环境工程领域有很好的发展前景。CS及其复合材料在NH4+的吸收[5]、重金属离子的捕集[6-7]和染料分子的去除[8-13]都取得了很好进展。
埃洛石纳米管(halloysites nanotubes,HNΤs)是一种具有管状纳米结构的天然无机矿物材料,具有大长径比、管壁内外带不同种电荷等诸多特点。这些特性使得HNΤs/聚合物纳米复合材料可实现以较低的成本获得特殊的机械、热和生物性能[14]。目前,HNΤs/CS复合材料在环境污染处理和生物医药等领域都显现出优异的性能[15-17]。对于吸附材料的研究往往注重提升吸附效果而忽视了吸附材料的后处理问题。本研究采用原位共沉淀法制备了Fe3O4@HNΤs/CS磁性复合水凝胶微球,可以同时用于吸附阴离子染料和阳离子染料,且可通过磁场快速分离。
1 实验部分
1.1 主要原料
CS(100~200μm,脱乙酰度≥95%,上海麦克林生化科技有限公司);六水合三氯化铁(FeCl3·6H2O,分析纯)、四水合氯化亚铁(FeCl2·4H2O,99.95%)、乙酸(CH3COOH,分析纯)、氢氧化钠(NaOH,分析纯)(国药集团化学试剂有限公司);不做进一步处理而直接使用。HNΤs(河北丹煦矿产品贸易有限公司)经纯化后使用。
1.2 HNΤs的纯化
在去离子水中加入适量HNΤs原料,超声,使HNΤs稳定分散于去离子水中。静置使不溶性SiO2杂质沉淀,取上层清液,离心。重复上述步骤直至样品在去离子水中再无不溶性沉淀残留。真空干燥,即得纯化后的HNΤs。
1.3 纯CS水凝胶微球的制备
取CS溶于质量分数为2%的醋酸溶液中,配制质量分数为2%的CS溶液。超声脱泡,用注射器将所得溶液逐滴加入到1.25 mol/L的NaOH溶液中,静置24 h至其完全凝胶。用去离子水清洗凝胶微球至中性,置于蒸馏水中备用。
1.4 Fe3O4@HNΤs/CS磁性水凝胶微球的制备
称取一定量纯化HNΤs,加入到质量分数为2%的醋酸溶液中,超声至均匀分散。将CS溶解于分散液中得质量分数2%的CS溶液。取一定量Fe3+与Fe2+摩尔比为2∶1的混合液加入CS溶液中,在氮气保护下搅拌30 min。超声脱泡,用注射器将所得混合液逐滴加入1.25 mol/L的NaOH溶液中,静置24 h至其完全凝胶。用去离子水清洗凝胶球至中性,置于蒸馏水中备用。改变HNΤs用量,得到HNΤs占CS质量0%、10%、20%、30%、40%的磁性复合水凝胶微球,分别标记为HNΤs00、HNΤs10、HNΤs20、HNΤs30、HNΤs40。
1.5表 征
测试样品经冷冻干燥,然后真空喷金处理后采用扫描电子显微镜(scanning electron microscope,SEM)在5 kV电压条件下对水凝胶球的截面形貌结构进行观察。
1.6 吸附性能
配制20 mg/L的亚甲基蓝(methylene blue,MB)溶液和100 mg/L的刚果红(Congo red,CR)溶液。取一定量水凝胶微球,分别加入到5 mL MB溶液和5mL CR溶液中,在50℃的条件下,每隔20 min采用Perkin-Elmer紫外-可见光分光光度计测试上层清液吸光度。CR和MB最大紫外吸收峰分别在496 nm和664 nm,根据最大吸收峰处的吸光度计算水凝胶对染料的脱色率与吸附量。脱色率(decolorization rate,DR)计算公式为:
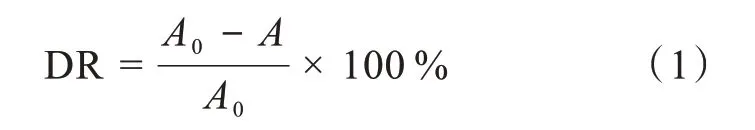
式(1)中:A0为初始MB或CR溶液最大吸收峰处的吸光度,A为不同时刻测定的MB或CR溶液的最大吸收峰处的吸光度。因染料溶液的浓度与吸光度成正比,可由平衡吸光度计算染料溶液的平衡质量浓度,进一步计算水凝胶的吸附量:
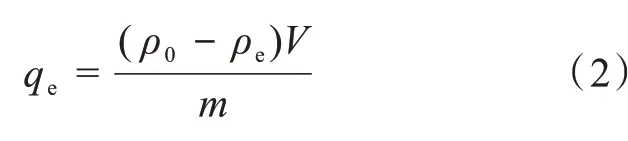
式(2)中:qe为单位质量的水凝胶平衡时的染料吸附量(mg/g),ρ0为染料溶液的初始质量浓度(mg/L),ρe为染料溶液的最终质量浓度或平衡质量浓度(mg/L),V是染料溶液的体积(L),m是用于吸附的水凝胶的质量(g)。
2 结果与讨论
2.1 磁性复合凝胶微球的制备与形貌
通过原位共沉淀法制备了Fe3O4@HNΤs/CS磁性复合凝胶微球,实验流程如图1所示。CS溶液、Fe3+与Fe2+摩尔比为2∶1的混合液和分散好的HNΤs混合后形成均匀的分散液,用注射器逐滴加到1.25 mol/L的NaOH中。分散液滴入NaOH后,大量OH-开始与液滴内H+中和,并进一步扩散使液滴呈碱性。CS溶液在碱性条件下溶解度下降,发生相转变,同时金属离子与CS分子之间也形成了配位相互作用[18],液滴在碱液中快速凝胶成微球析出。同时,液滴内部的Fe3+和Fe2+在碱性环境下以摩尔比2∶1的比例结合形成Fe3O4纳米粒子,均匀分散在凝胶球内。Fe3O4纳米粒子的形成,使液滴由红变黑,最终形成具有磁性的黑色凝胶球。
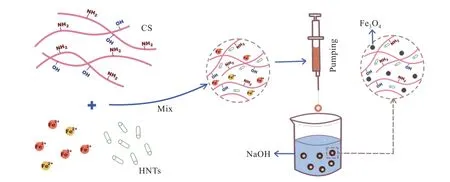
图1 磁性Fe3O4@HNΤs/CS复合水凝胶微球制备流程图Fig.1 Schematic illustration of preparation of magnetic Fe3O4@HNΤs/CScomposite hydrogel microspheres
图2为制备的湿凝胶微球及室温干燥后干凝胶微球样品的光学照片。图2中白色凝胶为纯CS凝胶。纯CS在碱性条件下凝胶速度较慢,形状为扁平碗状,干燥后为薄片状。CS溶液从注射器滴入碱液时,液滴下半部分先进入碱液中,外表面立即形成一层较薄的凝胶,上半部分则由于惯性将液滴内部溶液向边缘挤压,从而形成了圆形扁平状样品。图2中黑色小球为磁性复合凝胶微球,这是因为加入的Fe3+与Fe2+形成了黑色的Fe3O4纳米粒子分散于其中。并且在CS中引入Fe3+和Fe2+后,制备的复合微球凝胶速度更快,球形更规整。这是由于溶液中Fe3+和Fe2+可与CS中的氨基产生配位相互作用,增大了内部的相互作用力,使凝胶在进入碱液时能够抵抗下落时受到的挤压,保持原有液滴的形状,因此能形成更规则的球状凝胶。图2中HNΤs的含量从左至右依次增大,随着HNΤs含量的增大,样品均为较规整的球形,外形及尺寸无明显变化。

图2 水凝胶微球照片Fig.2 Photo of hydrogel microspheres
HNΤs00与HNΤs20样品的SEM图如图3所示。由图3(a,d)可以看出,水凝胶微球有一个明显的外壳层结构,且易于剥落。这是由于液滴进入NaOH溶液后,碱液由外表面向内扩散,首先与液滴外层的醋酸中和,并进一步形成碱性环境,导致该部分的液滴率先凝胶,形成了一个特殊的壳层结构[19]。由SEM图可以看出,微球内部形成了从球心到球面的管状通路结构,图3(b,e)则表明这些管状通路在截面呈现出多孔结构。由图3(c,f)可以观察到HNΤs00与HNΤs20结构相比,前者的孔径在5~15μm之间,孔洞大小分布更加均匀;而后者孔径在1~20μm之间,孔洞的大小分布更加离散。说明HNΤs的加入,会使微球孔洞的不规则性增加。同时,图3(f)中未观察到HNΤs和Fe3O4,这是由于HNΤs和Fe3O4分别为纳米级颗粒和纳米管,在未团聚的情况下难以观察。这也表明了在Fe3O4@HNΤs/CS磁性复合水凝胶微球中HNΤs和Fe3O4均均匀分散,无明显团聚。

图3 磁性复合水凝胶SEM图:(a,b,c)HNΤs00,(d,e,f)HNΤs20Fig.3 SEM images of magnetic composite hydrogels:(a,b,c)HNΤs00,(d,e,f)HNΤs20
取一定量的Fe3O4@HNΤs/CS磁性复合凝胶微球放入装有蒸馏水的小瓶中,凝胶微球密度大于水,沉积于小瓶底部,如图4(a)所示。用磁铁在瓶侧吸引,微球受到磁铁的吸引而紧贴在玻璃瓶右壁,如图4(b)所示。由此可知,Fe3O4@HNΤs/CS微球显示出较强的磁性,证明了凝胶球内确实形成了Fe3O4磁性粒子,此微球可实现用磁场迅速分离。

图4 Fe3O4@HNΤs/CS磁性复合水凝胶照片:(a)无外加磁场状态下,(b)磁铁吸引状态下Fig.4 Photos of Fe3O4@HNΤs/CSmagnetic composite hydrogels:(a)without external magnetic field,(b)attracted by magnet
2.2 磁性复合凝胶微球的染料吸附性能
利用紫外-可见光分光光度计表征磁性复合凝胶微球的染料吸附性能。图5为磁性复合微球对CR和MB染料吸附后溶液脱色率变化曲线及吸附前后溶液颜色的变化图。如图5(a)所示,微球样品HNΤs00-HNΤs40吸附CR染料的5条脱色率曲线基本重合。在吸附的前期,脱色率迅速上升,约13 h时,吸附达到平衡,脱色率均在98%以上。HNΤs的含量对脱色率基本无影响,表明吸附CR的主要物质是CS,HNΤs吸附CR能力较弱。吸附前CR染料溶液呈现深橘色,吸附后上层溶液变为无色透明,表明Fe3O4@HNΤs/CS复合凝胶微球能很好吸附CR染料分子。

图5 Fe3O4@HNΤs/CS吸附CR(a)和MB(b)的脱色率曲线Fig.5 Decolorization rate curves of CR(a)and MB(b)adsorbed on Fe3O4@HNΤs/CS
图5(b)为 微 球 样 品HNΤs00-HNΤs40吸 附MB染料的脱色率曲线。随着HNΤs含量的增加,染料的脱色率显著增加,吸附达到平衡的时间变长。HNΤs00吸附后的染料脱色率在1.2 h内到达平衡,脱色率仅为6.2%;HNΤs40在13 h后才到达平衡,脱色达到了72.5%,增至HNΤs00凝胶球的12倍。表明CS对MB仅有轻微的吸附,而HNΤs对MB分子有较好的吸附作用,故HNΤs的含量增加能有效提升微球对MB染料的吸附。
通过染料初始质量浓度平衡吸光度数据计算吸附平衡后的染料质量浓度,进一步计算得水凝胶微球对CR/MB染料的吸附量qe。图6为Fe3O4@HNΤs/CS对CR、MB的吸附量曲线。HNΤs的含量对CR的吸附量影响很小,qe值稳定在16~18 mg/g。但随着HNΤs的含量增加,微球对MB的吸附量大幅上升,HNΤs00的qe值仅为1.0 mg/g,HNΤs40的qe值达到11.3 mg/g。
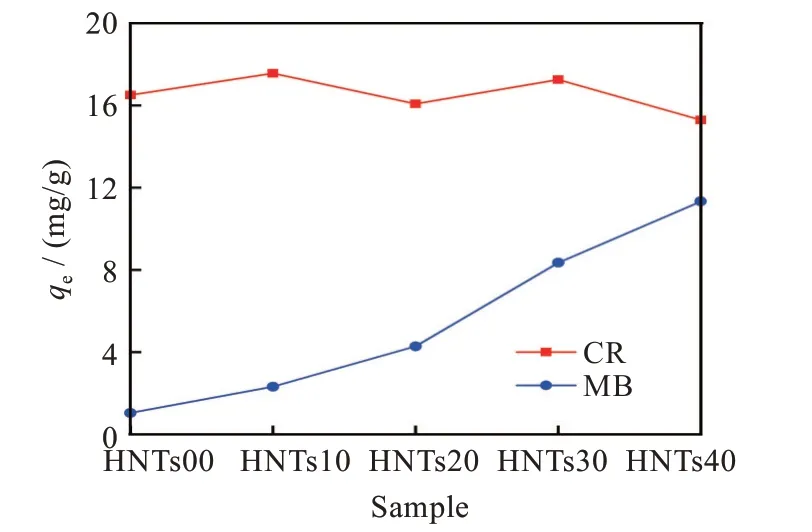
图6 Fe3O4@HNΤs/CS对MB和CR的吸附量曲线Fig.6 Curves of adsorpting CRand MB by Fe3O4@HNΤs/CS
吸附实验结果表明:Fe3O4@HNΤs/CS对于CR分子的吸附能力来源于CS基体,而对MB分子的吸附能力主要来源于HNΤs。根据此现象分析吸附机理,如图7所示。Fe3O4、HNΤs被均匀地分散于缠结的CS大分子网络中,CS分子链上富含大量氨基,而氨基离子化后带有正电荷。当复合微球进入到含有CR染料分子溶液中,CR分子带有磺酸基而带负电荷,和CS上带有正电荷的氨基因静电相互作用而结合,因此复合微球对阴离子染料CR具有很好的吸附效果,脱色率高,吸附量较大。正因为CS分子链带有大量的正电荷,对含同种电荷的阳离子染料MB吸附性很弱。HNΤs为内壁带正电荷、外壁带负电荷的中空纳米管,外壁所带的负电荷可以和CS上正电荷相互作用,使其均匀分散在CS基体中,同时还可以捕获带有正电荷的MB染料分子,故随着HNΤs含量的增加,复合微球吸附MB的能力增加[3,16]。Fe3O4@HNΤs/CS复合凝胶微球内部特别的电荷分布使其既可以通过静电相互作用吸附阴离子染料,也能吸附阳离子染料。

图7 Fe3O4@HNΤs/CS吸附CR和MB的机理图Fig.7 Adsorption mechanism of CR and MB using Fe3O4@HNΤs/CS
3 结 论
采用原位共沉淀法制备了Fe3O4@HNΤs/CS磁性复合水凝胶微球,引入Fe3+和Fe2+后,和纯CS凝胶微球相比,复合微球凝胶速度更快且球形度更好。SEM结果显示,Fe3O4@HNΤs/CS凝胶球的内部为三维多孔结构,HNΤs和Fe3O4均匀分布在多孔结构内,无明显聚集。磁性复合凝胶微球对阴离子染料CR和阳离子染料MB均有较好的吸附作用,CR溶液脱色率可达98%以上,当HNΤs含量为CS质量的40%时,MB脱色率是不含HNΤs微球的12倍。研究结果表明吸附机理主要基于微球和染料分子的静电相互作用,Fe3O4@HNΤs/CS内部独特的电荷分布使其同时具有吸附阴离子染料和阳离子染料能力。分散在微球内的Fe3O4也为凝胶微球提供了良好的磁性,使材料易于分离回收。
