Kex2 蛋白酶K291 突变体性质和动力学研究
2021-12-30王之可李素霞
杨 帆, 刘 晓, 王之可, 李素霞
(1. 华东理工大学生物反应器工程国家重点实验室,上海 200237;2. 上海雅心生物技术有限公司,上海 200231)
Kex2 蛋白酶是一种钙离子依赖型的丝氨酸蛋白酶,可以特异性识别两个连续的碱性氨基酸并在第二个碱性氨基酸的羧基端肽键进行切割[1-3]。Kex2 蛋白酶包含814 个氨基酸残基,分为7 个结构域:信号肽(1~19 氨基酸残基)、前肽(20~113 氨基酸残基)、催化结构域(114~410 氨基酸残基)、P 结构域(411~624 氨基酸残基)、丝氨酸/苏氨酸富集区(625~679 氨基酸残基)、跨膜区(680~699 氨基酸残基)以及胞浆区(700~814氨基酸残基)[4-5]。研究发现信号肽、跨膜区和胞浆区这3 个结构域与Kex2 蛋白酶的活性无关,去除这些结构域不会影响蛋白酶的活性,因此在表达时通常只表达前肽至丝氨酸/苏氨酸富集区这4 个结构域的氨基酸片段[6-9]。
Kex2 蛋白酶在生物医药行业有广泛应用前景,相比胰蛋白酶,Kex2 酶切位点更特异。为了能够得到高产量的Kex2 蛋白酶,研究人员尝试了多种不同类型的表达系统,结果表明毕赤酵母表达系统表达Kex2 蛋白酶效率最高[10-13]。本实验室成功利用毕赤酵母表达系统表达了含有Kex2 前肽、催化结构域、P 结构域和丝氨酸/苏氨酸富集区结构域的20~667 位氨基酸残基序列,利用毕赤酵母α-信号肽取代原Kex2 信号肽(1~19 氨基酸残基),可以得到直接分泌到胞外的目的蛋白[14]。然而在纯化过程中发现,Kex2 蛋白酶会出现自降解的现象,产生多条杂条带,酶活性降低。在分析其氨基酸序列后发现,Kex2 蛋白酶自身结构中含有多对连续碱性氨基酸残基位点,这可能是导致其自降解的原因。
结合降解条带的分子量和蛋白结构分析[15],筛选到了一个最有可能的潜在降解位点K290-K291。该位点位于α-螺旋处,且暴露于整个蛋白分子的表面,非常容易被识别并被切割。此外,该位点在空间结构上距离催化三联体Ser385-His213-Asp175 较远,突变后不会影响蛋白酶催化活性。根据氨基酸的带电荷情况和侧链R 基团,选择组氨酸(His)和亮氨酸(Leu)作为突变后氨基酸。经过分析后发现,His 与原位点赖氨酸(Lys)均带正电荷,Leu 的侧链R 基团与Lys 的侧链R 基团相比,除了减少一个氨基外,碳原子个数相同,因此决定选择这两种氨基酸。
本文将K291 位点的Lys 突变为His 和Leu,对突变体的降解情况和稳定性、动力学进行了研究,并将天然Kex2 与突变体进行了比较。
1 材料与方法
1.1 质粒与菌株
含Kex2基因序列的质粒pPIC9K 和宿主细胞毕赤酵母菌株GS115 均由本实验室保存,
1.2 主要试剂和培养基
实验所用内切酶、连接酶和蛋白分子量标准购自Takara 生物有限公司,测活底物叔丁氧羰-谷氨酰胺-精氨酸-精氨酸-对硝基苯胺(Boc-Gln-Arg-ArgpNA)购自Sigma 公司。其他试剂均为国产分析纯。MD(Minimal Dextrose)培养基(1.34 g/mL YNB (Yeast Nitrogen Base without Amino Acids),2 g/mL 葡萄糖,4×10−5g/mL 生物素),YPD(Yeast Extract Peptone Dextrose)培养基(1 g/mL 酵母提取物,2 g/mL 蛋白胨, 2 g/mL 葡萄糖) , BMGY( Buffered Glycerol-Complex)培养基(1 g/mL 酵母提取物,2 g/mL 蛋白胨,1.34 g/mL YNB,100 mmol/L 磷酸钾缓冲液,4×10−5g/mL 生物素,体积分数为1%甘油,pH 5.0),BMMY(Buffered Methanol-Complex)培养基(1 g/mL酵母提取物,2 g/mL 蛋白胨,1.34 g/mL YNB,100 mmol/L磷酸钾缓冲液,4×10−5g/mL 生物素,体积分数为1%甲醇,pH 5.0)。
1.3 实验方法
1.3.1 点突变构建 使用重叠延伸生物学的聚合酶链反应(PCR)法构建点突变。突变位点K291 在蛋白空间结构中的位置如图1所示。在Kex2 蛋白酶原始序列中找到对应的核酸序列,根据毕赤酵母的偏好性设计突变引物,引物序列如表1 所示。进行两次PCR 反应得到突变后的核酸序列,经过连接、转化和筛选后,挑选阳性重组子送至生工生物(Sangon Biotech)有限公司进行测序。
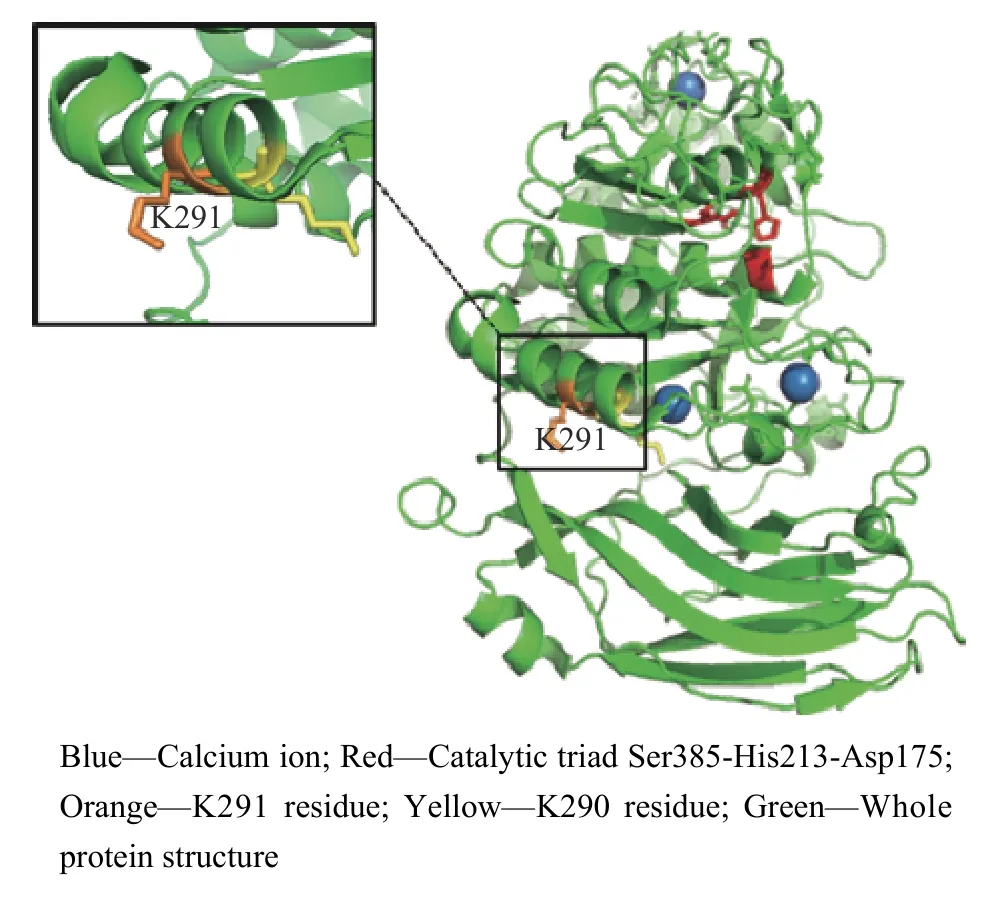
图1 Kex2 蛋白酶的三维结构Fig. 1 Three-dimensional structure of Kex2 protease
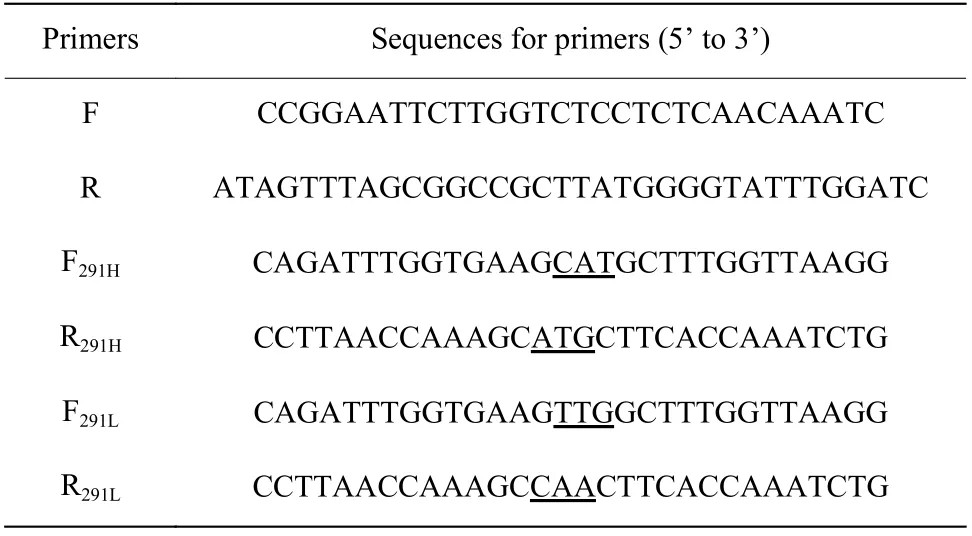
表1 突变引物Table 1 Primers of mutants
1.3.2 重组毕赤酵母菌株的筛选 重组子测序确认正确后进行质粒少量抽提。选取SalⅠ限制性内切酶将质粒线性化,然后使用电击转化法将线性化的质粒转化至毕赤酵母GS115 中,菌液先涂布于MD 平板进行第一次筛选,然后收集菌落,重新涂布于含有质量浓度分别为1、2、3 mg/mL 的遗传霉素G418 的YPD 平板进行第二次筛选。
1.3.3 诱导表达和纯化 挑取含高浓度G418 的YPD 平板上的单菌落至YPD 液体培养基中,待菌液浓度OD600达到2.0 时,再接种至BMGY 培养基中,待菌液浓度OD600为20.0 时,菌液离心,将菌体重悬于BMMY 培养基中,每24 h 添加终浓度为1%(体积分数)的甲醇,诱导72 h。
诱导结束后离心菌液,将上清液进行透析(透析液为20 mmol/L 乙酸钠-乙酸缓冲液,pH 5.2),去除上清液中高浓度的磷酸盐和色素小分子。使用Q-FF阴离子交换柱进行纯化,并用pH5.2、20 mmol/L NaCl、20 mmol/L 乙酸钠-乙酸缓冲液和pH5.2、200 mmol/L NaCl、20 mmol/L 乙酸钠-乙酸缓冲液等体积线性洗脱,分步收集洗脱液,用SDS-PAGE(Polyacrylamide gel electrophoresis)鉴定蛋白纯度,超滤除盐后测定蛋白酶活性。
1.3.4 活性测定方法 底物为叔丁氧羰-谷氨酰胺-精氨酸-精氨酸-对硝基苯胺(Boc-Gln-Arg-Arg-pNA)。该底物在405 nm 处无吸光值,当Kex2 蛋白酶在RR 位点切割后,产生了两个片段Boc-Gln-Arg-Arg 和pNA,pNA 在405 nm 处有吸光值,且吸光值大小与浓度成正比。
酶活力定义为:在25 ℃、pH8.0 的条件下,每分钟催化1 μmol 的底物转化为产物所需要的酶量。将底物溶于50 mmol/L Tris-HCl、 pH8.0、 2 mmol/L CaCl2的测活缓冲液中,置于25 ℃水浴中孵育30 min以上,取3 mL 底物于玻璃比色皿中,加入适量酶,在波长405 nm 下,每间隔30 s 记录吸光值A405,连续记录5 min,然后根据式(1)计算酶活:
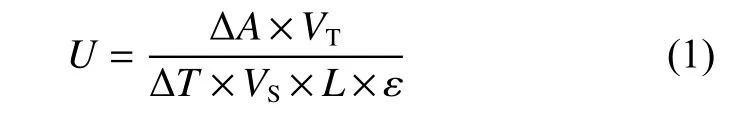
其中,ΔA为测量时间段内吸光值A405的差值;VT为测活体系总体积;ΔT为测量时长;VS为测活体系中加入酶的体积;L为比色皿光程(L=1cm);ε 为反应体系中pNA 的摩尔消光系数,ε=1.02 ×104L/(mol·cm)。
1.3.5 最适温度与温度稳定性 按照标准配制底物,将底物溶解于50 mmol/L Tris-HCl、pH8.0, 2 mmol/L CaCl2的缓冲液中,置于不同温度(4、25、37、60 ℃)水浴中孵育2 h 后加入适量蛋白酶测定活性。将测得的活性最高的一组作为100%,计算其他温度下蛋白酶的相对活性,以温度为横坐标,蛋白酶的相对活性为纵坐标作图。
将纯化后的Kex2 蛋白酶在不同温度(4、25、37 ℃)水浴下孵育,每2 h 测定不同温度处理后的蛋白酶的活性,结果为3 组平行实验的平均值。以未经处理蛋白酶的活性为100%,以温度为横坐标,不同温度和时间处理后的蛋白酶的残留活性为纵坐标作图。
1.3.6 最适pH 与pH 稳定性 将测活底物分别溶解在不同pH 值的缓冲液中,在25 ℃水浴中放置2 h后,加入适量蛋白酶测定活性。将测得的活性最高的一组作为100%,计算其他pH 值下蛋白酶的相对活性。以pH 值为横坐标,相对活性为纵坐标作图。不同pH 值的缓冲溶液包括50 mmol/L NaAc-HAc(pH 3.0 ~ 6.0),50 mmol/L Tris-HCl (pH 7.0 ~ 8.0)和50 mmol/L Gly-NaOH (pH 9.0 ~ 10.0)。
将纯化后的蛋白样品进行超滤浓缩,然后稀释至不同pH 值的缓冲液中,在4 ℃水浴中处理12 h后测定蛋白酶活性,结果为3 组平行实验的平均值。以测得的活性最高的一组作为100%,计算经不同pH 缓冲液处理后的蛋白酶的相对活性。以pH 值为横坐标,蛋白酶的相对活性为纵坐标作图。
1.3.7 动力学参数 利用Lineweaver-Burk 双倒数作图法得到各蛋白酶的米氏常数(Km)和最大反应速率(Vmax):配制浓度(c)分别为10、20、30、50、100、200、300 μmol/L 的底物,在不同底物浓度下测定蛋白酶的反应速率v(μmol/min),然后以1/v−1/c作图,拟合出一条直线,其横轴截距为−1/Km,纵轴截距为1/vmax。
2 结果与讨论
2.1 Kex2 蛋白酶突变体表达与纯化
在培养基中每24 h 添加体积分数为1%甲醇溶液进行诱导,取样离心后取上清液进行电泳鉴定,结果如图2(a)所示,Kex2 蛋白酶的天然形式和突变体均成功表达,在甲醇的诱导下分泌到培养液中,表观分子量为75 kDa。经过Q-FF 纯化后,SDS-PAGE 电泳检测如图2(b)所示,天然Kex2 蛋白酶在纯化过程中发生了降解,出现了非单一条带,在66 kDa 处出现了一条杂条带,而突变体在纯化过程中未发现明显的降解,仍为单一条带。测定蛋白浓度和活性后计算得到蛋白酶比活分别为:天然Kex2 蛋白酶 55.6 U/g,突变体Kex2-K291H 107.7 U/g,突变体Kex2-K291L 143.8 U/g。

图2 天然Kex2 蛋白酶和突变体的诱导表达(a)和Q-FF 纯化结果(b)Fig. 2 Expression (a) and purification by Q-FF (b) of the wild Kex2 protease and mutants
2.2 蛋白酶的最适温度和温度稳定性
本文在不同温度下测定蛋白酶的活性,结果如图3(a)所示。随着反应体系的温度升高,蛋白酶的反应速率也逐渐升高。但是考虑到该测活过程中反应时间仅为5 min,反应时间较短,而在实际应用过程中蛋白酶的加工时间要长于5 min,通常为1 h 甚至更长,因此本文又将蛋白酶与底物在相同的温度下分别放置30 min 后,再将蛋白酶与底物混合进行活性测定,实验结果如图3(b)所示。两种突变体Kex2-K291H 和Kex2-K291L 分别与天然Kex2 蛋白酶进行显著性差异分析,两次计算得到的P值均大于0.05,即突变体Kex2-K291H 和Kex2-K291L 与天然Kex2 蛋白酶的最适温度差异不显著。天然Kex2 蛋白酶和两种Kex2 突变体的最适温度保持一致,都能在37 ℃条件下于一段时间内保持较高的活性。当反应体系温度超过40 ℃后,蛋白酶无法长久保持稳定,虽然在较短时间内呈现较高活性,但随着反应时间延长,蛋白酶活性呈下降趋势。根据这两种测定方法的实验结果可以发现,若在短时间内进行测活,可以使用温度较高的反应体系;若要进行长时间反应,最好在低于37 ℃条件下进行反应。
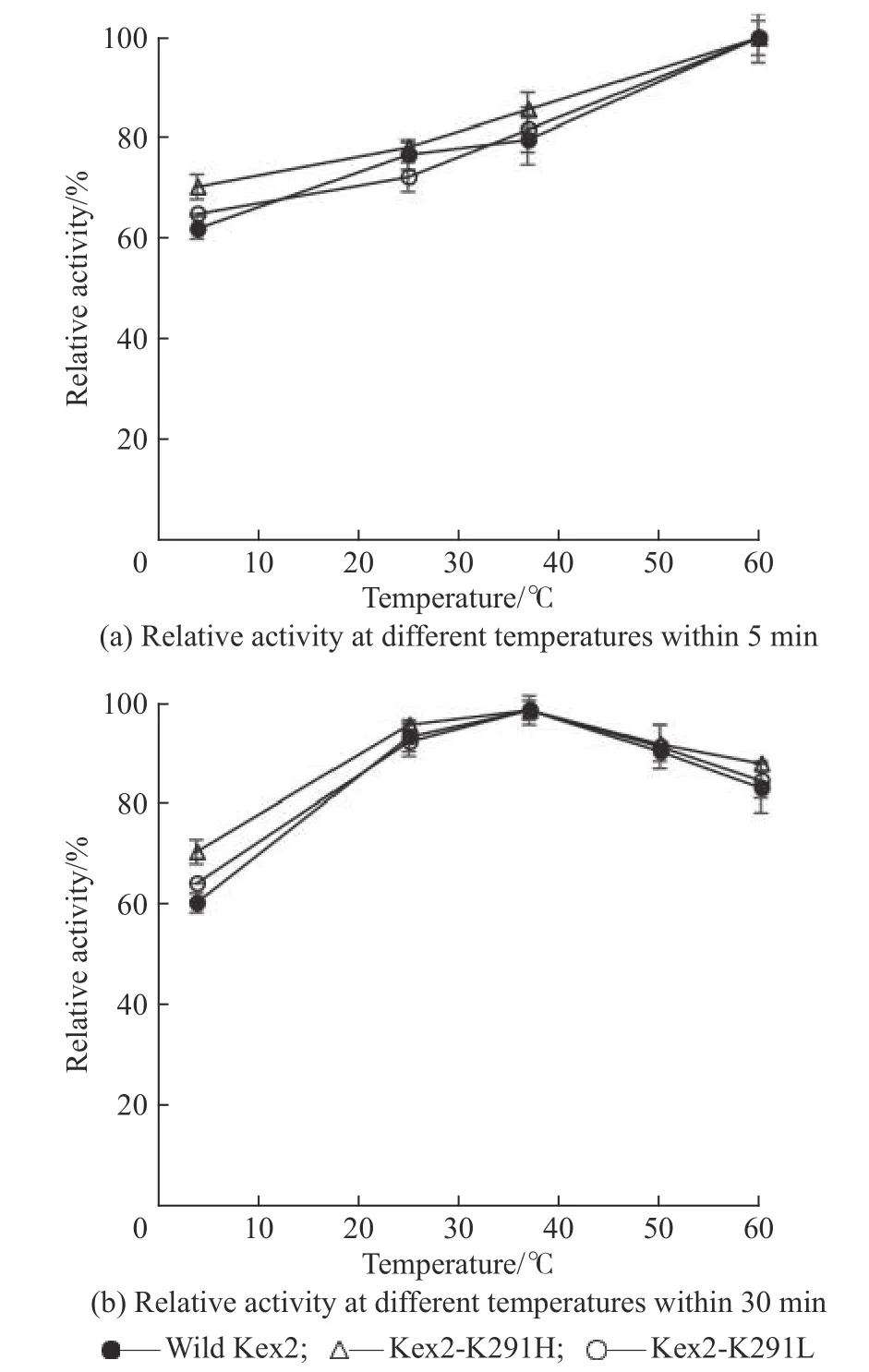
图3 天然Kex2 蛋白酶和突变体的最适温度Fig. 3 Optimal temperature of wild Kex2 protease and mutants
蛋白酶测活均在25 ℃反应体系中进行,蛋白酶的温度稳定性比较结果如图4 所示。两种突变体Kex2-K291H 和Kex2-K291L 分别与天然Kex2 蛋白酶温度稳定性结果进行显著性差异分析,两次计算得到的P值均大于0.05,即突变体Kex2-K291H 和Kex2-K291L 与天然Kex2 蛋白酶的温度稳定性差异不显著。在4 ℃和25 ℃条件下,两种突变体的稳定性与天然Kex2蛋白酶的稳定性都较好,24 h 后仍能保留90%以上的活性。在37 ℃条件下,两种突变体和天然Kex2 蛋白酶的稳定性趋势基本相同,在12 h内均能保留90%以上的活性,但当时间延长至24 h后,蛋白酶稳定性呈下降趋势。

图4 天然Kex2 蛋白酶与突变体的温度稳定性比较Fig. 4 Comparison of temperature stability between wild Kex2 protease and mutants
2.3 最适pH 值和pH 稳定性
将测活底物分别溶解在不同pH 值的测活缓冲液中,在25 ℃下加入蛋白酶进行测活,最适pH 值实验结果如图5 所示,天然Kex2 蛋白酶与Kex2 蛋白酶突变体的最适pH 值相同,均为9.0。当反应体系的pH 值低于5.0 时,蛋白酶的活性完全丧失;当反应体系的pH 值在5.0~8.0 范围内,蛋白酶的活性逐渐升高,在pH 值为9.0 时达到最高;当反应体系的pH 值高于10.0 时,蛋白酶活性又开始迅速降低。两种突变体Kex2-K291H 和Kex2-K291L 分别与天然Kex2 蛋白酶的最适合pH值进行显著性差异分析,两次计算得到的P值均大于0.05,即突变体Kex2-K291H 和Kex2-K291L 与天然Kex2 蛋白酶的最适pH 差异不显著。

图5 天然Kex2 蛋白酶与突变体的最适pH 值Fig. 5 Optimal pH value of wild-type Kex2 protease and mutants
天然Kex2 蛋白酶和Kex2 蛋白酶突变体在不同pH 条件下放置12 h 后,残留的活性如图6 所示。由图可知,三者的活性变化趋势是一致的,在pH5.0~6.0 范围内,蛋白酶的活性相对稳定,但Kex2-K291H 和Kex2-K291L 稳定的pH 范围要明显大于天然Kex2。当pH>7.0 时,天然Kex2 蛋白酶的活性开始逐渐下降,而当pH>8.0 时,Kex2-K291H 和Kex2-K291L 的活性才开始下降。
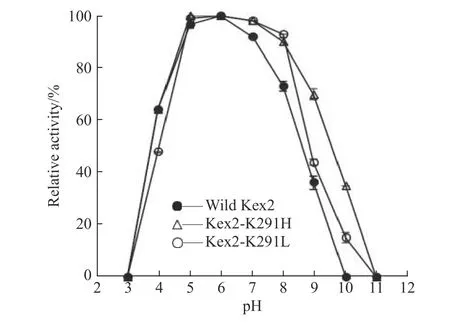
图6 天然Kex2 蛋白酶与突变体pH 稳定性Fig. 6 pH stability of wild-type Kex2 protease and mutants
对两种突变体Kex2-K291H 和Kex2-K291L 与天然Kex2 蛋白酶的pH 稳定性进行显著性差异分析,结果表明,突变体Kex2-K291L 与天然Kex2 蛋白酶显著性差异P>0.05,即两者的pH 稳定性差异不显著;但突变体Kex2-K291H 与天然Kex2 蛋白酶显著性差异P=0.0379<0.05,即两者的pH 稳定性差异显著。
2.4 动力学参数
天然Kex2 蛋白酶和Kex2 蛋白酶突变体的Lineweaver-Burk 曲线如图7 所示,根据拟合后的直线计算得到各蛋白酶的动力学参数(表2)。天然Kex2 蛋白酶的Km值为0.037 mmol/L,突变体Kex2-K291H 的Km值为0.018 mmol/L,突变体Kex2-K291L的Km值为0.019 mmol/L,与天然Kex2 蛋白酶相比,两种突变体的Km值均减小。突变体Kex2-K291H的催化效率指数(Kcat/Km)为天然Kex2 的1.85 倍,突变体Kex2-K291L 的Kcat/Km值为天然Kex2 的2.05 倍。
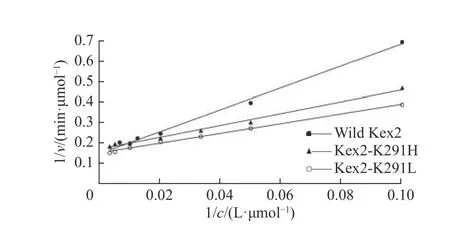
图7 Lineweaver-Burk 双倒数图分析动力学参数Fig. 7 Lineweaver-Burk plots analysis of the kinetic parameters
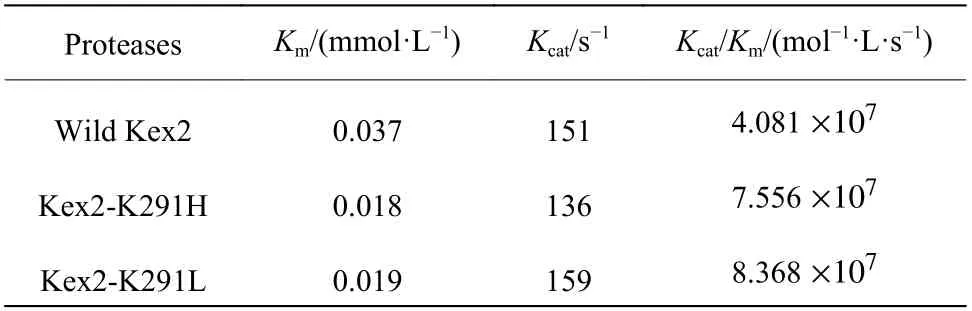
表2 Kex2 蛋白酶的动力学参数Table 2 Kinetic parameters of Kex2 proteases
3 结 论
(1)利用毕赤酵母表达系统成功表达了Kex2 蛋白酶K291 位点的两种突变体Kex2-K291H 和Kex2-K291L。
(2)对比天然Kex2 蛋白酶和Kex2 突变体的降解情况,Kex2-K291H 和Kex2-K291L 的降解条带基本消失,为单一条带。
(3)与天然Kex2 蛋白酶相比,突变体Kex2-K291H 的稳定pH 范围扩大,在pH5.0~7.0 范围内均能保持较高的稳定性。而两种突变体的最适温度、温度稳定性、最适pH 值仍与天然Kex2 蛋白酶保持一致。
(4)突变体Kex2-K291H 和Kex2-K291L 的催化效率提高,两者的Kcat/Km值分别为天然Kex2 蛋白酶的1.85 倍和2.05 倍。
