三种新冠病毒疫苗的比较
2021-12-29邵江樵
邵江樵
摘要 推行新冠病毒疫苗的接种是建立群体免疫,控制疫情最有效的办法。文中阐述了我国目前广为使用的1针、2针、3针疫苗制备的技术线路和疫苗的成分特点和接种。
关键词 新冠疫苗 新型冠状病毒灭活疫苗 腺病毒载体重组疫苗 重组新冠病毒疫苗
中图分类号 Q-49
文献标志码 E
由新冠病毒引起的新冠肺炎对公共健康造成了极大的威胁,对经济发展造成了严重影响。新冠病毒没有细胞结构,是一种带包膜的RNA病毒,其包膜主要来源于宿主细胞膜。膜表面主要由刺突蛋白(S)、包膜蛋白(E)和膜蛋白(M)3种结构蛋白组成。病毒膜内是由核衣壳蛋白(N)包裹的RNA。新冠病毒通过S蛋白(刺突蛋白)与细胞膜表面受体ACE2结合,以包膜与宿主细胞膜融合方式完成病毒内吞,进入人体宿主细胞,开始增殖,破坏宿主细胞,同时引起人体相应的免疫反应。新冠病毒疫苗的研制和疫苗接种是建立群体免疫、控制疫情最有效的办法。目前,国内普遍使用的新冠疫苗有灭活疫苗、腺病毒载体疫苗、重组蛋白疫苗。研制思路大多以S蛋白(刺突蛋白)为抗原进行设计。
1新型冠状病毒灭活疫苗(Vero细胞)灭活疫苗属于比较传统的疫苗类型,研发历史比较悠久,技术也相对比较成熟。病原体在受控条件下
生长,培养过程中被杀死而失去致病能力,制成疫苗,利用失去活性的病毒刺激人体产生抗体。
新型冠状病毒灭活疫苗(Vero细胞)的生产需要经过:细胞培养→病毒培养→灭活→纯化→配比(半成品)→灌装→包装七大步骤,每一步还有更多更细致的环节,质控检测则贯穿全程。
灭活疫苗生产的核心之一是生产疫苗原液,通过细胞培养、病毒培养、灭活、检测、纯化等流程,得到纯度极高的疫苗原液。
细胞培养:Vero细胞是非洲绿猴的肾脏上皮细胞,是连续的非整倍体细胞,能无限增殖。用含质量分数为10%新生牛血清的199培养基培养,在pH控制在7.2~7.4,温度34~37±0.2°C,微载体培养4d,让细胞进入平台期。
病毒培养:在Vero细胞平台期接种新冠病毒(弱病毒株或高效价病毒株)。接种病毒后,更换为含质量分数为5%的新生牛血清的199病毒维持液,进行灌流培养。
灭活是用物理或化学手段使病原体失去感染、致病和繁殖的能力,但保留抗原性的过程。常见的灭活方法:把培养所得的病毒液,按一定比例加入甲醛或β-丙内酯等试剂进行灭活。甲醛为活泼的烷化剂,对病毒核酸和病毒蛋白质都有破坏作用,甲醛使病毒核酸灭活——与腺嘌呤、鸟嘌呤和胞嘧啶等含有胺基的碱基结合而使病毒核酸变性。甲醛使蛋白质变性,与病毒蛋白质中的氨基酸发生交联反应,破坏空间结构,使蛋白质变性。甲醛对单链核酸最为有效,故常用于RNA病毒的灭活。灭活剂β-丙内酯直接与病毒核酸分子中的鸟嘌呤或腺嘌呤作用,引起单链断裂或双螺旋链交联而达到灭活病毒的作用。
疫苗生产的核心之二是配比。配比是疫苗生产中的重要一环,配比是疫苗原液中加入佐剂、稀释液等,将其制成半成品的过程。灭活疫苗诱导的免疫效果相对较差,佐剂能增强机体对抗原的免疫应答或改变免疫应答类型,减少抗原用量,进而降低疫苗成本。
新型冠状病毒灭活疫苗(Vero细胞)的主要成分是杀死的新冠病毒,接种后不在宿主细胞内复制,无传染性,保留的免疫原性可以刺激人体的体液免疫。目前,新冠病毒灭活疫苗(Vero细胞)需要接种两剂;首剂与第2剂次的接种间隔要在3周及以上,第2剂在首剂接种后8周内尽早完成。也就是接种完第1剂次后的21~56天内完成第2剂接种。同种疫苗两次接种的目的利用第一次接种产生的记忆细胞对相同抗原的特异性识别,迅速增殖分化,使人体产生更多的效应B细胞(浆细胞),从而产生更多的抗体,形成较好的免疫效果。
2腺病毒载体重组疫苗(5型腺病毒载体)
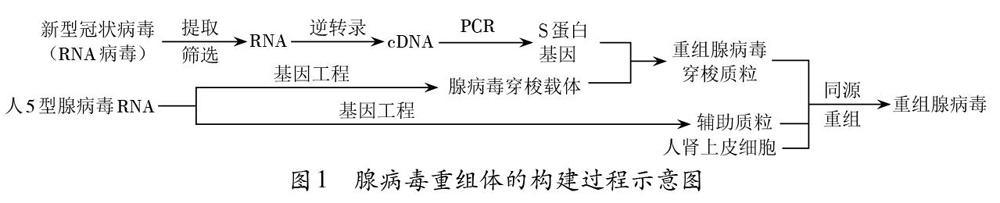
腺病毒(Ad)是一种无包膜的双链线性的DNA病毒。腺病毒基因组包含与腺病毒复制相关的E1~E4基因,E1基因为病毒复制必需区,缺失则成为复制缺陷型载体。E3基因是病毒复制非必需区,可用于外源基因的插入。Ad5是一种普通感冒病毒,以人5型腺病毒(Ad5)为载体的重组新冠疫苗是能表达外源S蛋白但复制缺陷的Ad5载体疫苗。具体来说,通过基因工程,构建了一个插入S蛋白基因且E1基因缺失的腺病毒重组体(图1)。重组体外壳仍然是腺病毒的正常外壳蛋白,使重组腺病毒具有同样的感染力进入靶细胞;由于基因组的E1区域被外源目的基因取代,进入靶细胞后病毒不能复制,但含有编码新冠病毒S蛋白的基因可以表达目的蛋白——S蛋白,并从细胞内转移到细胞外,激发一系列的免疫反应。
由于新冠病毒为RNA病毒,其遗传物质不能直接拼接到质粒上,因此在制备以上疫苗时需先通过逆转录过程获得相应的目的基因——S蛋白基因。腺病毒病毒载体重组疫苗的巧妙之处在于改造后的腺病毒进入细胞后不会复制,但可使宿主细胞表达S蛋白(抗原)。腺病毒载体新冠疫苗可以同时刺激人体的体液免疫和细胞免疫。体液免疫产生的抗体可以直接与病毒结合,使其失去寄生能力;细胞免疫则可以杀伤被病原体感染的细胞(如被接种疫苗感染的细胞)。
目前,腺病毒载体疫苗免疫程序是接种1剂次。其優点体现在能持续表达抗原,免疫应答更持久。缺点:若在接种该种疫苗前机体曾感染过腺病毒,人体内会具有5型腺病毒的抗体,接种疫苗时会被体内相应抗体部分清除而降低免疫效果或导致不能携带S蛋白基因进入细胞内表达,使该种疫苗的有效性降低。
3重组新冠病毒疫苗(CHO细胞)
重组新冠病毒疫苗(CHO细胞)又叫重组亚单位疫苗,制备的技术线路:提取新冠病毒RNA→逆转录生产cDNA→扩增筛选RBD蛋白基因→构建基因表达载体→导入CHO细胞→纯化RBD蛋白→加入佐剂、稀释液等制成疫苗。
S蛋白通过与受体血管紧张素转换酶2(ACE2)结合,介导病毒进入宿主细胞。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。在感染过程中,S蛋白被宿主蛋白酶切割成N端的S1亚基和C端的S2亚基。RBD蛋白是真正与ACE2结合的蛋白。
CHO细胞是中国仓鼠卵巢细胞,是生物制药最常用的细胞表达系统。重组新冠病毒疫苗(CHO细胞)生产工艺先进成熟,采用转基因技术,通过成熟的CHO细胞重组表达RBD蛋白特异性抗原,能实现高产量、高纯度、低成本;并且疫苗只含RBD蛋白,纯度高,无病毒核酸成分,安全性好。接种重组新冠病毒疫苗(CHO细胞)——RBD蛋白,诱导人体产生中和抗体,可以阻断新冠病毒与宿主细胞表面的ACE2结合,达到预防感染的目的。
目前,重组新冠病毒疫苗(CHO细胞)需要接种3剂:相邻2剂之间的接种间隔建议≥4周。第2剂尽量在接种第1剂次后8周内完成,第3剂尽量在接种第1剂次后6个月内完成。
以上三种疫苗的技术路线各不相同,但都是利用新冠病毒的S蛋白,使人体产生特异性免疫反应,形成保护效应。
参考文献:
[1]杨安纳,王吟,杨东升,周艳萍,涂晶,卢佳,李茜,施金荣,王泽鋆,申硕.新型冠状病毒灭活疫苗(Vero细胞)中β-丙内酯残留气相色谱检测方法的建立、优化及验证.中国生物制品学杂志[J].2021,(4):448-452.
[2]韩中山.生物反应器培养Vero细胞制备狂犬病毒.中国畜牧兽医文摘[J].2013,(3):50-51.
