一株燕麦根腐病生防菌的鉴定及其防治效果
2021-12-29张建强吴康莉张晓梦李昭煜李佳佳漆永红田永强
张建强,吴康莉,张晓梦,李昭煜,,李佳佳,漆永红,田永强,
(1. 兰州交通大学化学与生物工程学院,甘肃 兰州 730070;2. 兰州交通大学研究院甘肃省植物源生物农药工程技术研究中心,甘肃 兰州 730070;3. 甘肃省农业科学院植物保护研究所,甘肃 兰州 730070)
燕麦(Avena sativa)是禾本科燕麦属的一年生植物,是世界上粮饲兼用的重要农作物之一,多生长在高寒、贫瘠和干旱的极端环境中,抗逆性较强,已经成为寒旱地区不可替代的特色粮饲作物[1],在世界上被广泛种植,种植面积约1 400 万hm2,总产量2 800 万t[2-3]。燕麦富含蛋白质、不饱和脂肪酸、维生素和矿物质等各种营养物质,具有降血脂、调节血糖和预防便秘等多种保健功能。燕麦茎叶饲用营养价值高,适口性好,是农牧区冬春补饲和抗灾保畜的优良饲草。
随着近年来燕麦种植面积不断扩大,水肥条件的改善和气候变暖的影响,导致燕麦病害问题日益严重,在燕麦种植区普遍发生[1,4-5],严重影响燕麦的品质和产量。燕麦的病害按照病原菌的侵染部位可以分为叶部病害、根部及茎基部病害、穗部病害。其中,常见的叶部病害的病原菌主要包括燕麦内脐蠕孢(Drechslera avenae)、 禾布氏白粉菌(Blumeria graminis)、燕麦冠锈菌(Puccinia coronata)和核腔菌(Pyrenophora avenicola)[6];根部病害的病原菌主要包括燕麦镰刀菌(Fusarium avenaceum)、假禾谷镰刀菌(F. pseudograminearum)[7]和立枯丝核菌(Rhizoctoia solani);穗部病害的病原菌主要包括燕麦散黑粉菌(Ustilago avenae)、黑粉菌(U. segetum)、层出镰刀菌(F. proliferatum)[8-9]和雪霉微座孢(Microdochium nivale)[10-11]。
为防治因病虫害造成的损失,大量使用化学农药造成了燕麦相关产品的农药残留,也对牧区草地生态环境造成严重污染,威胁着草原畜牧业生产和人类的健康。因此,利用微生物菌剂开展生物防治是预防植物病虫害和解决化学农药污染的最理想途径。查阅国内外文献发现,对燕麦根部病害的调查研究较多,且防治药剂主要以化学农药为主,关于生物防治的研究鲜有报道[12]。为此,通过从健康燕麦田土壤中分离出一株对燕麦根腐病菌具有防治作用的拮抗细菌,旨在为燕麦根腐病的生防菌开发和绿色防控提供新的依据和思路。
1 材料与方法
1.1 供试病原菌
燕麦镰孢菌(F. avenaceum)、茄腐镰孢菌(F.solani)、番茄匍柄霉(Stemphylium lycopersici)、立枯丝核菌(R. solani)、禾谷镰孢菌(F. graminearum)、细极链格孢(Alternaria tenuissima)、番茄灰霉(Botrytis cinerea)、核盘菌(Sclerotinia sclerotiorum)、尖孢镰孢菌(F. oxysporum)。以上菌株由兰州交通大学微生物实验室分离、保存。
1.2 土样采集
2020 年6 月,在甘肃省合作市卡加曼乡香拉村燕麦地(35°06′22.20″ N, 102°52′6.02″ E),用“S”型采样法选取健康燕麦植株,土壤样品的采集采用抖根法,先铲去植株根际表层0 − 5 cm 的土壤,取5 −20 cm 附着于根毛上的土壤装入无菌自封袋带回实验室,4 ℃保存,用于后续试验。
1.3 培养基制作
马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 L;马铃薯葡萄糖(potato dextrose broth, PDB)培养基:马铃薯200 g,葡萄糖20 g,水1 L。
1.4 拮抗菌的筛选
将土壤样品称取1 g,用100 mL 无菌水配置成悬液,然后将悬液梯度稀释,采用平板涂布法吸取100 μL 浓度1×10−5的悬液均匀涂布于PDA 培养基上,28 ℃培养3 d,挑取形态各异的菌落划线纯培养。试验重复3 次。
采用平板对峙培养法进行筛选,将培养5 d 的燕麦根腐病菌用打孔器(直径6 mm)打成菌饼接种于培养皿中央,再用接种环将培养24 h 的细菌用十字交叉法接种在距菌饼2 cm 处,25 ℃黑暗培养5 d。能产生抑菌带即为拮抗菌,并测定抑菌率[13]。抑菌率 = (对照组菌落直径 − 处理组菌落直径)/对照组菌落直经 × 100% 。试验重复3 次。
1.5 拮抗菌抑菌广谱性测定
为测定拮抗菌潜在应用价值,测定其对8 种常见农作物病原菌的抑菌能力。方法同上。供试病原菌:茄腐镰孢菌、番茄匍柄霉、立枯丝核菌、禾谷镰孢菌、细极链格孢、番茄灰霉孢、核盘菌、尖孢镰孢菌。
1.6 拮抗菌鉴定
采用Ezup 柱式细菌基因组DNA 抽提试剂盒(上海生工生物工程有限公司)提取拮抗菌总DNA 后,通过测序分析其16S rDNA 基因序列进行拮抗菌鉴定。采用细菌通用引物27F (5-AGAGTTTGATCTGG CTCG-3)和1492R (5-GGTTACCTTGTTACGACTT-3)聚合酶链式反应(polymerase chain reaction, PCR)扩增16S rDNA。PCR 的反应体系为25 μL,所用程序为94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸90 s,共进行30 次循环,然后以72 ℃延伸10 min 后,4 ℃保存备用。送至北京华大基因完成测序工作,测序结果在NCBI 数据库Blast 比对分析,并用MEGA 6.0 软件选择最大似然法(maximum likelihood, ML)构建系统发育树。
1.7 拮抗菌抑菌能力测定
1.7.1 菌株YF 发酵液对燕麦镰孢菌菌丝的抑制作用
从活化的燕麦镰孢菌培养皿中取5 个直径为8 mm 的菌饼,接种于100 mL PDB 培养基中,28 ℃、180 r·min−1培养24 h 后加入1 mL 培养24 h 的YF 发酵液(无菌),对照组不接种YF 发酵液。继续培养2 d 后在光学显微镜下观察各组燕麦镰孢菌菌丝的生长情况。
1.7.2 菌株YF 对燕麦镰孢菌孢子萌发的抑制作用
采用琼脂培养法[14],并做一些改进。在洁净无菌的载玻片上滴加含有无菌YF 发酵液的1.5%水琼脂培养基,待水琼脂凝成薄层后,将有琼脂培养基的一面朝上,平放在培养皿中“U”形玻璃棒上,再吸取10 μL 孢子浓度为1.5 × 105个·mL−1的燕麦镰孢菌分生孢子悬浮液均匀涂抹在水琼脂平面上,平板底部加浸水的滤纸片保温培养,置于25 ℃培养箱中培养,每个处理重复3 次。以不加发酵液的水琼脂为空白对照。24 h 后在光学显微镜下观察,每次镜检50 个孢子,并统计萌发率 。萌发抑制率 =(对照组萌发率 − 处理组萌发率) / 对照组萌发率 ×100%[15]。
1.7.3 菌株YF 防效测定
将培养8 d 的燕麦镰孢菌加5 mL 无菌水,轻轻刮下孢子,置于无菌三角瓶中稀释成孢子浓度为1.5 × 103个·mL−1的孢子悬浮液,每盆取100 mL 孢子悬浮液与灭菌土(约1 kg)拌匀后装盆,选取颗粒饱满的燕麦种子,用75%的乙醇消毒后分装于花盆中,每盆10 粒,覆土1 cm 左右后置于光照培养箱中培养。试验设置3 个处理,分别为处理组[待燕麦出苗后,将YF 制成菌悬液(1 × 108cfu·mL−1) 20 mL进行灌根处理]、对照组[待燕麦出苗后,以50%多菌灵粉剂为常规对照(稀释倍数为800 倍),取稀释后的多菌灵溶液20 mL 进行灌根处理]和空白对照组(以20 mL 无菌水进行灌根处理)。每个处理重复3 次。灌根15 d 后调查各处理病害发生情况,用自来水将根茎部土壤冲洗干净后,观察记载发病程度,然后统计发病率并计算病情指数和防治效果。根腐病病情调查分级标准[16]:0 级,根部无病斑;1 级,根部出现淡褐色斑点,根系发病面积占1%~15%;3 级,部分根部变褐色至黑褐色,根系发病面积占16%~30%;5 级,多数根部变黑褐色,根系发病面积占31%~60%;7 级,根部变黑甚至腐烂,根系发病面积占60%以上。计算公式[17]:

1.8 数据统计
利用Excel 2016 和SPSS 22.0 进行统计分析,以平均值 ± 标准差表示,采用单因素方差分析菌落直径,采用Duncan 法进行多重比较,显著水平为0.05。
2 结果与分析
2.1 拮抗菌的分离和筛选
以燕麦镰孢菌为靶点,利用平板对峙培养法筛选拮抗细菌。通过筛选获得一株抑制效果较好的菌株YF,抑菌效果明显(图1),经测定处理菌落直径为(1.7 ± 0.3) cm,对照菌落直径为(5.8 ± 0.4) cm,抑制率为70.69%。因此,确定以菌株YF 为燕麦镰孢菌拮抗菌株开展后续研究。

图1 菌株YF 对燕麦镰孢菌的抑制效果Figure 1 Inhibitory effect of strain YF on Fusarium avenaceum
2.2 拮抗菌的抑菌广谱性测定
采用平板对峙培养法测定了拮抗菌YF 对8 种常见植物病原菌的抑菌作用。结果表明YF 对供试病原菌均表现出较好的抑菌作用(表1)。其中YF 对茄腐镰孢菌、番茄匍柄霉、立枯丝核菌、禾谷镰孢菌、细极链格孢、番茄灰霉孢、核盘菌均具有较强的抑菌作用,抑菌率达到70%以上,对尖孢镰刀菌为中度拮抗作用,抑菌率为62.23%。
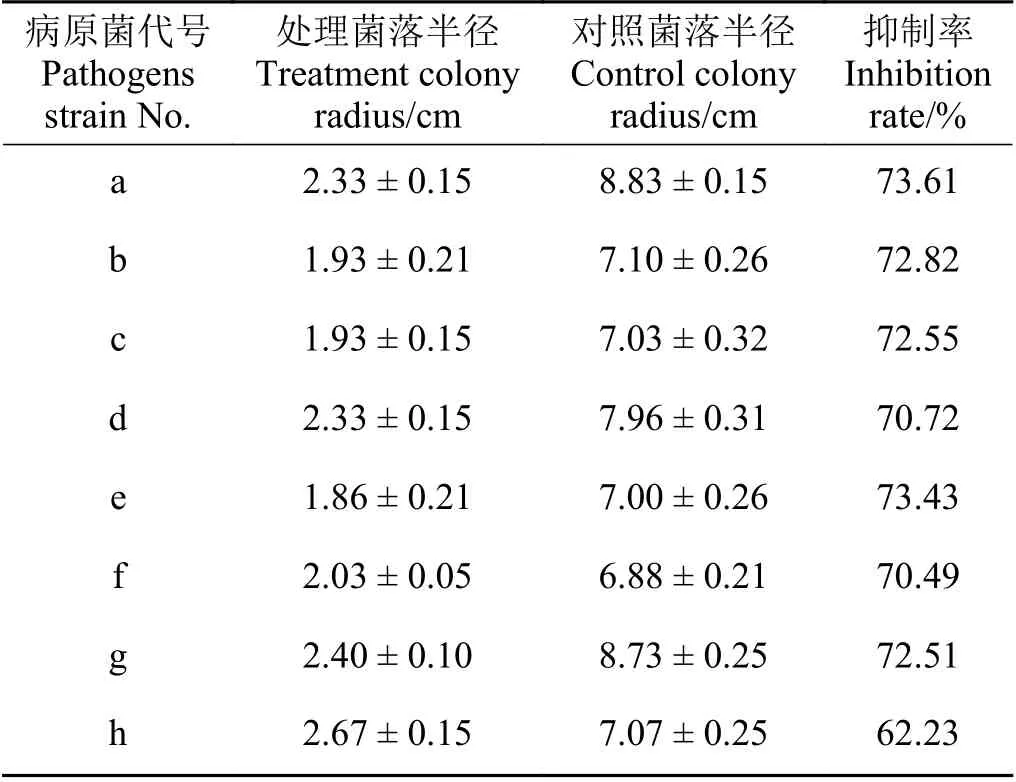
表1 菌株YF 抑菌广谱性测定Table 1 Determination of broad spectrum antimicrobial activity of strain YF
2.3 拮抗菌株YF 的鉴定
菌株YF 在PDA 培养基上菌落为圆形,突起,乳白色,粘稠状,不透明,表面湿润光滑,边缘不整齐,具有很强的粘性(图2A);经革兰氏染色观察,该菌为革兰氏染色阳性,菌体杆状,大小为(0.5~2.5) μm × (1.2~8) μm (图2B)。利用16S rDNA 基因进行PCR 扩增分析,结合最大似然法建树进行鉴定。结果显示,菌株YF (GenBank 登录号:MW205750)与多粘类芽孢杆菌[Paenibacillus polymyxaATCC:25901 (KM051087.1)]聚集在一起(图3)。因此,基于以上研究结果可以确定菌株YF 为多粘类芽孢杆菌。
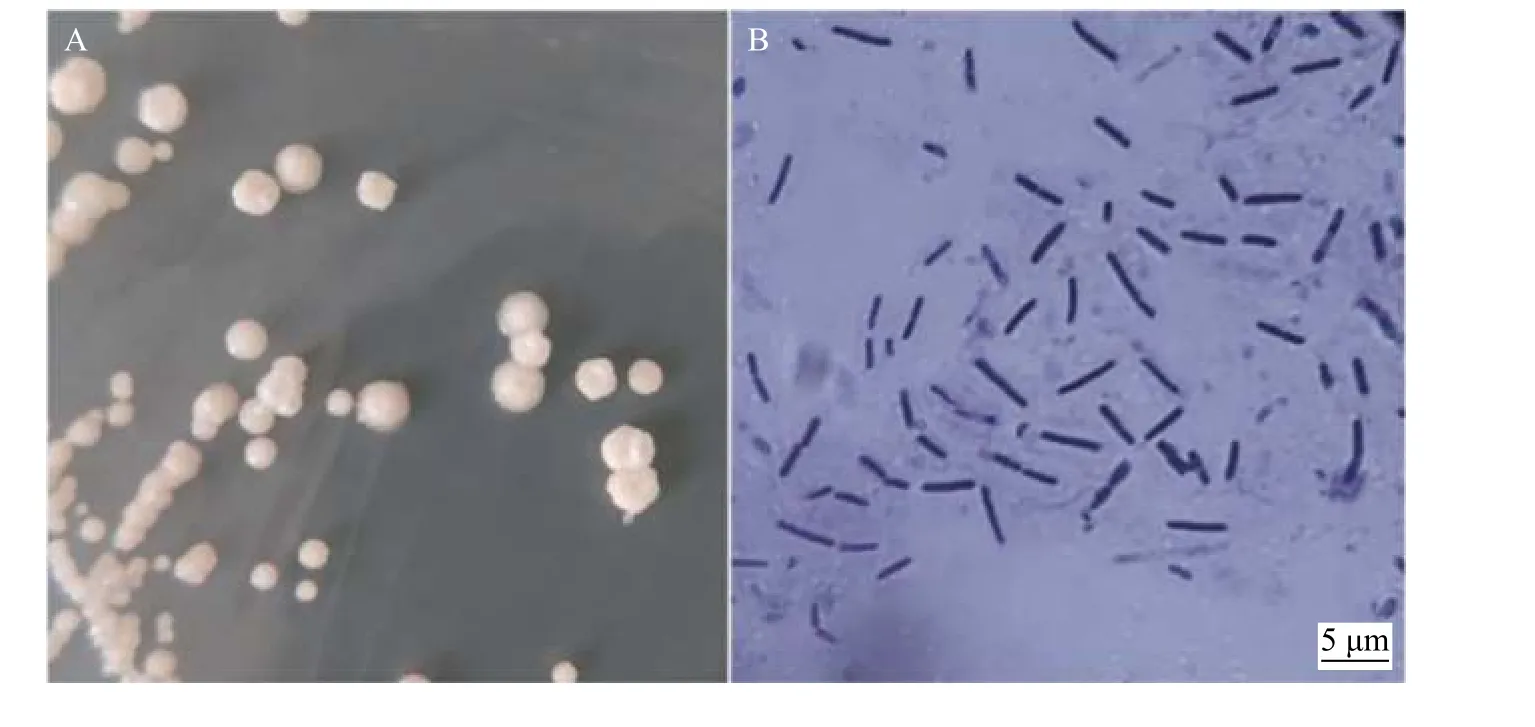
图2 菌株YF 形态Figure 2 Morphology of strain YF

图3 基于16S rDNA 基因系统发育树Figure 3 Phylogenetic tree based on 16S rDNA gene
2.4 菌株YF 发酵液对燕麦镰孢菌菌丝和孢子萌发的抑制作用
利用菌株YF 无菌发酵滤液处理燕麦镰孢菌后通过显微镜观察发现,燕麦镰孢菌菌丝生长明显受到YF 发酵滤液的影响(图4)。与对照组相比,处理组的燕麦镰孢菌菌丝膨大变粗,分枝增多,节间缩小,出现囊泡状畸形。采用琼脂培养法研究了该菌发酵液对燕麦镰孢菌孢子萌发的影响,结果表明,对照组萌发率为90.00%,处理组萌发率为12.67%,经计算,该菌对燕麦镰孢菌孢子萌发的抑制率为85.92% (表2)。

表2 孢子萌发抑制率Table 2 Rate of inhibition of spore germination

图4 菌株YF 对燕麦镰刀菌的抑制作用Figure 4 Inhibition of Fusarium avenaceum by strain YF
2.5 菌株YF 防效测定
为验证菌株YF 在田间对燕麦镰孢菌的作用效果,模拟田间开展了室内盆栽防效试验。从农艺性状来看,不同处理组的盆栽燕麦在出苗15 d 后表现出明显差异,其中多粘类芽孢杆菌处理组燕麦长势良好,根系发达,株高和根长与其他处理组间存在明显差异(表3),多菌灵处理组次之,空白对照组燕麦明显长势较弱,根系较少,并且根部变褐色(图5)。统计分析发现,多粘类芽孢杆菌处理组的发病率、病情指数、防治效果均与多菌灵处理和空白对照差异显著(P< 0.05),其防治效果高达81.45%,明显优于多菌灵处理组的61.87%。

图5 菌株YF 对燕麦生长的影响Figure 5 Effect of strain YF on oat growth

表3 菌株YF 在燕麦上的防治效果Table 3 Control effect of strain YF on oat
3 讨论与结论
我国燕麦主产区主要分布在内蒙古、青海、陕西、山西、吉林、甘肃[18],燕麦产区各种病害的发生已经引起了重视,尤其对叶部病害的调查研究较多,但是对于燕麦根腐病的研究报道相对较少。根据《中国牧草真菌病害名录》[19]记载,能够引起燕麦根腐病的病原菌有燕麦镰孢菌、大刀镰孢菌(F.culmorum)、禾谷镰孢菌、雪腐镰孢菌(F. nivale)、长直喙镰孢菌(F. orthoceras)、早熟禾镰孢菌(F. poae)、藤草镰孢菌(F. scripi),并且病害分布不详。马从[20]对甘肃省燕麦病害调查发现根腐病病原菌为小麦长蠕孢菌(Helminthosporium tritici-repetis)。陈昊[5]通过对甘肃省燕麦真菌病害多样性调查发现,燕麦根腐病病原菌为燕麦镰孢菌、层出镰孢菌(F.proliferatum)、雪球微座孢(M. nivale),其中燕麦镰孢菌的分离频率最高,在通渭、山丹、天祝和榆中4 个地区分离率分别达到31%、30%、58%和44%,燕麦根部病害在各地发生差异较大,山丹地区相比于其他调查地区发病率最高,青引1 号燕麦品种的发病率达到2.93%,而在通渭地区根部病害发生最轻,定引1 号发病率为0.02%,在天祝、榆中地区不同品种的发病率不同,但总体发病率较低。
关于燕麦根腐病防治研究大多数是化学防治,生物防治文献极少,仅有陈昊[5]和马从[20]分别研究报道菌株Y-Y-1 与菌株LHS11 对燕麦根腐病病原菌有抑制作用,但抑菌效果并不理想,抑菌率分别为3.09%与41.2%。为了燕麦种植业的健康发展,急需开展该领域的绿色生物防治研究。本研究从甘肃合作市卡加曼乡香拉村燕麦根际土壤中分离到一株生防菌YF,经鉴定为多粘类芽孢杆菌,室内活性测定发现该菌不仅对燕麦镰孢菌具有较好的抑制作用,对孢子萌发抑制作用也达到85.92%。通过盆栽试验发现菌株YF 对燕麦根腐病的防治效果达到81.45%,防效显著高于化学农药多菌灵(61.87%),并且对燕麦促生长作用明显。因此,多粘类芽孢杆菌YF 具备开发为燕麦根腐病生物防治菌剂的潜力。
多粘类芽孢杆菌是目前农业生产中应用较为广泛的生物菌剂。可用于多种真菌、细菌和线虫引起的病害防治。据文献报道,多粘类芽孢杆菌XZ-2 发酵原液10 倍稀释液对甘薯(Dioscorea esculenta)黑斑病的防治效果最佳,达到73.62%,并且显著地抑制其分生孢子的萌发[21]。刘珂欣等[22]研究表明,多粘类芽孢杆菌CH-23 菌剂对水稻(Oryza sativa)恶苗病具有较好的生防效果,生防指数高达68.35%。孙光忠等[23]研究表明,5 亿cfu·g−1多粘类芽孢杆菌悬浮剂对小麦(Triticum aestivum)赤霉病防治效果在80%以上,增产效果达到14.51%~17.27%,说明多粘类芽孢杆菌可以广泛用于小麦赤霉病的防治。多粘类芽抱杆菌已作为微生物杀菌剂产品进行登记,在美国登记的商品名为Hydroguard,在韩国登记的商品名为Topseed 和NH[24],说明多粘类芽孢杆菌具备广谱的抗菌活性。
本研究所筛选出的拮抗菌株YF 从室内活性测定和盆栽试验证明其对燕麦镰孢菌有较好的防治效果,但还需要研究菌株YF 针对燕麦镰孢菌作用的主要代谢产物及作用分子机理,阐明其作用机制,并进一步开展田间试验验证,有望早日将该菌开发为用于防治燕麦镰孢菌的生物防治菌剂。本研究结果可为燕麦根腐病病原菌燕麦镰孢菌的生物防治和相应产品的开发提供新的思路和途径。
