<10 mm纯磨玻璃肺腺癌临床、CT和病理资料的相关性研究
2021-12-29李辉贤左玉强段俊王胜磊刘占杰张亚肖甄强吕宝雷王仁峰宋春旺
李辉贤 左玉强 段俊 王胜磊 刘占杰 张亚肖 甄强 吕宝雷 王仁峰 宋春旺
近年来由于健康意识增强及体检采用胸部薄层高分辨CT检查,临床上被发现的直径在≤10 mm的肺结节(亚厘米结节)或淡片状磨玻璃密度肺结节越来越多[1]。根据2017年Fleischner学会指南定义,肺结节被分为实性结节和亚实性结节,其中亚实性结节包括纯磨玻璃结节(pure ground glass nodule,pGGN)和部分实性结节[2]。pGGN特指在胸部CT上病灶密度略增高而不足以遮盖其内血管走行的病灶,因其形似磨砂玻璃而被冠以其名[3]。以往有研究认为对于pGGN来说,直径10 mm 是其浸润前病变与浸润性病变的最佳临界值,直径<10 mm的pGGN多为浸润前病变,但近年来有部分学者通过研究发现在<10 mm的pGGN中也有部分是微浸润腺癌或浸润性腺癌[4,5]。目前,笔者发现国内外报道对直径<10 mm的pGGN的临床资料较少。不同病理亚型肺腺癌的5年生存率也不同,因此术前正确诊断对不同亚型肺腺癌临床处理策略的选择、预后判断及指导治疗有重要意义[6,7]。
1 资料与方法
1.1 一般资料 回顾性分析我院2017年5月至2019年4月53例经手术切除且病理证实为肺腺癌患者的临床、CT及病理资料,患者均为单发病灶,共计53个pGGN。53例患者中,男25例,女28例;年龄33~74岁,平均(57.15±9.33)岁。患者均无临床症状,部分因体检发现,部分因其他疾病住院期间检查偶然发现。所有pGGN病灶按照WHO(2015)肺肿瘤组织学分类[8]标准分为不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(microinvasive adenocarcinoma,MIA)和浸润性腺癌(invasive adenocarcinoma,IAC)4种病理类型,按照浸润程度将不典型腺瘤样增生和原位腺癌归为浸润前病变组(37个pGGN,包括AAH 14个,AIS 23个),将微浸润腺癌和浸润性腺癌归为浸润性病变组(16个pGGN,包括MIA 4个,IAC 12个)。本研究经医院伦理委员会批准,且所有纳入者签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准:①病灶均在层厚≤1.5 mm层厚的薄层CT影像上表现为最大径<10 mm的pGGN;②所有患者在pGGN切除之前均未经任何抗肿瘤治疗;③所有pGGN病灶经切除后并经病理证实为肺腺癌;④患者均无肺门及纵膈肿大淋巴结。
1.2.2 排除标准:①在薄层CT图像上显示病灶内有实性成分;②患者既往接受过抗肿瘤治疗。
1.3 检查方法 所有患者经美国GE公司64排螺旋CT(LightSpeed VCT,Optima)进行胸部扫描。扫描时患者取仰卧位,头先进,于患者吸气末屏气后进行扫描,扫描范围自肺尖到肺底。扫描参数如下:管电压120 kV,管电流100~300 mA自动适应,螺距1.375∶1,扫描层厚5 mm,视野360 mm,图像矩阵512×512。扫描完成后进行层厚1.25 mm薄层重建。
1.4 方法 由一名住院医师记录患者的性别、年龄、吸烟史、肿瘤史及CEA是否升高,CEA的数值取患者术前空腹状态下静脉血测量值,测量仪器为瑞士Roche公司Modular E170电化学发光免疫分析系统及配套试剂,检测结果以≥5 ng/ml记为升高。由两名具有5年以上胸部影像诊断的主治医师在不知道患者临床及病理结果的情况下进行单独阅片、分析及诊断,并记录所有pGGN的CT形态学表现(分布、形态、大小、密度、瘤肺界面、空泡征、空气支气管征、分叶征、毛刺征、血管集束征、胸膜凹陷征)。其中病变大小测量时需在横断面薄层肺窗图像上测量病灶的最大径(mm),瘤肺界面根据pGGN病灶与周围肺实质间界面是否清晰可辨分为瘤肺界面清晰和瘤肺界面模糊;空泡征特指pGGN病灶内最大径<5 mm的点状透亮区。pGGN的CT形态学表现测量及记录需要在肺窗上进行,观片条件如下:肺窗窗宽1 500 Hu,窗位-600 Hu;纵隔窗400 Hu,窗位50 Hu。pGGN最大径的测量在1.25 mm层厚的薄层横断面图像上测量其最大距离;pGGN密度的测量时需避开病灶内支气管、血管、空泡等位置尽可能选择最大的测量范围;pGGN病灶最大径及密度需取两名影像医师测量的平均值。当两名影像医师对CT征象意见不统一时需协商解决。

2 结果
2.1 2组不同临床资料比较 浸润前病变组性别比、年龄、吸烟史、肿瘤史、CEA升高比例与浸润性病变组比较,差异无统计学意义(P>0.05)。见表1。

表1 2组临床资料比较
2.2 2组pGGn病灶分布比较 浸润前病变组pGGn病灶分布于右肺上叶、右肺中叶、右肺下叶、左肺上叶和左肺下叶所占比例与浸润性病变组比较,差异无统计学意义(P>0.05)。见表2。

表2 2组pGGn病灶分布比较 例(%)
2.3 2组不同形状、界面、直径和密度比较 浸润前病变组直径、密度和瘤肺界面清楚所占比例低于浸润性病变组(P<0.05)。2组球/类球形比例比较,差异无统计学意义(P>0.05)。见表3,图1~4。

表3 2组不同形状、界面、直径和密度比较
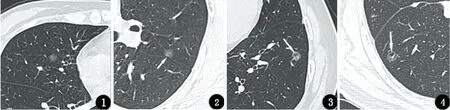

图1 患者女,57岁,横断面CT示右肺中叶内侧段pGGN,最大径约5.9 mm,CT值约-597 Hu,病灶呈不规则形,瘤肺界面模糊,病理结果为AAH图2 患者男,33岁,横断面CT示左肺上叶尖后段斜裂胸膜旁pGGN,最大径约7.8 mm,CT值约-522 Hu,病灶呈类球形,瘤肺界面清晰,邻近胸膜凹陷征(箭头),病理结果为AIS图3 患者男,73岁,横断面CT示左肺下叶外基底段pG-GN,最大径约9.8 mm,CT值约-474 Hu,病灶瘤肺界面清晰,病灶内可见空泡征(箭头),病理结果为MIA图4 患者男,60岁,横断面CT示右肺下叶背段pGGN,病灶呈不规则形,最大径约9.1 mm,CT值约-574 Hu,病灶瘤肺界面清晰,病灶内可见空泡征(箭头),病理结果为IAC
2.4 2组不同CT影像表现比较 浸润前病变组空泡征所占比例低于浸润性病变组,差异有统计学意义(P<0.05);2组空气支气管征、分叶征、毛刺征、血管集束征和胸膜凹陷征所占比例比较,差异均无统计学意义(P>0.05)。见表4。
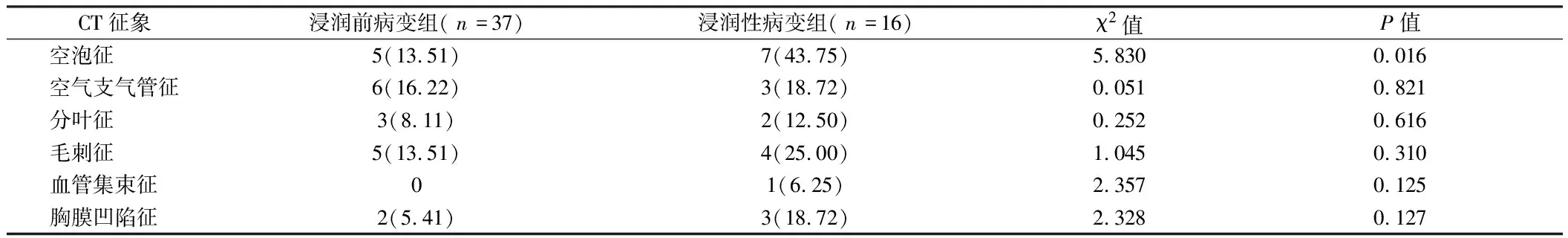
表4 2组不同CT影像表现比较 例(%)
2.5 两种不同病理亚型的指标的最佳临界值、敏感度、特异度 浸润前病变组与浸润性病变组pGGN大小的ROC曲线分析显示最佳临界值为7.65 mm,曲线下面积为0.828,敏感度87.5%,特异度70.3%。浸润前病变组与浸润性病变组pGGN密度的ROC曲线分析显示最佳临界值为-533.5 Hu,曲线下面积为0.777,敏感度75.0%,特异度73.0%。见图5。
3 讨论
有研究报道在常规体检者人群中pGGN的检出率为0.16~0.50%,且其检出率随着多排螺旋CT的普及和肺癌筛查的普及在继续增长[9]。有学者指出pGGN可以在一定时期内保持不变[8],但也有学者报道有40%的直径>10 mm的pGGN在随访过程中出现增长[10],有报道最大径≤10 mm的pGGN多为良性结节,但吴芳等[11]通过研究发现最大径≤10 mm的pGGN中有48.5%的为浸润性病变。由此可见,对于pGGN的最佳临床介入时间是一个值得深入研究的问题,尤其是针对于最大径<10 mm的pGGN。

图5 pGGN浸润前病变与浸润性病变大小、密度的ROC曲线
既往有研究报道患者的年龄、吸烟史是肺内结节恶性程度的独立危险因素,随着年龄增大和吸烟指数的增加,肺结节的恶性率增高[12]。此次研究中不同病理亚型间患者的年龄、吸烟史间差异均无统计学意义,分析其可能原因为研究对象不同所致;冯明凯等[12]研究对象为直径10 mm以下结节,包括实性结节、部分实性结节和磨玻璃结节,不同于此次研究对象为pGGN。有研究报道CEA为广谱性肿瘤标记物,其表达量及阳性率随着肿瘤恶性程度的增加而增加,且其有助于诊断恶性肺结节[13]。本研究发现2组患者CEA升高的发生率均较低,在浸润前病变组和浸润性病变组发生率分别为5.41%、12.50%,且CEA升高患者在两种不同病理亚型间差异无统计学意义;可能是因为本研究纳入对象为pGGN,且所有病灶最大径<10 mm,即使pGGN为IAC,其也属于早期,因此CEA无明显升高。Tamura等[14]对63例pGGN患者的临床病史及pGGN的最大径、形态和边缘特征进行回顾性研究发现,患者肺癌家族史和pGGN的平均CT值与pGGN的增长密切相关,是独立的风险因素。此次研究发现患者肿瘤史间差异无统计学意义,导致该结果的可能原因为此次研究统计的是患者本人肿瘤史而非患者肺癌家族史。
以往有文献报道pGGN随着浸润程度的增加,其病灶大小亦随之增大[3,11]。此次研究发现浸润性病变组pGGN病灶较浸润前病灶最大径平均值大,且组间差异有统计学意义,再次印证以上学者[3,11]观点,即随着pGGN病变浸润程度的增加,其大小亦随之增大。另外,此次研究通过ROC曲线分析发现,最大径<10 mm的pGGN的浸润前病变与浸润性病变的最佳临界值为7.65 mm,提示当pGGN病灶最大径超过7.65 mm时,其为浸润性病变的可能性大,尽管此次ROC曲线下面积仅为0.828,但该最佳临界值还是能为<10 mm的pGGN浸润性病变的判断提供一定参考。同理,很多研究表明定量影像可以判断肺腺癌的病理学侵袭性[15]。Kitami等[16]研究发现当pGGN直径<10 mm,且平均CT值≤-600 Hu,几乎全是浸润前病变;部分学者研究发现浸润性病变的pGGN病灶平均CT阈值较-600Hu高[17,18]。Zhang等[19-21]研究表明,pGGN的平均CT值与肿瘤中侵袭性成分的含量呈显著正相关(P=0.02)。此次研究发现浸润性病变组pGGN病灶平均CT值约为(-511.56±83.28)Hu,较浸润前病变组pGGN病灶平均CT值(-572.746±80.76)大,且组间差异有统计学意义;ROC曲线分析显示浸润前病变与浸润性病变的最佳临界值为-533.50 Hu;该结果与范丽等[7,17]学者研究结果基本一致。分析pGGN病灶随着浸润程度增加而平均CT值增加的病理机制可能是由于肿瘤细胞最初沿着肺泡壁生长而未破坏肺实质,随着病变进展,肿瘤细胞逐渐开始浸润肺泡壁,肺泡腔逐渐被肿瘤细胞充填,pGGN逐渐变得密实[20]。
此次研究pGGN病灶的形态学特征中仅瘤肺界面、病灶内空泡征在不同病理亚型间差异有统计学意义,浸润性病变组pGGN病灶瘤肺界面清晰及空泡征的发生率均高于浸润前病变组。导致浸润性pGGN瘤肺界面清晰的病理机制可能是由于肿瘤细胞沿肺泡壁生长,增殖的肿瘤细胞排列较为紧密从而使得肺泡壁结构更加密实和(或)肺泡壁厚度增加所致,该点有别于炎性细胞浸润所导致的瘤肺界面模糊[22,23]。空泡征特指pGGN病灶中最大径<5 mm的点状透亮区。在此次研究中空泡征在浸润性病变中发生率较浸润前病变组更高,且组间差异有统计学意义,导致该结果的病理机制可能是由于肿瘤细胞呈伏壁式生长,随着肿瘤组织的侵犯,受破坏而扩张的肺泡腔或未完全被肿瘤细胞填充的肺泡腔所致[23]。
2017年肺结节Fleischner指南[2]指出肺上叶为肺亚实性结节恶性病变的独立危险因素,但此次研究中,pGGN病灶分布在不同病理亚型间差异无统计学意义,可能是由于此次研究样本量小而导致的偏差所致,有待于未来基于更大样本量的进一步分析。此次研究中pGGN病灶的其他形态学征象,如:分叶征、毛刺征、血管集束征、胸膜凹陷征等在不同病理亚型间差异无统计学意义,这与部分学者研究结果[3,7,11,22]一致,其原因可能是由于<10 mm的pGGN尚处于病变的早期,侵袭性较低,尚未表现出恶性肿瘤的典型征象。
本研究存在以下不足:(1)本研究样本量较小,可能导致统计学偏差的存在;(2)本研究所有纳入对象均为手术切除的病例,样本不可避免存在一定偏倚;(3)本研究纳入对象为单发pGGN患者,未将多发pGGN纳入研究对象。
综上所述,<10 mm的pGGN病灶的一些CT征象在浸润前病变与浸润性病变组存在差异,浸润性病变组pGGN病灶较浸润性病变较大、密度较高,且瘤肺界面清晰、空泡征的发生率更高。因此,通过对pGGN病灶的CT征象分析,可以预测其浸润性病变的可能,为临床制定合理的治疗方案提供帮助。
