七氟醚调控miR-4458影响胃癌SNU-1细胞的增殖、迁移和凋亡
2021-12-30封雪王咏强赵滨滨
封雪 王咏强 赵滨滨
胃癌发病率和死亡率分别高居全球恶性肿瘤排行榜第四位和第二位,已成为一种全球性重大健康问题[1]。随着胃癌综合诊断和治疗手段不断进展,胃癌患者预后得到改善,但由于胃癌细胞的异常存活和恶性迁移、侵袭,胃癌患者的长期生存率仍较低[2]。手术是临床胃癌治疗重要手段之一,研究显示围手术期麻醉药的应用可能影响肿瘤细胞和免疫细胞的行为,与癌症的不良结局有关[3]。七氟醚是临床常用麻醉药之一,具有用药剂量小、对血液动力学影响轻微、苏醒快等优势。最近研究表明,七氟醚通过调节微小RNA(miRNA)表达对结直肠癌、乳腺癌、胶质瘤的增殖、迁移和侵袭具有显著抑制作用[4-6]。miR-4458是一种乳腺癌、非小细胞肺癌抑癌基因,上调miR-4458表达对癌细胞的增殖、迁移和侵袭有显著抑制作用[7,8]。异丙酚对肝癌细胞生长和转移的抑制作用亦与上调miR-4458表达有关[9]。但miR-4458在胃癌中的作用、七氟醚是否调控miR-4458表达发挥抗肿瘤作用。本研究重点探讨了七氟醚对胃癌细胞SNU-1增殖和凋亡的影响,并探讨其机制是否与调控miR-4458表达有关。
1 材料与方法
1.1 材料 SNU-1细胞、GES细胞购于武汉普诺赛生命科技公司;七氟醚购于上海恒瑞医药有限公司;miRNA模拟物(mimics)、抑制物(anti-miRNA)购于北京华大基因公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium)MTT试剂盒、总RNA提取试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购于北京索莱宝生物公司;Transwell小室购于美国密理博公司;兔源β-actin(β-肌动蛋白)、细胞周期蛋白D1(CyclinD1)、裂解的半胱氨酸蛋白酶3(Cleaved-caspase-3)、机制金属蛋白酶2(MMP-2)、MMP-9抗体等一抗以及羊抗兔IgG二抗购于美国CST公司;miRNA逆转录试剂盒、miRNA定量PCR试剂盒购于美国GeneCopoeia公司。
1.2 方法
1.2.1 细胞培养:SNU-1细胞采用含10%胎牛血清、1%青链霉素双抗的RPMI-1640培养基在37℃、CO2体积分数为5%的湿润培养箱中培养。按照1∶4比例进行传代培养,换液频率为每周2~3次,选取第3次对数期细胞进行后续实验。将细胞培养板置于密闭培养箱中,进气口、出气口分别连接麻醉气体挥发罐(5% CO2、21% O2、74% N2)、气体分析仪。将混合气体瓶连接麻醉机,打开混合气体瓶预充气3 min,随后调整气流为0.5 L/min。随后打开麻醉挥发罐,维持适当麻醉气体浓度,37℃处理6 h,取出平板常规培养24 h[10],随后测定细胞活力、迁移和凋亡情况。
1.2.2 实验分组:将SNU-1细胞分为正常对照(NC)组:进充入混合气体;1.7%给药组:七氟醚浓度为1.7%;3.4%给药组:七氟醚浓度为3.4%;5.1%给药组:七氟醚浓度为5.1%。为证实miR-4458对SNU-1细胞生物学行为的影响,利用脂质体法将miR-NC、miR-4458 mimics、anti-miR-NC、anti-miR-4458瞬时转染至SNU-1,依次记为miR-NC组、miR-4458 mimics组、anti-miR-NC组、anti-miR-4458组,收集转染48 h细胞进行后续分析。为证实七氟醚是通过调控miR-4458表达进而影响SNU-1细胞生物学行为,对转染anti-miR-NC、anti-miR-4458的SNU-1细胞(转染48 h)进行七氟醚处理6 h,依次记为5.1%给药+anti-miR-NC组、5.1%给药+anti-miR-4458组,常规培养24 h进行后续分析。人正常胃黏膜细胞(GES1)组:正常培养的GES1细胞;GES1(5.1%给药组):七氟醚浓度为5.1%。
1.2.3 MTT法检测细胞活力:将各组SNU-1细胞接种到96孔板上,培养24 h后,每孔加入20 μl的MTT溶液在37℃下孵育4 h。之后,弃去培养基,并向每个孔中加入150 μl的二甲基亚砜以溶解晶体。酶标仪测量570 nm波长的吸光度(A)来确定细胞活力。
1.2.4 流式细胞术检测细胞凋亡:Annexin V结合缓冲液重悬各组细胞,向100 μl细胞悬液中加入5 μl的Annexin V-FITC和5 μl的PI暗室孵育15 min。流式细胞仪分析细胞凋亡。
1.2.5 Transwell实验检测细胞迁移:将各组细胞重悬在不含胎牛血清的培养液中,分别200 μl加入Transwell上室中,而下室中加入500 μl含有10%的胎牛血清的培养基。37℃下孵育12 h后,用无菌棉擦去上室内未迁移细胞,4%多聚甲醛固定Transwell膜下表面迁移细胞10 min,室温下用0.5%结晶紫染色10 min。显微镜下随机选择3个视野进行细胞计数,以平均值表示细胞迁移数量。
1.2.6 蛋白质印迹法(Western blot)检测CyclinD1、Cleaved-caspase-3、MMP-2、MMP-9蛋白表达:放射免疫沉淀测定(RIPA)缓冲液裂解各组细胞,BCA分析试剂盒测量蛋白浓度。100℃变性5 min,随后取等量变性蛋白进行聚丙烯酰胺凝胶电泳(PAGE)。蛋白转移到聚偏二氟乙烯(PVDF)膜上后,将膜与5%脱脂牛奶室温下孵育1 h,再将膜与特异性一抗(均1∶1 000稀释)4℃孵育过夜。然后将膜与相应二抗室温下孵育2 h。用增强型化学发光试剂盒检测蛋白条带,凝胶成像系统分析灰度值,目的蛋白和内参β-actin灰度值比值为目的蛋白相对表达量。
1.2.7 实时定量PCR(RT-qPCR)检测miR-4458表达:总RNA提取试剂盒分别提取各组细胞总RNA,用miRNA逆转录试剂盒合成cDNA,再采用miRNA qPCR试剂盒进行定量分析。2-ΔΔCt方法计算miR-4458表达量。miR-4458上游引物5’-AGAGGTAGGTGTGG
AAGAA-3’,下游引物5’-GCGAGCACAGAATTAATAC
GA C-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTT GCGT-3’。

2 结果
2.1 不同浓度七氟醚对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响 不同剂量七氟醚处理后SNU-1细胞活力、迁移细胞数显著降低,而凋亡率显著升高,差异有统计学意义(P<0.05)。七氟醚(5.1%)处理后GES1细胞活力、迁移细胞数、凋亡率无显著变化。见图1,表1。
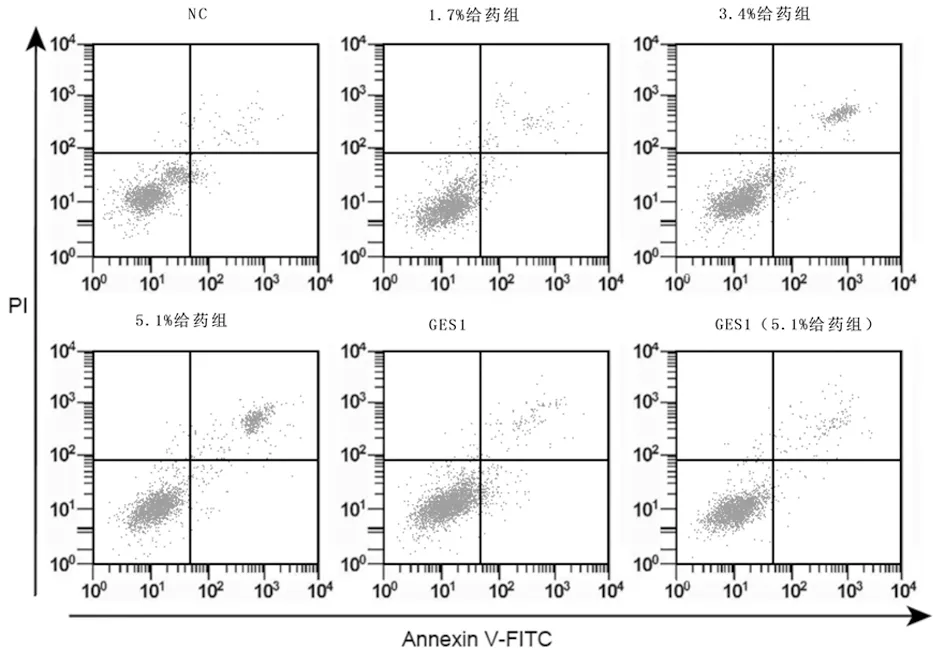
图1 不同浓度七氟醚对胃癌细胞SNU-1细胞凋亡的影响

表1 不同浓度七氟醚对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响
2.2 不同浓度七氟醚对胃癌细胞SNU-1中CyclinD1、Cleaved-caspase-3、MMP2、MMP9蛋白表达的影响 不同剂量七氟醚处理后SNU-1细胞中CyclinD1、MMP-2和MMP-9蛋白表达量显著降低,差异有统计学意义(P<0.05),而Cleaved-caspase-3蛋白表达量显著升高,差异有统计学意义(P<0.05)。见图2,表2。

图2 七氟醚对胃癌细胞SNU-1中CyclinD1、Cleaved-caspase-3、MMP-2、MMP-9蛋白表达的影响

表2 七氟醚对胃癌细胞SNU-1中CyclinD1、Cleaved-caspase-3、MMP-2、MMP-9蛋白表达的影响
2.3 不同浓度七氟醚对miR-4458表达的影响 不同剂量七氟醚处理后SNU-1细胞中miR-4458表达量显著升高,差异有统计学意义(P<0.05)。见表3。
2.4 miR-4458对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响 与miR-NC组比较,miR-4458组SNU-1细胞miR-4458表达量显著升高(P<0.05),细胞活力、细胞迁移数量、CyclinD1、MMP-2以及MMP-9蛋白

表3 七氟醚对miR-4458表达的影响
表达量显著降低(P<0.05),凋亡率、Cleaved-caspase-3蛋白表达量显著升高(P<0.05)。与anti-miR-4458组比较,anti-miR-4458组SNU-1细胞miR-4458表达量显著降低(P<0.05),细胞活力、细胞迁移数量、CyclinD1、MMP-2以及MMP-9蛋白表达量显著升高(P<0.05),凋亡率、Cleaved-caspase-3蛋白表达量显著降低(P<0.05)。见表4,图3。

表4 miR-4458对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响

图3 Western Blot检测CyclinD1、Cleaved-caspase-3、MMP-2、MMP-9蛋白的表达
2.5 抑制miR-4458表达逆转七氟醚对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响 与5.1%给药+anti-miR-NC组比较,5.1%给药+anti-miR-4458组SNU-1细胞miR-4458表达量显著降低(P<0.05),细胞活力、细胞迁移数量、CyclinD1、MMP-2以及MMP-9蛋白表达量显著升高(P<0.05),凋亡率、Cleaved-caspase-3蛋白表达量显著降低(P<0.05)。见图4,表5。
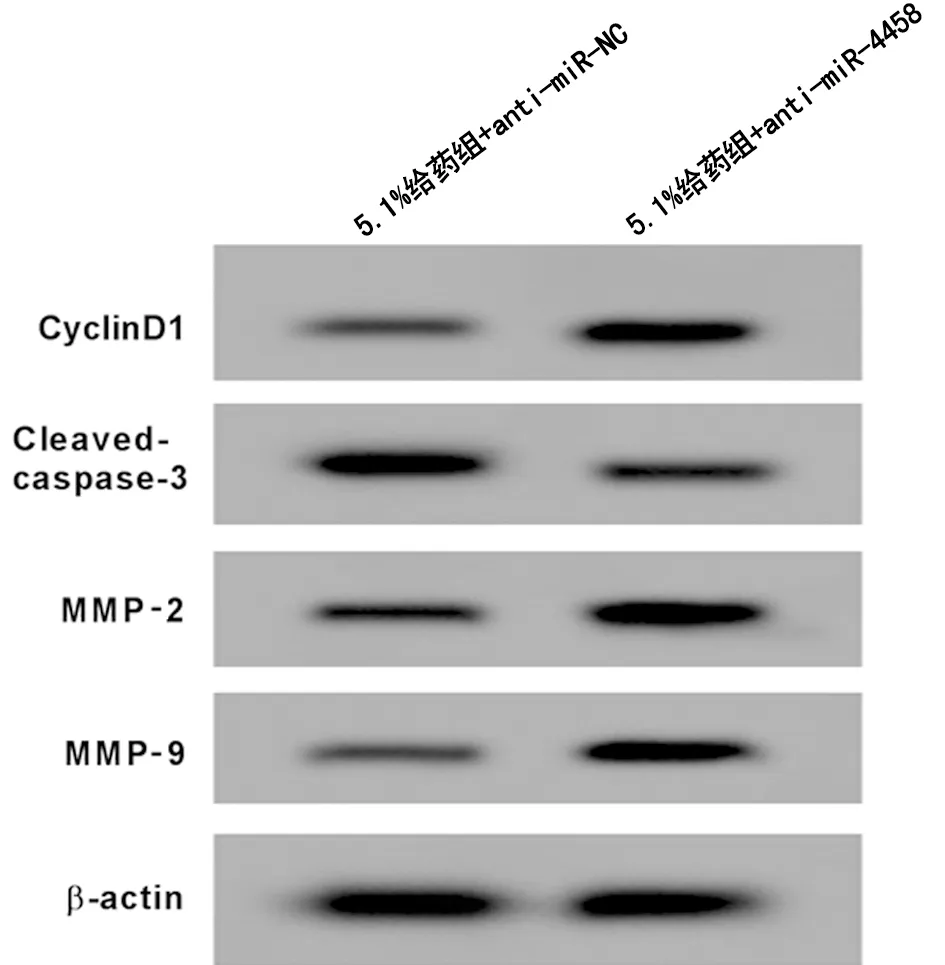
图4 Western Blot检测CyclinD1、Cleaved-caspase-3、MMP-2、MMP-9蛋白的表达

表5 anti-miR-4458逆转七氟醚对胃癌细胞SNU-1细胞增殖、凋亡及迁移的影响
3 讨论
癌细胞的异常迁移和侵袭在胃癌复发中具有重要作用。已有研究显示麻醉药的使用可影响癌症患者的临床结局。七氟醚是临床常用吸入性麻醉剂,已被证实在肺癌、乳腺癌等多种实体肿瘤中具有抗增殖、抗转移和促凋亡作用[11]。Yang等[12]研究显示七氟醚可能通过抑制ERK信号通路参与结肠癌上皮间充质转化调控抑癌细胞增殖和转移,并诱导细胞凋亡和自噬。Kang等[13]报道七氟醚调控丝裂原活化蛋白激酶(MAPK)信号通路以剂量依赖的方式抑制了卵巢癌细胞的增殖、迁移和侵袭,并促进细胞凋亡。与上述研究类似,本研究中七氟醚处理后SNU-1细胞活力、侵袭数量显著降低,而细胞凋亡率显著增加,并呈剂量依赖效应。CyclinD1是细胞周期调控重要参与者,其通过促进周期向S期推进具有抗增殖作用,研究指出川芎嗪通过下调CyclinD1表达诱导G1期阻滞具有显著的抗肿瘤作用[14]。MMP-2和MMP-9能够消化细胞外基质和基底膜从而提高肿瘤细胞的运动能力进而促进肿瘤细胞转移、扩散,降低MMP-2和MMP-9表达量可有效胃癌细胞的迁移和侵袭[15]。本研究中七氟醚以剂量依赖方式降低CyclinD1、MMP-2以及MMP-9表达水平,与其抗增殖、抗迁移作用相吻合。此外,本研究发现七氟醚处理还可降低凋亡执行蛋白Cleaved-caspase-3表达水平。以上研究表明,七氟醚通过调控增殖、迁移和凋亡相关蛋白表达抑制胃癌细胞SNU-1增殖、迁移并诱导细胞凋亡。
miRNA通过与靶mRNA结合在转录后水平调控基因表达进而调节肿瘤细胞多种生物学过程参与癌症发生发展。研究表明miR-4458表达降低与肝癌患者预后差呈正相关[16]。血管瘤中过表达miR-4458显著抑制细胞增殖、诱导细胞周期阻滞,而抑制miR-4458表达可逆转G0/G1期阻滞和细胞凋亡[17]。此外,敲减Circ_0000337显著促进miR-4458表达降低骨肉瘤细胞的增殖和侵袭能力从而抑制骨肉瘤进展[18]。本研究中转染miR-4458 mimics发现,过表达miR-4458显著降低SNU-1细胞活力和迁移能力,下调CyclinD1、MMP-2以及MMP-9表达,上调Cleaved-caspase-3,并促进细胞凋亡,而转染anti-miR-4458抑制miR-4458表达则促进SNU-1细胞增殖和迁移,抑制细胞凋亡,这提示miR-4458在胃癌中具有抑癌作用。
近年来多项研究指出七氟醚通过调节miRNA表达对癌细胞发挥作用[17-20]。如七氟醚通过上调miR-124-3p表达抑制Rho相关的卷曲蛋白激酶(ROCK1)信号通路进而抑制胶质瘤细胞增殖和转移[19]。结肠癌中七氟醚通过调节miR-203表达抑制细胞外信号调节激酶(ERK)/MMP-9通路抑制癌细胞迁移和侵袭[20]。本研究中七氟醚处理后SNU-1细胞中miR-4458表达呈以剂量依赖方式增加,提示七氟醚在胃癌中抗肿瘤作用与诱导miR-4458表达增加有关。深入研究显示,抑制miR-4458表达还可逆转七氟醚对SNU-1细胞增殖、迁移、凋亡以及相关蛋白表达的影响,恢复SNU-1细胞增殖、迁移能力以及凋亡水平。以上研究提示七氟醚通过上调SNU-1细胞中miR-4458水平发挥其抗增殖、抗侵袭和促凋亡作用。
综上所述,本研究证实七氟醚通可抑制胃癌SNU-1细胞增殖和迁移,并诱导细胞凋亡,其机制与过上调miR-4458表达有关。这些发现有助于全面了解七氟醚的药理作用,为胃癌患者选择更合理的麻醉药提供实验依据。
