姜黄素通过Akt-mTOR信号通路调控细胞自噬对骨关节炎大鼠的保护作用研究
2021-12-29曹舒兴周楠王进赵立辉曹光马维李明
曹舒兴 周楠 王进 赵立辉 曹光 马维 李明
骨关节炎(Osteoarthritis,OA)是一种伴有疼痛的致残性进行性退行性疾病。据统计,髋关节和膝关节的OA残疾患者从1990年的1 050万增加到2010年的1 710万[1]。其主要病变为软骨退变,包括软骨细胞的死亡和细胞外基质的降解。目前虽然提出了很多方式预防延缓OA的发生,但还未发现有效的治疗方法来逆转疾病的进展[1],此外,目前大部分OA药物在长期使用过程中出现了严重的不良反应。因此,探索新型安全性治疗方法对OA患者来讲是必要的。细胞自噬作为一种内源性保护机制,它通过清除细胞内未折叠的蛋白和受损的细胞器,在骨关节炎的发生和进展过程中发挥着重要作用,近年来逐渐成为新的治疗靶点[2,3]。mTOR(哺乳动物雷帕霉素靶蛋白,the mammalian target of Rapamycin,mTOR)属于PI3K(磷脂酰肌醇3-激酶,phosphatidylinositol-3-kinase,PI3K)蛋白激酶类家族中成员,是许多与自噬相关的信号通路交汇节点,而且与骨关节炎有着密切的联系[4-6],其中Akt-mTOR信号通路对自噬起重要的负调控作用。姜黄素是从姜科姜黄属植物根茎中提取的一种天然酚性色素,其抗炎抗氧化的特性使姜黄素在改善OA的中药领域中脱颖而出[7,8]。据报道,姜黄素可以调控一系列信号通路的抑制和激活,包括核因子激活的B细胞的κ-轻链(nuclear factor-k-gene binding,NF-kB)通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路、信号转导与转录激活子(signal transducer and activator of tran-ions,STAT)通路等等[9]。但目前关于姜黄素对骨关节疾病的作用和机制研究较少。因此,本研究以大鼠OA模型为研究对象,以 PI3K-Akt-mTOR信号通路为切入点,探讨姜黄素通过调控细胞自噬减轻大鼠OA的作用及可能机制,为OA的临床应用提供实验依据。
1 材料与方法
1.1 实验动物 SPF清洁级SD雄性大鼠由河北医科大学实验动物中心提供,许可证号:SCXK(冀)2018-1-003,雄性,200~240 g,在恒温恒湿、明暗交替的环境中喂养,均可自由获得水和食物,饲养1周后用于实验。所有动物实验按照本院动物保护机构和伦理委员会的批准进行。
1.2 主要试剂与仪器 姜黄素、尼古丁均购自Sigma公司;TUNEL试剂盒购自Abcam公司;抗体 β-actin、procaspase-3、caspase-3及其活化状态(Active p19、Active p17)、Bax、Bcl-2、LC3、Beclin 1、p62、p-mTOR/mTOR、p-Akt/Akt及其下游激酶P70小体S6激酶(p70 ribosomal S6 kinase,P70S6K)等抗体均购自 CST 公司。DMEM 培养基、PBS、胎牛血清、0.25% 胰蛋白酶、青霉素和链霉素、RIPA 裂解液、BCA 试剂盒、BlueRanger预染蛋白质量标准购自美国Thermo公司。组织切片机(德国徕佧);酶标仪(Tecan,Mannedorf,Switzerland),电泳及转移系统(Bio-Rad公司,美国),Odyssey扫 描仪(LiCor公司,美国),普通倒置显微镜及荧光显微镜(Olympus公司,日本)。
1.3 实验方法
1.3.1 动物模型制备及给药:30只SD大鼠随机分为假手术组,手术组和治疗组,每组10只。采用改良Hulth法制备大鼠膝关节OA模型,即取髌骨旁内侧切口显露膝关节,切断前后交叉韧带及内侧副韧带,切除2/3半月板,保留关节面。假手术组只暴露膝关节前后交叉韧带及内侧副韧带,而不作任何其他处理。假手术组、手术组给予PBS灌胃,治疗组在术后即灌胃给药(姜黄素50 mg·kg-1·d-1),连续给药8周[9]。
1.3.2 软骨细胞的分离与培养:将假手术组、手术组、治疗组大鼠的膝关节软骨组织切成<1 mm的碎片,用0.25 g/L胰蛋白酶消化,然后用2 g/L的胶原酶Ⅱ孵育8 h,未消化的组织用180 μm细胞过滤器过滤,1 500 r/min离心10 min,锥虫蓝染色,检测细胞活力。在添加体积分数10%胎牛血清(100 U/ml青霉素和0.1 g/L链霉素)的DMEM中培养软骨细胞,细胞培养于37℃,体积分数5%CO培养箱中。在通路Akt-mTOR检测部分,提取进行改良Hulth法手术后的大鼠膝关节软骨组织细胞原代培养,分为4组:分别为手术组(原代细胞不额外添加其他试剂)、姜黄素组(添加40 μmol/L姜黄素处理24 h)、尼古丁组(添加2.5 μmol/L尼古丁处理24 h,该浓度可以显著激活mTOR通路且不影响细胞状态)、姜黄素+尼古丁组(姜黄素处理前2 h给予尼古丁(2.5 μmol/L)进行处理),以上各组处理24 h后收集细胞进行测试。
1.3.3 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(Terminal deoxynucleotidyl transferase-mediated dTUP-biotin nick end labeling assay,TUNEL)染色:在姜黄素处理8周后,处死动物进行原位凋亡检测,膝关节样品用福尔马林固定,脱钙,石蜡包埋,切片经二甲苯脱蜡和分级浓度的醇脱水后,用原位凋亡检测试剂盒TUNEL染色进行软骨细胞凋亡分析,光镜下检测阳性信号。采用TUNEL染色(绿色)和DAPI核复染(蓝色)来评估软骨细胞凋亡。凋亡率(%)定义为每个切片同一平面内阳性细胞核总数与现存细胞总数之比。比较各组细胞凋亡率,并进行统计学分析。
1.3.4 组织检查和免疫组化:番红-O固绿染色可评估软骨退化情况,原理在于嗜碱性的软骨与碱性染料番红O结合呈现红色。切片固定后用番红-O染色,镜检。软骨和软骨下板厚度的蛋白多糖缺失根据Mankin评分方法进行评估。切片常规脱蜡后进行LC-3的免疫组织化学染色。
1.3.5 Western blot检测:使用含有蛋白酶抑制剂混合物的RIPA裂解缓冲液从大鼠软骨组织/软骨原代细胞中提取胞浆蛋白,等量的蛋白质(30 μg)在SDS-PAGE凝胶上分离并电泳,将蛋白转移到聚偏二氟乙烯膜上,用5%脱脂牛奶在室温下封闭1 h,用一抗孵育膜过夜,第2天PBST洗3次后,二抗室温孵育1 h,PBST洗3次,暗房曝光。采用Image J对条带进行灰度值分析。

2 结果
2.1 姜黄素可降低OA的严重程度 通过番红-O染色和Mankin’s评分评估关节软骨结构特征来确定姜黄素对OA大鼠的影响。术后8周,大鼠出现OA病理学特征,表现为番红-O染色红色减少,细胞密度下降。治疗组软骨细胞密度增加,表明姜黄素可减轻大鼠OA严重程度。定量分析手术组软骨厚度明显低于假手术组(P<0.05),以及姜黄素处理后治疗组延缓了组织降解(P<0.05)。此外,与假手术组相比,手术组的Mankin’s评分显著升高(P<0.05),姜黄素治疗组的Mankin’s评分显著降低(P<0.05)。见图1,表1。

图1 术后8周假手术组、手术组、治疗组关节软骨番红-O染色
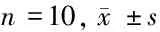
表1 3组相对软骨厚度及Mankin’s评分
2.2 姜黄素抑制大鼠OA软骨细胞凋亡 为了进一步研究姜黄素对OA中软骨细胞凋亡的影响,我们对关节软骨进行TUNEL染色分析,采用TUNEL染色和DAPI核复染来评估软骨细胞凋亡。与假手术组相比,术后8周OA大鼠出现软骨退化,软骨细胞凋亡明显增强。姜黄素治疗后,TUNEL阳性细胞数量减少,大鼠软骨损伤改善,细胞凋亡减少。Western blot检测凋亡相关标志物进一步证实了姜黄素对OA细胞凋亡活性的影响:caspase-3的激活以及Bax/Bcl2比值在姜黄素治疗后明显被抑制(P<0.05)。见表2,图2、3。
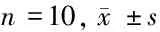
表2 3组细胞凋亡标记物相对蛋白量

图2 3组OA大鼠关节软骨组织中caspase-3和Bax/Bcl-2的相对蛋白表达
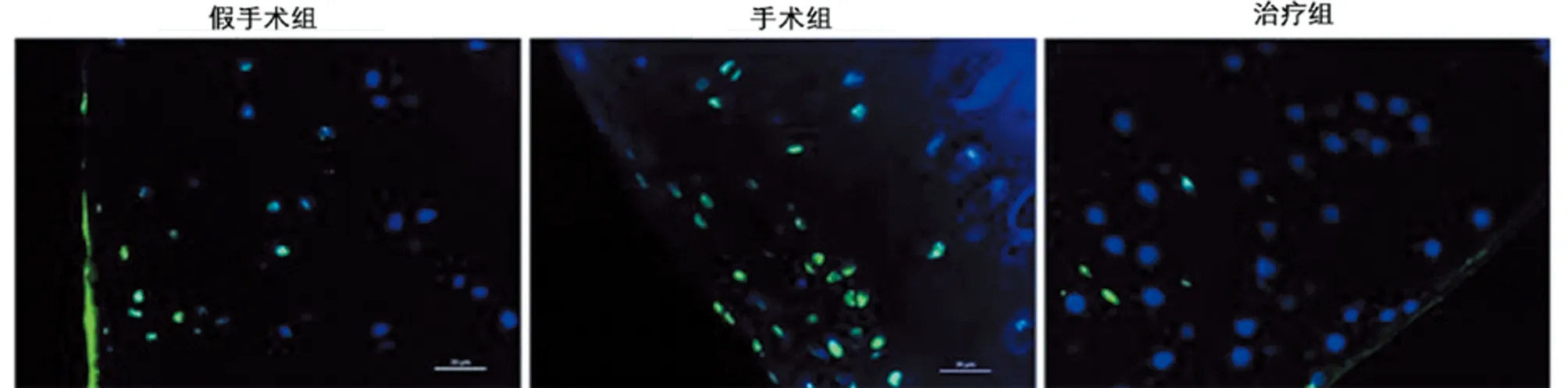
图3 姜黄素抑制OA大鼠软骨细胞凋亡TUNEL染色分析(×40)
2.3 姜黄素增强OA大鼠软骨细胞自噬 自噬是正常软骨的另一种保护机制。为了探讨姜黄素对自噬的影响,我们对OA大鼠关节组织LC-3的表达进行了免疫组化分析,姜黄素治疗组大鼠LC-3的表达明显高于手术组。Western blot检测了自噬相关标志物LC3-Ⅰ/Ⅱ和Beclin1的表达水平,进一步证实了这一观察结果:与未治疗大鼠相比,姜黄素治疗后LC3-Ⅰ/Ⅱ和Beclin1的表达均显著升高,而p62的表达显著降低(P<0.05)。见图4、5,表3。
2.4 姜黄素通过AKT/mTOR通路调控软骨细胞自噬

图4 姜黄素可有效促进OA大鼠软骨细胞自噬(免疫组×40)

图5 姜黄素抑制OA大鼠软骨细胞凋亡相关标志物表达
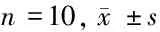
表3 3组软骨细胞自噬相关标志物相对蛋白量比较
Western blot结果显示,mTOR、Akt、及其下游激酶p-P70s6k在OA大鼠中的表达水平较高,而姜黄素处理后mTOR、Akt、p-P70s6k的表达水平较未处理大鼠显著降低(P<0.05)。Akt和mTOR的磷酸化位点分别为Ser473和Ser2448,提示AKT/mTOR通路可能参与姜黄素对OA大鼠软骨细胞自噬的调控过程。为了进一步确定姜黄素对软骨细胞自噬的调控是否依赖于Akt/mTOR,我们提取了进行改良Hulth法手术后的大鼠膝关节软骨组织细胞原代培养,分别添加40 μmol/L姜黄素、2.5 μmol/LAkt/mTOR通路激活剂尼古丁、姜黄素联合尼古丁[姜黄素处理前2 h给予尼古丁(2.5 μmol/L)进行处理],以上各组处理24 h后收集细胞进行测试。当给予姜黄素+尼古丁处理后,相比于单纯给予姜黄素,LC3Ⅱ/LC3Ⅰ水平明显下降(P<0.01)。结果证实了姜黄素对软骨细胞自噬的调控作用依赖于Akt/mTOR信号通路。见表4、5,图6、7。
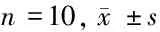
表4 3组Akt/mTOR通路相对蛋白量比较
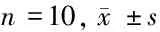
表5 尼古丁预处理后4组Akt/mTOR通路相对蛋白量比较
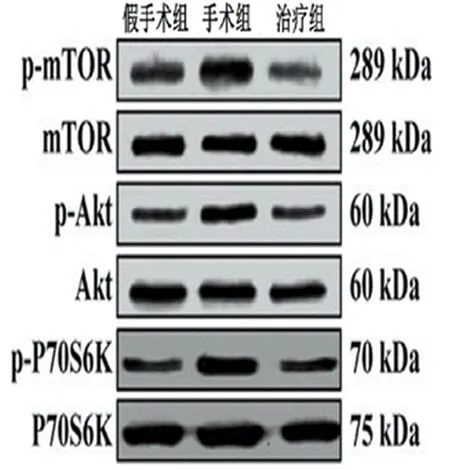
图6 3组关节软骨组织中p-mTOR, p-Akt, p-P70S6K蛋白表达水平

图7 尼古丁激活后各组p-mTOR, p-Akt, p-P70S6K蛋白表达水平
3 讨论
OA是一种进展缓慢的疾病,伴有明显的关节软骨丧失和纤维化。年龄增长是OA发病和进展的主要危险因素[10]。然而,由于关节不稳定和生物力学改变而导致的韧带断裂在10~15年后导致人类发生OA[11,12]。因此,手术不稳定模型已成为实验动物中最常见、最流行的OA模型[13]。与自发性模型相比,外科手术模型发病速度更快,变异更少,以及对遗传背景的依赖更小[14]。
在本研究中,我们采用Hulth法诱导大鼠OA模型,结果表明,姜黄素能有效改善OA模型大鼠的关节软骨损伤,并且这种改善是通过促进自噬实现的。姜黄素诱导的自噬增强与OA模型大鼠Akt/mTOR信号通路有关。
大量的临床实验已经证实姜黄素对OA具有治疗作用[15]。姜黄素保护软骨的机制之一是其抗软骨细胞凋亡的作用。一项研究通过免疫印迹和电镜[3]检测表明姜黄素可抑制IL-1β刺激的人软骨细胞凋亡。在本研究中,我们观察到OA大鼠关节软骨体中凋亡的软骨细胞显著增加。
动物和人类膝关节软骨的衰老与自噬减少有关,主要表现为自噬关键调控因子包括ULK1、Beclin 1和LC3[16]的表达降低。Beclin1通过使自噬相关蛋白聚集并启动自噬;LC3可以调控自噬泡的形成,其中LC3-Ⅰ型能够通过泛素化修饰转变为LC3-Ⅱ型,后者数量与自噬体数量成正比;而p62能够和待降解物结合,随着自噬作用的增加而不断地被消耗[16,17]。与衰老相关的OA一样,手术诱导的OA小鼠也表现出自噬减少和相关的凋亡增加[17]。通过对健康人和OA患者关节软骨自噬基因表达分析显示,在OA组织中LC3、Beclin1等20个下调的自噬相关基因,这些变化与细胞死亡/凋亡的重要调控因子上调[18]有关。已有文献表明,蔗糖[19]、雷帕霉素[20]等生物活性成分对OA的治疗作用与通过调控Akt/mTOR信号通路增加自噬有关。Akt属于一种丝氨酸/苏氨酸蛋白激酶,是调控mTOR最重要的直接上游分子,细胞内Akt蛋白的磷酸化后即被激活、进而活化下游mTOR(最关键的自噬负调控因子),细胞自噬抑制水平可以在很大程度上从Akt-mTOR通路的激活程度反映[17-19]。本研究中,我们的实验结果表明,在OA模型中LC3和Beclin1下调,Akt/mTOR通路激活,自噬减少;姜黄素治疗后,LC3和Beclin1上调,Akt/mTOR通路抑制,自噬增加,且我们在姜黄素联合尼古丁处理的软骨原代细胞中验证了姜黄素调节软骨自噬作用依赖于Akt/mTOR通路。
综上所述,我们的研究结果表明,姜黄素通过Akt/mTOR信号通路诱导自噬,在OA大鼠中发挥了治疗作用。在此次研究中尚有不足:第一,不同浓度的姜黄素对大鼠软骨组织修复有何影响路还未阐明,在今后的研究中将通过不同浓度、不同治疗时间的姜黄素处理以明确此问题;第二,仍需要进一步细胞实验支持此次研究的发现,更加明确姜黄素对细胞自噬的潜在作用。
