低氧低温对大鼠骨骼肌细胞脂代谢关键酶及解耦联蛋白1的影响#
2021-12-29刘川川张瑞霞
关 璐,刘川川,张瑞霞*
(1.青海大学研究生院,青海 西宁 810016;2.青海大学附属医院,青海 西宁 810001;3.青海大学高原医学研究中心,青海 西宁 810001)
目前学者们多关注平原状态下的骨骼肌的糖代谢,对高原脂代谢的研究并不多见且研究结论不一。因此,本研究拟通过对高原低氧低温条件下骨骼肌细胞内脂代谢关键酶HSL和CPT1A及棕色脂肪线粒体内产热基因UCP1的表达水平的研究,观察低氧低温对大鼠骨骼肌细胞脂代谢关键酶及解耦联蛋白1的影响。
1.材料与方法
1.1 材料及动物
胰蛋白酶、DMEM、离心管购于西格玛生物公司;SABC免疫组化染色试剂盒购于博士德生物公司;油红O染色试剂盒购于索莱宝公司。RNA提取试剂盒、BCA蛋白定量试剂盒购于赛默飞世尔科技公司;cDNA反转录试剂盒、PCR反应试剂盒购于天根生物公司;抗体购于爱博泰克公司。
大鼠购于上海杰思捷实验动物有限公司,体重约140~160g,动物合格证号:20180004012817。
1.2 方法
1.2.1 骨骼肌细胞的分离与培养方法
腹腔注射1.5%戊巴比妥钠(0.2mL/100g),麻醉后脱颈处死大鼠,浸泡于含75%酒精的容器内,充分消毒后于超净工作台分离骨骼肌。取1 cm3腓肠肌剪碎至1 mm3,用PBS洗涤后离心,去除上清后加2 mL 0.1%Ⅱ型胶原酶消化(37.0℃,20min),期间吹打混匀,重悬细胞并接种在25 cm2的培养瓶中,细胞约2 h贴壁,镜下观察细胞形态。
1.2.2 骨骼肌细胞的鉴定方法

1.2.3 细胞分组方法
随机分为对照组(nature group,N。氧浓度:21%。37℃)、低氧组(hypoxia group,HO。氧浓度:1%。37℃)、低温组(hypothermia group,HT。氧浓度:21%。28℃)、低氧低温组(hypoxia and hypothermia group,HOHT。氧浓度:1%。28℃)。
1.2.4 RNA分离、逆转录PCR和RT-qPCR方法
用TRIZOL法分离和提取细胞总RNA,在分光光度计上测定总RNA的浓度和纯度,在1%琼脂糖凝胶上进行RNA电泳,通过观察28S RNA及18S RNA以评估RNA的完整性。根据说明将800 ng总RNA逆转录为cDNA。特异性扩增引物(表1)由上海生工生物公司合成。配制20 μL的RT-qPCR反应液:2×SuperReal Color PreMix 10 μL,正、反向引物各0.6 μL,cDNA模板2 μL,50×ROX Reference Dye 0.4 μL,RNase-free ddH2O 6.4 μL。在ABI Q5序列检测系统上进行两步法扩增:预变性95 ℃,15 min;变性95 ℃,10 s;退火及延伸60 ℃,32 s。共40个循环,以2-△△CT法对mRNA进行相对定量。

表1 RPS18与目的基因的特异性引物序列
1.2.5 Western-Blot方法

1.2.6 统计学方法
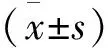
2.结果
2.1 骨骼肌细胞形态
以酶消化法分离骨骼肌细胞,图为已贴壁的梭形骨骼肌细胞(图1)。

图1 骨骼肌细胞镜下图(20×)
2.2 骨骼肌细胞的鉴定结果
以SABC免疫组化法鉴定骨骼肌细胞(ACTA1蛋白在骨骼肌细胞阳性表达)(图2)。
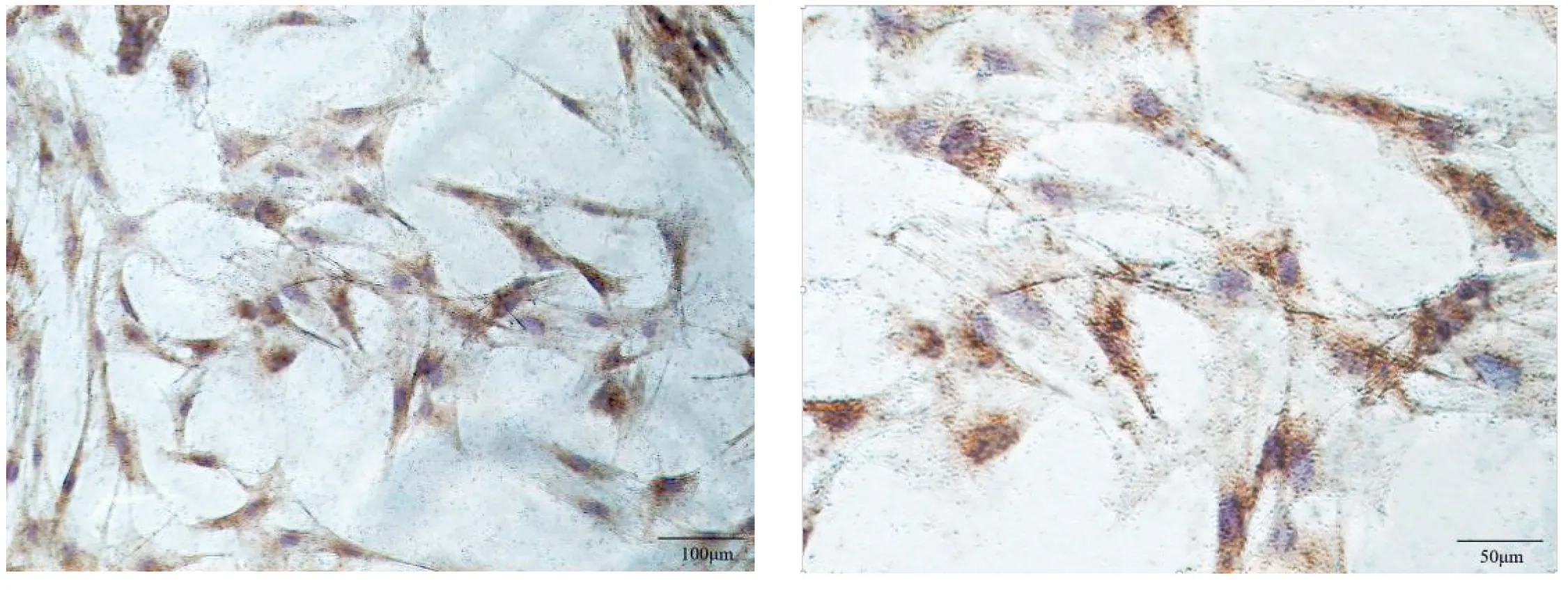
图2 免疫组化法测定ACTA1蛋白图
2.3 HSL、CPT1A、UCP1 mRNA表达差异
为研究低氧低温对骨骼肌细胞脂代谢相关基因表达的影响,采用RT-qPCR法检测HSL、CPT1A、UCP1 mRNA表达水平。与对照组、低氧组、低温组比,低氧低温组HSL mRNA表达增多(P<0.05)。与低温组比,低氧低温组CPT1A mRNA表达减少(P<0.05)。与对照组和低氧组比,低氧低温组UCP1 mRNA表达增多(P<0.05)。
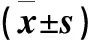
表2 各组目的基因mRNA表达水平
2.4 HSL、CPT1A、UCP1蛋白表达差异
为进一步详细研究低氧低温对骨骼肌细胞脂代谢相关蛋白表达的影响,采用Western-Blot法检测HSL、CPT1A、UCP1蛋白表达水平(图3)。与前三组比,低氧低温组HSL蛋白表达水平升高(P<0.05)。与对照组、低氧组比,低氧低温组CPT1A表达水平降低(P<0.05),与低温组比,表达水平升高(P<0.05)。与对照组比,三组UCP1蛋白表达均减少(P<0.05)(表3)。
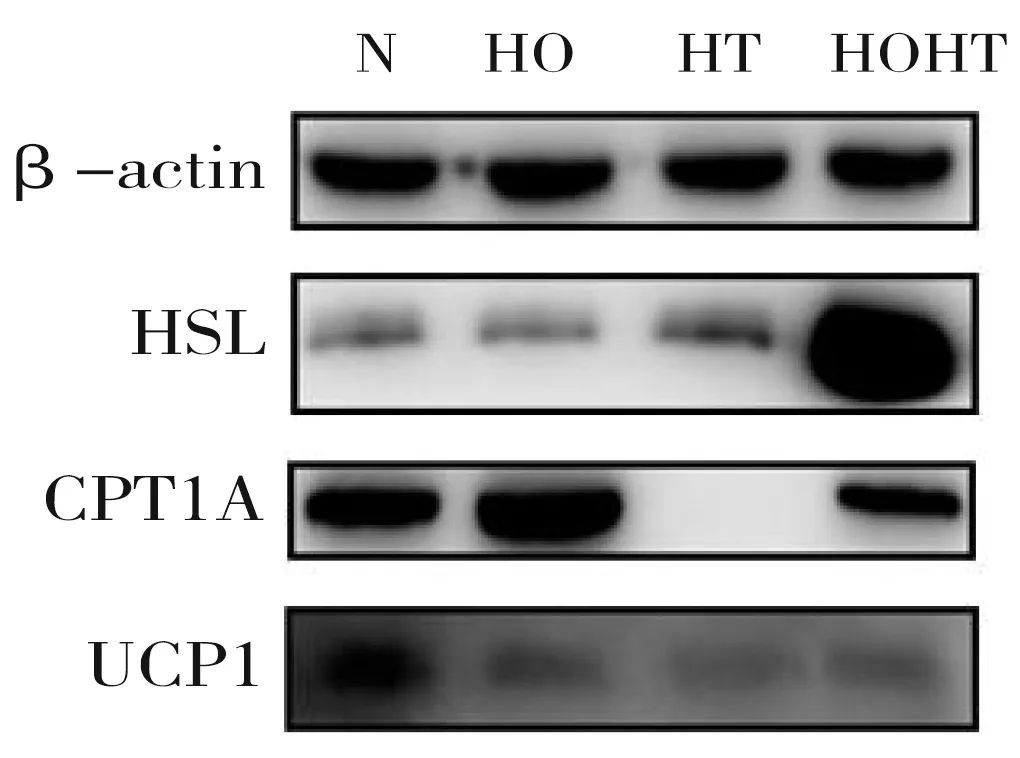
图3 Western-Blot法检测各目的蛋白表达水平图
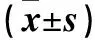
表3 各组目的蛋白表达水平
3.讨论
对急进高原人群来说,机体能量代谢不同于平原地区。在这个过程中糖利用率降低,脂肪利用率升高,血液中游离脂肪酸和甘油含量增多,提示高原习服过程中脂肪分解占优势[1]。有学者发现,高原地区人群棕色脂肪组织多于汉族人群[2]。高原地区糖脂代谢是近年来的研究热点,骨骼肌的能量代谢逐渐被关注。低氧低温条件下骨骼肌细胞内脂代谢关键酶的改变情况未知。我们通过在低氧低温环境下培养骨骼细胞,检测脂代谢关键酶HSL、CPT1A及UCP1的表达情况,发现低氧低温双重因素对骨骼肌细胞脂代谢水平有一定的影响,低氧低温促进脂代谢关键酶HSL mRNA及蛋白表达,抑制CPT1A mRNA及蛋白表达,低氧低温促进骨骼肌细胞UCP1 mRNA表达,抑制骨骼肌细胞UCP1蛋白表达。
我们发现,低氧低温双重因素促进HSL mRNA及蛋白表达。HSL的C端有一个含200个氨基酸的调节区[3],该区是PKA的主要靶点。缺氧时cAMP/PKA信号通路被激活,进而激活HSL,使其表达升高[4]。低氧间接激活糖酵解途径产生大量的丙酮酸,丙酮酸进入线粒体通过三羧酸循环产生大量ATP,为脂肪分解供能,促进HSL合成,这与我们的研究一致。低温环境还可直接刺激脂肪分解,诱导HSL产生,加速脂肪动员,使甘油三酯分解为甘油与游离脂肪酸[5],从而促进脂肪酸β氧化而产生ATP,刺激了骨骼肌细胞的生长代谢。寒冷条件下促进HSL磷酸化,其磷酸化水平越高,脂肪分解速率越高[6],被激活的HSL水解甘油三脂的酯键产生游离脂肪酸,而游离脂肪酸是激活棕色脂肪组织内UCP1的燃料[6,7]。对于哺乳动物,缺氧及低温均可激活cAMP/PKA/HSL途径,促进HSL的合成及活化以增加能量消耗,这也是维持体重、避免肥胖的原因[7]。
与低温组比,低氧低温组CPT1A mRNA表达减少,提示骨骼肌细胞内CPT1A的减少主要受低氧诱导因子(HIF)的诱导。而低温组CPT1A表达减少的原因可能是,基因到蛋白水平存在着复杂的转录后修饰及翻译等过程,CPT1A合成减少可缓解线粒体因脂质过多导致的损伤和氧化应激[8,9]。低氧环境促进CPT1A的表达,在肝细胞内,CPT1A的转录上调利于线粒体内脂肪酸的摄取及氧化[8,10],研究发现,低氧环境促进哺乳动物体内HIF的合成,HIF通过诱导CPT1A启动子转录沉默而抑制CPT1A的产生[11],从而减少脂肪酸向线粒体的转运,使得脂肪酸以脂滴的形式储存,利于高海拔地区人群御冷[12]。骨骼肌细胞内的变化也是如此,与低温组比,低氧低温组CPT1A mRNA合成减少,推测这种情况下细胞内糖酵解占主要地位,糖酵解过程的加强促进乳酸合成,导致ATP生成减少、 CPT1A合成抑制,使脂肪酸的β氧化被进一步抑制。在蛋白水平,与对照组比,低氧低温组CPT1A合成明显减少,提示低氧低温双重因素会抑制CPT1A合成。低温促进CPT1A mRNA合成,而敲除CPT1A基因后,脂质积累面积增大[11]。
多数学者认为冷暴露诱导棕色脂肪中UCP1 mRNA的合成[13],与我们的结果一致。而与低氧组比,低氧低温组UCP1 mRNA合成减少,提示低温环境抑制UCP1合成,这可能是由于UCP1是棕色脂肪组织特异基因,在骨骼肌内该基因的表达不一定增多,也可能是低温可激活HIF通路使CPT1A沉默,影响了脂肪酸氧化而抑制线粒体内UCP1的表达[11]。低氧促进AMPK的表达[14],AMPK/PGC-1α信号通路也参与调控骨骼肌脂肪酸氧化代谢,PGC-1α与PPARα、PPARγ、ERRα等结合促进UCP1的表达,进一步促进脂肪分解[15],这与Du W等[11]的研究不一致,即低氧时HIF通过诱导转录抑制物的产生而抑制PGC-1α的合成,PGC-1α进一步抑制UCP1的合成,这是实验组UCP1蛋白表达减少的原因。
综上所述,低氧低温对骨骼肌细胞的脂代谢水平有一定的影响,低氧低温促进脂代谢关键酶HSL mRNA及蛋白表达,抑制CPT1A mRNA及蛋白表达,低氧低温促进骨骼肌细胞UCP1 mRNA表达,抑制骨骼肌细胞UCP1蛋白表达,这可能是高海拔地区肥胖患病率、非酒精性脂肪肝患病率低于平原的原因[16]。
