基于分子对接对唐古红景天中抑制精氨酸酶活性成分的研究※
2021-12-29华玉美多苏姗姗南星梅杨占婷芦殿香李占强
王 珊,华玉美多,苏姗姗,南星梅,杨占婷,芦殿香,李占强*
[1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学高原医学研究中心,高原医学教育部重点实验室,青海省高原医学应用基础重点实验室(青海-犹他高原医学联合重点实验室),青海 西宁 810001;3.西宁海关技术中心,青海省食品安全研究重点实验室,青海 西宁 810003;4.青海大学医学院药学系,青海 西宁 810001]
精氨酸酶(Arginase,Arg)通过与一氧化氮合酶竞争底物L-精氨酸来调节NO的生物利用度,Arg活性的增加和NO生物利用度的降低会引起内皮功能障碍及其并发症的发生[1,2]。因此,认为Arg是治疗内皮功能障碍性疾病的潜在靶点。课题组前期研究发现,唐古红景天活性部位能够通过调节NO水平而发挥血管舒张活性,并能够显著干预低氧性肺动脉高压的形成[3,4]。基于此,本研究以精氨酸酶与唐古红景天中部分化学成分的分子对接结果为基础,虚拟筛选出抑制精氨酸酶的活性成分。并测定其中没食子酸对精氨酸酶的IC50、Ki、Ki′值,确定其对精氨酸酶的抑制活性及酶动力学反应类型。
1.材料与方法
1.1 主要材料与仪器
精氨酸酶(批号:M20A11Y120133,规格:BR,100μ/mg)购于上海源叶生物科技有限公司,没食子酸(批号:J1120A)购于大连美仑生物技术有限公司),尿素(Lot#:C11167159)、L-精氨酸(Lot#:C10882613)、2-异亚硝基苯丙酮(Lot#:C10239530)、氯化锰(Lot#:C11446505)均购于上海麦克林生化科技有限公司,1M Tris·HCl(产品编号:ST776-100mL)购于碧云天生物技术研究所。全自动酶标仪分析系统(Infinite 200 Pro)购于Tecan公司。
1.2 分子对接方法
1.2.1 结构准备
从PDB数据库(www.pdb.org)获得精氨酸酶蛋白晶体结构(PDB编码:3KV2)。配体分子三维结构从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得,共获取唐古红景天中11个单体化合物的3D结构,包括没食子酸、络塞、大花红天素、酪醇、表儿茶素没食子酸酯、槲皮苷、异槲皮苷、表儿茶素、阿魏酸、咖啡酸和木犀草素。
1.2.2 分子对接操作
受体蛋白的处理:使用PyMOL软件去除蛋白结构中自带的小分子结构;使用AutoDockTools软件给蛋白分子进行加氢处理;计算电荷并进行能量优化,保存为PDBQT格式。小分子的处理:利用AutoDockTools软件给配体分子进行加氢、加电荷处理;判定配体分子的Root,选择配体分子中可扭转的键,并保存为PDBQT格式。
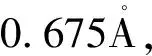
1.3 精氨酸酶抑制活性
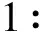
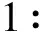
1.4 精氨酸酶抑制动力学
对酶动力学进行评估时,分别设置25、50、100 mM三种L-精氨酸底物浓度,25、50、100、200 μM四种没食子酸终浓度,进行如1.3所述的精氨酸酶抑制活性测定实验。动力学模型(米氏模型)用GraphPad Prism 7.0软件进行拟合,并绘制Lineweaver-Burk图。将Lineweaver-Burk图中不同直线的斜率与没食子酸浓度进行线性回归,获得没食子酸与精氨酸酶的抑制常数Ki,将Lineweaver-Burk图中不同直线与纵轴的截距同没食子酸浓度进行线性回归,获得没食子酸与“精氨酸酶-精氨酸”复合物的抑制常数Ki′。
2.结果
2.1 分子对接
使用分子对接法分析唐古红景天中11个主要化学成分与精氨酸酶蛋白3KV2的结合力,并对获得的各化学成分结合能量最低的构象进行分析。对接结果如表1所示,结合自由能低于-5.0 kcal/mol的化学成分有没食子酸、木犀草素、表儿茶素、咖啡酸、槲皮苷、阿魏酸、络塞,分别为-5.80、-5.75、-5.73、-5.53、-5.36、-5.29、-5.14 kcal/mol。
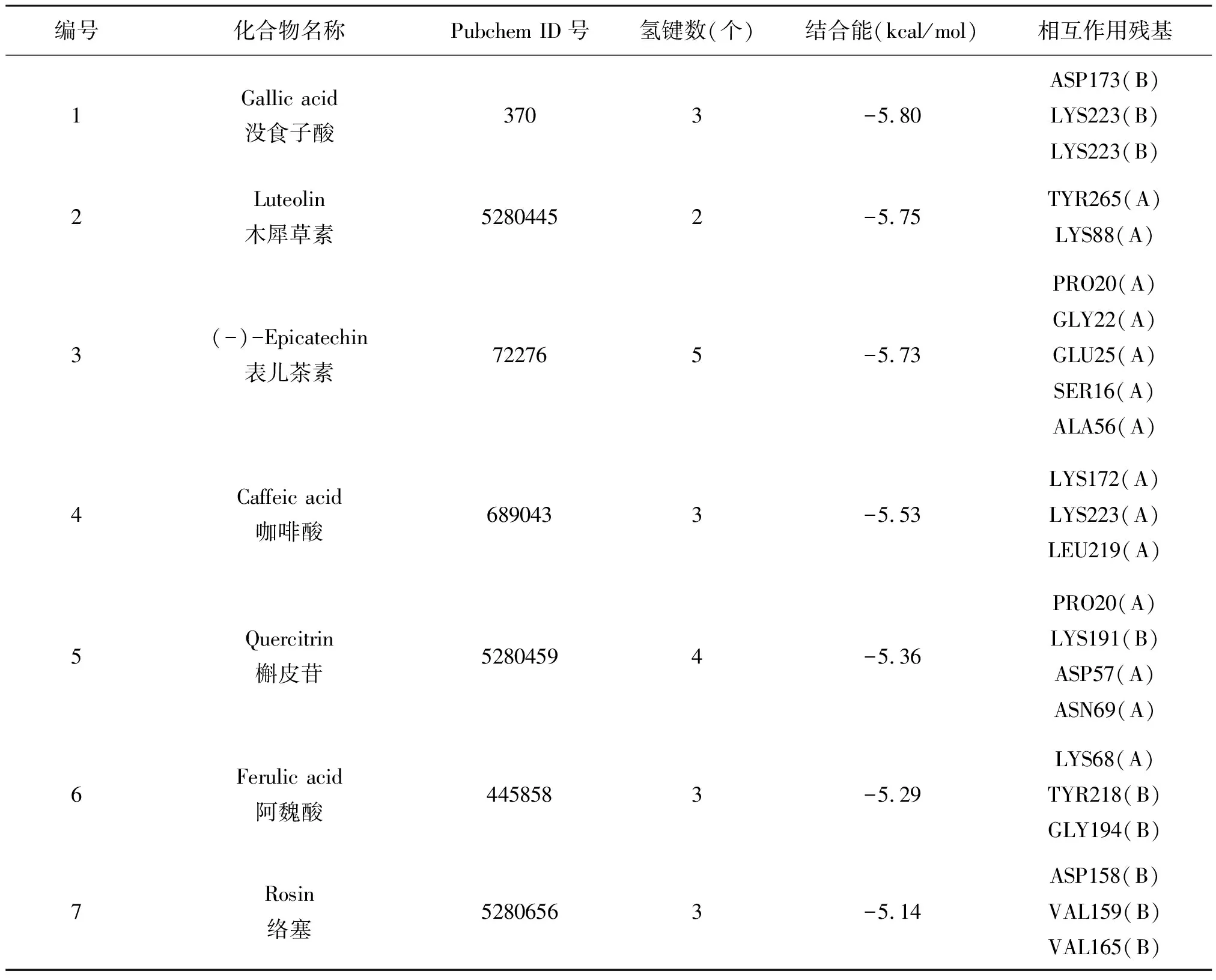
表1 唐古红景天主要化学成分与精氨酸酶靶点的分子对接评价表

续表:
用Discovery Studio Visualizer 2017软件进一步分析靶蛋白与配体的相互作用及结合模式,结果如图1所示。图1A~G中,左图为三维结合模式图,右图为二维结合模式图。其中具有最小结合自由能的没食子酸,通过酚羟基和羧基与精氨酸酶ASP173、LYS223相互作用形成3个氢键(图1A);木犀草素可通过酚羟基和羰基与精氨酸酶TYR265、LYS88相互作用形成2个氢键(图1B);表儿茶素可通过酚羟基和醇羟基与精氨酸酶PRO20、GLY22、GLU25、SER16、ALA56相互作用形成5个氢键(图1C);咖啡酸通过酚羟基和羧基与精氨酸酶LYS172、LYS223、LEU219相互作用形成3个氢键(图1D);槲皮苷通过酚羟基和糖基与精氨酸酶PRO20、LYS191、ASP57、ASN69相互作用形成4个氢键(图1E);阿魏酸通过羧基与精氨酸酶LYS68、TYR218、GLY194相互作用形成3个氢键(图1F);络塞通过糖基与精氨酸酶ASP158、VAL159、VAL165相互作用形成3个氢键(图1G)。此外,酪醇、表儿茶素没食子酸酯、异槲皮苷和大花红天素也能够与精氨酸酶残基相互作用形成氢键,但其结合自由能高于-5.0 kcal/mol。因此,进一步对结合自由能最小的没食子酸测定了其对精氨酸酶的IC50、Ki、Ki′及酶动力学反应类型。

图1 化学成分与精氨酸酶靶蛋白3KV2的3D与2D结合模式图
2.2 没食子酸抑制精氨酸酶活性测定
尿素浓度分别为0.1、0.2、0.4、0.8、1.2 mg/mL时,以尿素溶液浓度为横坐标,显色后550 nm处的吸光度为纵坐标,获得尿素标准曲线方程[Y=0.718X+0.0371(R2=0.997)]。
当没食子酸终浓度分别为12.5、25、50、100、200 μM时,其精氨酸酶抑制率分别为26.11±1.01%、29.62±2.14%、36.04±2.30%、43.07±2.62%、60.44±2.61%,确定其IC50为124.3 μM。以终浓度为横坐标、精氨酸酶抑制率为纵坐标获得没食子酸量效曲线图(图2A)。

图2 没食子酸对精氨酸酶的浓度-反应曲线
2.3 精氨酸酶抑制动力学测定
以底物浓度的倒数为横坐标,反应速率的倒数为纵坐标,获得Lineweaver-Burk曲线图(图2B),结果显示,随着没食子酸浓度的升高,最大反应速率Vm值在减小,米氏常数Km值在增大,各直线在第二象限相交(逆时针方向)。以没食子酸浓度为横坐标,由Lineweaver-Burk图中不同直线的斜率为纵坐标进行线性回归(图2C),获得抑制常数Ki为106.70 μM,由Lineweaver-Burk图与纵轴的截距为纵坐标进行线性回归(图2D),获得抑制常数Ki′为193.61 μM,抑制常数Ki′/Ki=1.81,表明没食子酸对精氨酸酶具有混合竞争性抑制作用。
3.讨论
精氨酸酶是由Kossel和Dakin于1904年在哺乳动物肝脏样本中首次描述的一种金属酶[6],与一氧化氮合酶拥有共同的底物L-精氨酸。精氨酸酶引起的L-精氨酸水平降低可限制NOS产生NO的水平[7],这与内皮依赖性血管舒张功能的损伤密切相关[8]。此外精氨酸酶产物L-鸟氨酸的增加与血管平滑肌细胞增生和血管纤维化也密切相关[9,10]。有关精氨酸酶的现有数据表明[11],精氨酸酶过度激活是内皮功能障碍发生的关键因素,是多种心血管疾病和与血管功能障碍相关的代谢和炎症性疾病的潜在致病因素。
精氨酸酶的表达和活性升高与肺动脉高压(Pulmonary Hypertension,PH)关系密切,其中PH与Arg2的表达增加有关[12-14]。同样,NO水平的降低与精氨酸酶表达/活性的增加有关[15]。Kao等[16]利用放射性同位素研究发现,精氨酸酶活性高的PH患者表现出NO水平显著下降,而且不能通过增加L-精氨酸来弥补。内皮功能障碍的主要特征是内皮依赖性血管舒张功能受损,特别是在氧化应激和(或)炎症增强的情况下,血管扩张剂NO的生物利用度降低[17]。此外,Watts等[18]在实验性肺栓塞模型中发现,Arg2的增加制约肺内皮依赖性血管扩张。而经精氨酸酶抑制剂的治疗可以提高NO水平,从而降低肺阻力并减轻低氧诱导的肺动脉高压症状[19,20]。因此Arg和eNOS之间存在的双向关系可能在肺动脉高压等血管性疾病中发挥重要作用[21],抑制精氨酸酶活性已成为治疗肺动脉高压等疾病的治疗策略。
因此,寻找能够有效抑制精氨酸酶活性的天然化合物将成为治疗和预防血管性疾病的新策略[22-23]。李更兄等[3]在离体的肺血管环中,筛选获得了唐古红景天舒张血管的活性部位,并确定其内皮依赖性的舒血管机制。南星梅等[4]进一步对该活性部位进行了体内药效学评价,发现其能够干预低氧性肺动脉高压的形成及肺血管的重构,并明确了唐古红景天舒张血管活性部位的主要化学成分[24]。基于上述研究成果,我们对唐古红景天主要化学成分是否具有精氨酸酶抑制活性进行了研究。本研究运用分子对接方法,对唐古红景天活性部位与精氨酸酶的相互作用进行了研究,并对结合自由能最低的没食子酸进行了精氨酸酶抑制活性研究,确定其对精氨酸酶的IC50。根据 Lineweaver-Burk图模型可得到Ki与Ki′值[25,26],其中Ki和Ki′分别是抑制剂与酶和“酶-底物”复合物结合的抑制常数。对于非竞争性抑制剂,其Ki=Ki′;对于竞争性抑制剂,其Ki′/Ki→∞;对于混合竞争性抑制剂,其Ki′/Ki≠1[23]。本研究中没食子酸对精氨酸酶的抑制常数Ki和Ki′分别为106.70、193.61 μM(Ki′/Ki=1.81),因此判定没食子酸是精氨酸酶的混合竞争性抑制剂,显示它与底物L-精氨酸、精氨酸酶形成了“酶-底物-抑制剂”三元复合物。De Oliveira等[27]证实没食子酸具有内皮依赖性的血管扩张作用,并显示了由内皮介导的发生机制。本研究进一步确定了没食子酸对精氨酸酶的抑制机制。
综上所述,本研究以精氨酸酶为靶点,利用分子对接技术从唐古红景天活性部位的11个化学成分中虚拟筛选出结合能最低的没食子酸,并确定了没食子酸对精氨酸酶的IC50及混合竞争性的抑制机制。
