红脊长蝽感觉神经元膜蛋白基因克隆及组织表达谱分析
2021-12-29宋月芹白小军陈庆霄吕琪卉孙会忠
宋月芹,白小军,陈庆霄,吕琪卉,孙会忠*
(1.河南科技大学林学院,河南 洛阳 471000;2.宜阳县林业技术指导站,河南 洛阳 471600)
昆虫的化学感受系统在其生存和繁殖过程中起着极其重要的作用[1-3]。在过去10 多年的时间里,研究者对昆虫触角嗅觉信号传导的分子机制研究有了突出的进步。在昆虫嗅觉识别时,气味分子从触角感器孔渗入,然后被气味结合蛋白(odorant binding proteins,OBPs)或化学感受蛋白(chemosensory proteins,CSPs)识别和转移,最后激活位于嗅觉感觉神经元(olfactory sensory neurons,OSNs)树突膜上的嗅觉受体(odorant receptors,ORs)或离子型受体(ionotropic receptors,IRs),产生电位,指导昆虫做出相应的行为反应[4-8]。此外,还有一些蛋白如感觉神经元膜蛋白(sensory neuron membrane proteins,SNMPs)在昆虫气味识别过程中也扮演着至关重要的作用[5]。
昆虫SNMPs 也是一种膜蛋白,与脊椎动物CD36 家族为同源基因,具有2 个跨膜区域,其功能主要是识别和转运亲脂性气味分子如脂肪酸和脂类化合物等[9-14]。昆虫第一个SNMP 基因在多音天蚕(Antheraea polyphemusCramer)中被鉴定,并命名为ApolSNMP1[9]。随后在烟草天蛾(Manduca sextaL.)中发现SNMP 的第二个亚类型,即命名为MsexSNMP2[10,15]。紧接着SNMP 的同源基因在鳞翅目Lepidoptera[10,15-16]、双翅目Diptera[17]、鞘翅目Coleoptera[18]、直翅目Orthoptera[13]和膜翅目Hymenoptera[19]等昆虫中都有发现。一直以来被认为SNMP 基因家族就2 个成员,即SNMP1 和SNMP2。最近昆虫SNMP 家族的第三个成员SNMP3 在鳞翅目中被鉴定[20-21],但认为该基因的主要功能与昆虫的免疫反应有关,这还需要进一步的去证明。
红脊长蝽(Tropidothorax elegansDistant)属半翅目(Hemiptera)长蝽科(Lygaeidae),主要为害刺槐(Robinia pseudoacaciaL.)、辣椒(Capsicum annuumL.)、葫芦(Lagenaria sicerariaMolina)、油菜(Brassica napusL.)、大白菜(Brassica pekinensisLour.)和小麦(Triticum aestivumL.)等多种植物,食性较杂。关于红脊长蝽的嗅觉基因研究较少,本研究通过前期红脊长蝽触角转录组测序结果[22],鉴定了红脊长蝽的2 个SNMP 基因,即TeleSNMP1和TeleSNMP2,并通过荧光定量PCR 技术对红脊长蝽TeleSNMP1和TeleSNMP2在不同组织中的表达情况进行分析,为进一步探索红脊长蝽SNMPs 的化学通讯功能奠定基础。
1 材料与方法
1.1 试虫的准备
红脊长蝽来自河南科技大学林学院昆虫实验室,该群体为自2014 年7 月在洛阳周边(112˚26′ E,34˚43′ N)蔬菜地采集的成虫,然后在温室内继代饲养至今。温室条件为:温度25 ± 2℃,相对湿度60% ± 5%,光周期14L∶10D。
1.2 总RNA 的提取与第一链cDNA 的合成
选取红脊长蝽羽化后第3 d 的雌雄成虫,收集触角各100 头、头部各30 头、胸部各20 头、腹部各5 头、足各50 头、翅各50 头,每个样品收集材料重复3 次。将红脊长蝽各部分组织解剖后立即放入浸在液氮中的1.5 mL 离心管内,然后保存于−80℃中。
总RNA 的提取采用RNAiso Plus Kit(TaKaRa,北京)试剂盒进行,并使用RNase-free DNase I(TaKaRa,北京)对提取的RNA 进行除DNA 处理。采用1%的琼脂糖凝胶电泳和NanoDrop 2000c 分光光度计(Thermo Scientific)进行质量检测。采 用PrimeScript™ 1st Strand cDNA Synthesis Kit(TaKaRa,北京)试剂盒对RNA 进行反转录。
1.3 红脊长蝽SNMPs 基因的克隆
从本实验室前期对红脊长蝽触角转录组测序注释结果中[21]搜素到2 个SNMP 基因。根据该序列设计特异性引物,TeleSNMP1-F:5′-ATGGCTG CACCACTGAGG-3′,TeleSNMP1-R:5′-CTAGTA CTTTGCCGGGGGTG-3′;TeleSNMP2-F:5′-ATG ACGAAGGTGCTGTTCCC-3′,TeleSNMP2-R:5′-T TAGCTTGTGAGAGTCCTTTTGA-3′,进行PCR 扩增。PCR 反应体系为20 μL:雌蛾触角cDNA 模板1 μL,上下游引物各1.5 μL(10 μmol·L−1),dNTPs混合液1.6 μL(2.5 μmol·L−1),Ex Taq DNA 聚合酶0.2 μL(TaKaRa,大连),10×Ex Taq buffer 2 μL,ddH2O 为12.2 μL。PCR 反应条件为:94℃5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,35 个循环;最后72℃ 10 min。胶回收目的片段,将目的片段克隆到pMDTM19-T 载体上,转化DH5α 感受态细胞,挑取阳性克隆培养过夜,送去测序。
1.4 红脊长蝽SNMPs 基因的序列分析
核酸序列采用在线工具(http://www.bio-soft.net/sms/)翻译;采用(http://www.cbs.dtu.dk/services/TMHMM)在线工具进行跨膜区域预测;利用在线工具(https://web.expasy.org/protparam/)对蛋白序列特性进行分析;蛋白亲疏水性采用在线工具(https://web.expasy.org/protscale/)分析;序列比对采用线下DNAMAN 进行多重序列比较;进化树采用线下MEGA 6.0 构建。
1.5 实时定量PCR
通过荧光定量PCR 检测红脊长蝽SNMPs 基因在不同组织中的表达情况。根据红脊长蝽SNMPs基因的开放阅读框和荧光定量引物设计原则设计特异性引物,TeleSNMP1-F:TCACCATCCCTCATC CA,TeleSNMP1-R:TCTTCGCCGTCTTTCAT,Tele SNMP2-F:TGTGGGAACGGAACTCT,TeleSNMP2-R:GCACCTTGGCACTTTG。内参基因为红脊长蝽Actin 基因(基因登陆号为MG322127),引物为:TeleActin-F:CAAGGACGAAACAATCA;TeleActin-R:GAGAATACACTCCCAGAAC。
荧光定量PCR被执行在ABI 7500 PCR 仪(ABI,Carlsbad,CA,USA)上进行,每个反应体积20 μL,包括10 μL 的2×SYBR Green PCR Master Mix(TaKaRa,大连)、0.8 μL 的正反向引物(10 μmol·L−1)、2 μL 的cDNA 模板(200 ng)和6.4 μL 的DEPC 水。PCR 循环遵循95℃ 30 s,然后95℃ 5 s,53℃ 31 s,共循环40 个周期。试验重复3 次。
1.6 数据分析
红脊长蝽SNMPs 基因在不同组织中的相对表达量采用公式2−∆∆CT[23]计算。利用SPSS 17.0 软件中的ANOVA 方法对TeleSNMPs 在红脊长蝽不同组织中的表达量进行显著性差异比较(新复极差法检验,P≤ 0.05)。
2 结果与分析
2.1 红脊长蝽SNMPs 基因克隆及序列分析
将测序结果在NCBI 上进行同源性搜索,结果表明所测序列与多种昆虫的SNMP 基因序列高度同源,证明这2 个基因就是红脊长蝽的SNMP 基因,并分别命名为TeleSNMP1和TeleSNMP2,在NCBI基因登陆号分别为MW442946 和MW442947。
这2 个SNMPs 基因都具有全长的开放阅读框,TeleSNMP1长度为1 497 bp,编码498 个氨基酸(图1);而TeleSNMP2长度为1 686 bp,编码561 个氨基酸。这2 个基因都是酸性,TeleSNMP1的等电点是8.26,蛋白分子量是55.59 kD;TeleSNMP2的等电点是7.05,蛋白分子量是63.37 kD。
TeleSNMP1和TeleSNMP2在氨基酸序列的N-端和C-端各有一个跨膜区域,其中TeleSNMP2在氨基酸第158 和180 之间还有一个跨膜区域。在膜外区域6 个保守的半胱氨酸残基位点被预测(图1),这6 个保守的半胱氨酸位点与CD36 基因家族相似。

图1 红脊长蝽TeleSNMP1 和TeleSNMP2 与其他昆虫SNMPs 的序列比对Fig.1 Alignment of Tropidothorax elegans SNMP1 and SNMP2 with SNMPs from other insects
2.2 红脊长蝽SNMPs 与其他昆虫SNMP 基因的同源性及进化树分析
将红脊长蝽TeleSNMP 基因与已报道的其他昆虫SNMP 基因的氨基酸序列在NCBI 中的Blastp在线搜索工具进行同源性分析,发现TeleSNMP 基因与不同种类昆虫SNMP 基因一致性差别较大。与同目昆虫SNMP 基因一致性较高,如TeleSNMP1与茶翅蝽 (Halyomorpha halysStal)HhalSNMP1序列一致性在81.33%;与苜蓿盲蝽 (Adelphocoris lineolatusGoeze)AlinSNMP1序列一致性在68.54%;与不同目昆虫SNMP 基因一致性较低,如TeleSNMP1与斑痣悬茧蜂 (Meteorus pulchricornisWesmael)MpulSNMP1序列一致性在43.44%。但TeleSNMP2与所有昆虫SNMP 基因一致性都不高,如与茶翅蝽HhalSNMP2序列一致性在48.68%;与苜蓿盲蝽AlinSNMP2序列一致性在41.18%;与德国小蠊 (Blattella germanicaLinnaeus)BgerSNMP1序列一致性在46.22%。TeleSNMP2与玉带凤蝶 (Papilio polytesL.)PpolSNMP2序列一致性在30.94%;与亚洲小车蝗 (Oedaleus asiaticusBei-Bienko)OasiSNMP2序列一致性在34.76%。红脊长蝽TeleSNMP1和TeleSNMP2之间序列一致性仅有29.66%。
使用MEGA6.0 对9 个目的36 种昆虫SNMP同源基因进行进化树比较。SNMPs 基因被分成2 个亚组,即SNMP1 和SNMP2(图2),每亚组中同目昆虫SNMP 基因同源性最高。红脊长蝽的TeleSNMP1和TeleSNMP2基因分别被集聚到这2 个亚组,并且与同为半翅目昆虫的苜蓿盲蝽、茶翅蝽和黑肩绿盲蝽SNMP 基因进化关系最近,与其他目昆虫SNMP 关系较远。
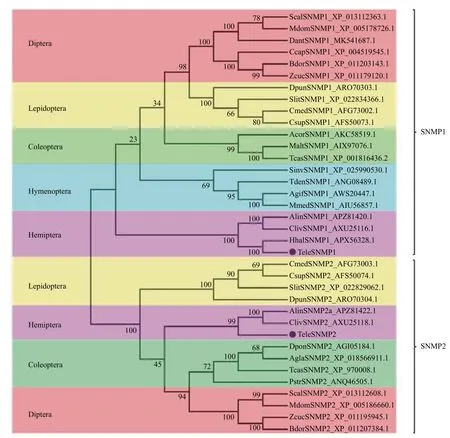
图2 红脊长蝽SNMPs 与其他昆虫SNMPs 氨基酸序列的系统进化树Fig.2 Phylogenetic tree of the SNMPs of Tropidothorax elegans and other insects based on amino acid sequences by using neighbor-joining method
2.3 红脊长蝽SNMPs 基因表达谱分析
使用荧光定量PCR 对红脊长蝽TeleSNMP1和TeleSNMP2在不同组织中的表达情况进行分析,结果发现:TeleSNMP1和TeleSNMP2在雌雄蛾触角中高度表达,TeleSNMP1在雄蛾触角中的表达量明显高于雌蛾,TeleSNMP2的表达情况刚好相反,即TeleSNMP2在雌蛾触角中的表达量明显高于雄蛾。除触角外,TeleSNMP1几乎不在其他组织中表达或表达量甚微。TeleSNMP2除在触角中表达量丰富外,在足和翅中也有少量表达(图3)。
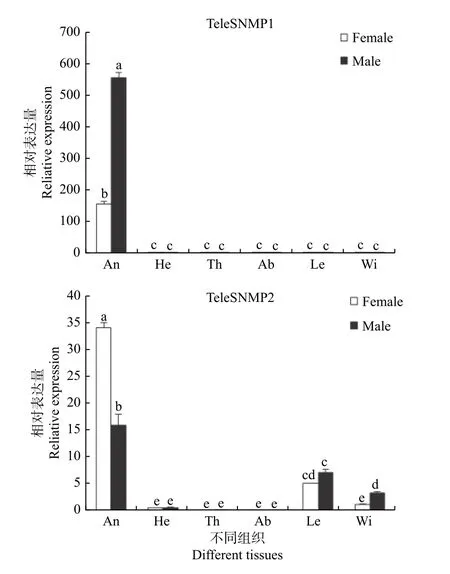
图3 红脊长蝽SNMPs 在不同组织中的相对表达量Fig.3 Expression level of SNMPs in different tissues of Tropidothorax elegans
3 讨论
本研究根据前期红脊长蝽触角转录组的数据,通过BLASTX 在线搜索和同源性比较鉴定出2 个SNMPs 基因,即TeleSNMP1和TeleSNMP2。这2 个基因与其他昆虫SNMPs 具有类似的特征,如在氨基酸序列N 端和C 端附近有2 个保守的跨膜区域,并且由6 个保守的半胱氨酸残基形成二硫键组成一个大的胞外环,此结构也与CD36 基因家族极其相似[24-26]。根据对这2 个跨膜蛋白结构投影预测,这部分的功能是转运和结合脂类分子[27-28],我们可推测红脊长蝽SNMPs 的2 个跨膜区具有同样的功能。但红脊长蝽TeleSNMP2在氨基酸序列第158 和180 之间多了1 个跨膜区域,目前关于SNMPs 基因具有3 个跨膜区域的报道还没有,可能是鉴定的SNMPs 数量还不够庞大,也可能长期进化形成的。
红脊长蝽TeleSNMP 基因同源性搜索发现TeleSNMP 基因与不同种类昆虫SNMP 基因一致性差别较大。与同目昆虫SNMP 基因一致性较高,与不同目昆虫SNMP 基因一致性较低。红脊长蝽TeleSNMP1和TeleSNMP2之间分歧也比较大。进化树结果也显示,红脊长蝽TeleSNMP1和TeleSNMP2分别被集聚到SNMP1 和SNMP2 两个亚组,在同一组内同目昆虫的SNMP 基因进化关系最近,与其他目昆虫SNMP 关系较远。此结果与大多数昆虫SNMP 基因特性相同[26,29-30]。在鳞翅目中曾经鉴定出SNMP3 亚家族基因[20],而在红脊长蝽触角转录组数据中没有发现该基因,可能是这个基因在幼虫肠中高度表达的原因。
组织特异性表达可以为功能预测提供可靠性的参考。我们研究发现红脊长蝽SNMP1主要表达在雌雄蛾的触角中,此结果与多音蚕蛾[9]、脐橙螟(Amyelois transitellaWalker)[31]、甜 菜夜蛾(Spodoptera exiguaHtibner)[32]和中红侧沟茧蜂(Microplitis mediatorHaliday)[33]等多种昆虫SNMP1的表达模式相同。Benton 等[34]在果腹黑蝇(Drosophila melanogasterwDm)中发现,DmelSNMP1能够识别集合信息素cVA,激活受体HR13。Pregitzer 等[28]在烟芽夜蛾(Heliothis virescensFabricius)中也发现,HvirSNMP1 能明显增强HR13 对信息素Z11-16:Ald 的结合力。以上研究都暗示昆虫SNMP1 的功能是调节信息素的识别和通过SNMP-OR 互作转运信息素。相对于TeleSNMP1,TeleSNMP2的表达相对广泛,除嗅觉感器触角外,在非嗅觉感器足中也有少量表达,此结果与小菜蛾(Plutella xylostellaL.)[35]、二化螟(Chilo suppressalisWalker)[36]、稻纵卷叶螟(Cnaphalocrocis medinalisG.)[37]、甜菜夜蛾[31]和中红侧沟茧蜂[32]一致。昆虫身体上分布有大量的味觉感器[38],而CD36 蛋白的主要功能是转运脂类化合物,因此可推测TeleSNMP2和GRs 在这些组织中共同表达,识别脂类分子完成味觉过程。
4 结论
本研究首次克隆和鉴定了红脊长蝽的2 个SNMPs 基因,即TeleSNMP1和TeleSNMP2。同目昆虫同类SNMP 同源序列一致性较高,反之,不同目昆虫不同类SNMP 同源序列一致性较低。同样,TeleSNMP1和TeleSNMP2之间的序列一致性也极低。TeleSNMP1主要在雌雄触角中特异性表达,而TeleSNMP2除触角外,在非触角组织中也有表达。
