液相色谱技术在饲料中抗菌肽分离纯化和含量测定的应用研究
2021-12-29何妍之
何妍之
(扬州大学生物科学与技术学院,江苏扬州 225009)
抗菌肽是一种广谱抗菌的多肽类物质,对动物机体的细胞没有毒害作用,耐药性较低,已成为动物饲料中常用的添加剂。目前,抗菌肽已逐渐在动物养殖中应用。王晓楠等(2012)研究发现,饲料中添加抗菌肽能促进肉鸡生长,显著提高肉鸡免疫功能。孙笑非等(2021)研究发现,抗菌肽作为猪饲料添加剂,能有效维持猪肠道菌群的平衡,促进肠道对饲料的消化与吸收,提高猪的生长速率,改善机体免疫功效。史庆超等(2014)发现,在饲料中添加抗菌肽能显著提高吉富罗非鱼的生长速率和免疫功能。黄小红等(2018)发现,添加抗菌肽能促进草鱼的生长发育,显著提高草鱼的免疫功能。抗菌肽是一种绿色饲料添加剂,具有稳定性强、分子量小、抗菌效果好等特点。
抗菌肽是一类小分子物质,来源于生物体内的水解物,在正常情况下,大多数抗菌肽带正电荷。饲料中抗菌肽的分离纯化作用机制是带正电荷的抗菌肽和带负电荷的离子交换剂结合在一起,抗菌肽与固定相结合,经高离子缓冲液对抗菌肽进行洗脱,将抗菌肽从离子交换剂洗脱到缓冲液中,从而分离出抗菌肽。针对饲料原料内各组成分的测定,高效液相色谱技术具有检测速度快、灵敏度强、安全和精确度强等特性。高效液相色谱技术在高分子蛋白的应用优势较为明显,能更好地精准确定高分子蛋白等的分子质量和结构。因此,高效液相色谱技术在饲料蛋白分子测定中广泛应用。本文对饲料添加剂中的抗菌肽采用高效液相色谱技术进行分离纯化,并测定饲料添加剂抗菌肽的含量,为饲料产品中抗菌肽的含量提供合适的检测方法,为饲料中抗菌肽的开发利用提供有效参考。
1 材料与方法
1.1 实验原料 饲料、抗菌肽样品。
1.2 试剂和溶液 甲醇、磷酸(分析纯)、纯净水(分析纯)。
标准溶液配置:称量5 g标准抗菌肽制品,将其放入100 mL锥形瓶中,配制抗菌肽样品浓度为3 mol/L的储备液,放入4℃冰箱中保存备用。临用时将储备液稀释10倍,配制流动相标准工作溶液,标准溶液分别为 0.25、0.5、0.75、1和1.5mol/L的标准溶液。
对照溶液:取5 g饲料样品放入天平中,精准称量饲料样品质量,将其放入250 mL锥形瓶中,加入适量无水乙醇,超声波加速溶解,冷却,加入无水乙醇稀释到容量瓶刻度线,摇匀,作为对照组样品。对照组样品溶液进行摇匀、过滤和冷置,制备阴性对照组样品。
1.4 固相萃取柱 本实验采用固相萃取柱洗脱和分离饲料样品,固相萃取柱用4 mL甲醇和碱性溶液活化,用饲料提取液初步润洗固相萃取柱,饲料提取液流速设置为2 mL/min,再用灭菌水和甲醇洗脱,收集固相萃取洗脱液体。洗脱液放入滤膜过滤后进行混合,而后使用高效液相色谱仪检测洗脱液。
1.5 液相色谱仪条件 本实验采用液相色谱柱为C18柱,固定流动相为甲醇-纯净水(体积比为9∶1),固定流动相的流速控制为2 mL/min,保持色谱柱温度为32℃,高效液相色谱仪的检测样品量为10 uL,仪器的检测波长控制在550~850 nm,多次反复测量液相色谱图。
1.6 饲料抗菌肽分离纯化的线性关系测定 将5 g标准抗菌肽样品放入250 mL锥形瓶中,加入无水乙醇,采用高温加热加速标准样品溶解,制定标准溶液,将其作为对照组。用3 mol/L抗菌肽标准溶液分别配置浓度为 0.25、0.5、0.75、1 和 1.5mol/L的标准溶液。各标准溶液组用移液枪量取10 μL放入高效液相色谱仪中,测定各组的峰面积,以各组峰面积为纵坐标,各组样品浓度为横坐标建立线性方程,测定其含量变化。
1.7 样品回收率实验 将适量样品放入500 mL回收瓶中,分别加入对照组液体5 mL,依照对照组液体配置回收样品,对样品浓度进行测定,并计算样品回收率。
2 结果与分析
2.1 饲料中抗菌肽的分离纯化条件优化 抗菌肽易溶于水和醇类,本实验对饲料中抗菌肽采用初步提取法,有效提高抗菌肽的纯度,再用高效液相色谱法进行分离纯化,高效液相色谱仪的流动固定相为甲醇,甲醇与水的体积比为9∶1,杂质与抗菌肽的分离效果好。
2.2 饲料中抗菌肽的液相色谱条件的优化 建立液态流动相,采用紫外检测器对流动相抗菌肽溶液扫描检测,定量结果由图1所示,紫外检测饲料中抗菌肽溶液的波长最大值为526 nm,吸光度最大。因此,饲料中抗菌肽溶液的检测波长为526 nm,结果准确,无杂质干扰。
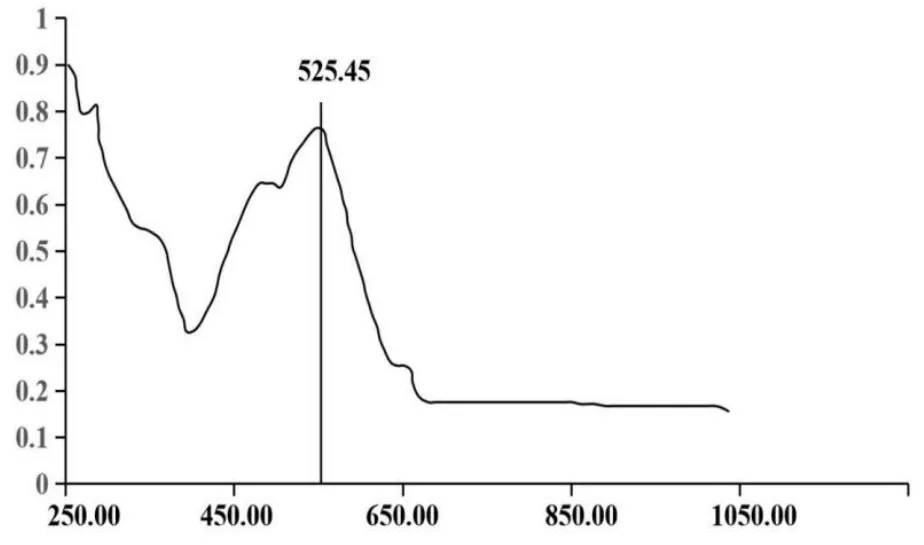
图1 抗菌肽紫外检测图
饲料中抗菌肽用C18柱进行色谱分离,使饲料抗菌肽与其他杂质分离,结果准确度高,且纯度更高。本实验对抗菌肽的液相色谱条件进行分析和优化,包括色谱柱温度、流动相体积比、流动相速率及样品停留时间,实验结果发现,高效液相色谱中提高流动相速率,流动相甲醇体积比及液体流动时间都对色谱图中峰的宽度有影响;实验将流速设置为0.75 mL/min,甲醇体积比为10%,柱温度为31℃。流动相中加入一定量的酸性溶液会有效改变色谱图的峰值,且磷酸-甲醇为流动相时,该峰线平稳,峰值稳定。为了维持液相色谱仪中色谱柱的安全有效性,流动相加入磷酸的效果远远高于甲酸和乙酸。由图2高效色谱图结果可知,该条件下抗菌肽的停留时间为7.56 min,且保持良好的峰值状态。
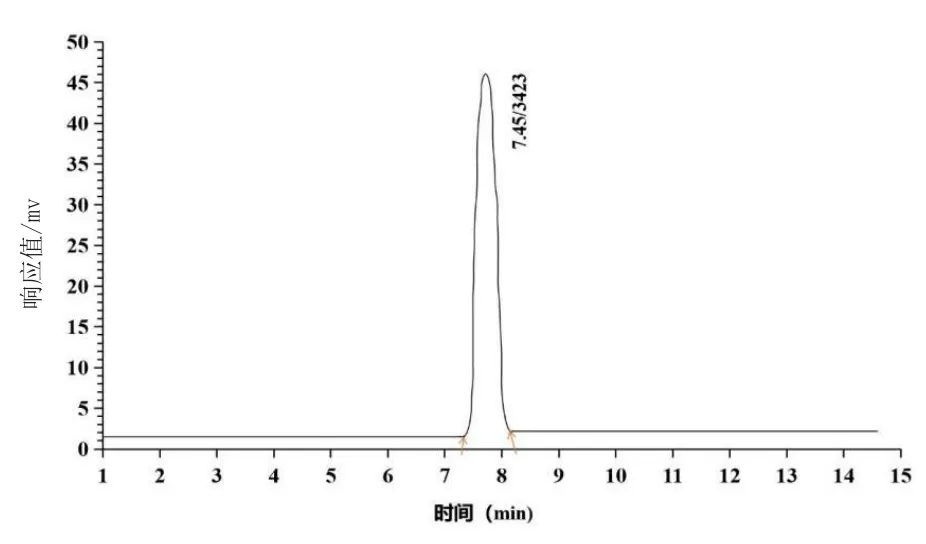
图2 抗菌肽标准溶液液相色图谱
2.3 饲料中抗菌肽分离纯化的结果分析 饲料中抗菌肽液体经过高效液相色谱仪分离纯化后,经过固相萃取后所得上清液,再经膜过滤后得到4个组分,结果如表1。由表1可知,抗菌肽的上清液经过膜过滤后被分离层析为各组成分,上清液中抗菌肽的含量最高,低于5 ku的抗菌肽浓度最小,总抗菌肽含量最低,5-10 ku的抗菌肽分子的活性最高,低于5 ku的抗菌肽活性为0。

表1 饲料中抗菌肽分离纯化的结果
2.4 饲料中抗菌肽的固相萃取柱的处理方法分析 抗菌肽上清液进行过膜过滤后,上高效液相色谱仪进行测定,操作较为便捷。本研究中采用固相萃取柱对抗菌肽上清液进行净化与浓缩,用甲醇和氢氧化钠进行活化,抗菌肽的离子化程度加强,更易保留在萃取柱中。该抗菌肽的上清液更好过固相萃取柱,用甲醇淋洗,将液体洗脱完毕后,抗菌肽的上清液流入洗脱液中。由图3所示,饲料中抗菌肽上清液经过固相萃取柱浓缩后,其色谱峰值的基线更低,抗菌肽浓度更高,以达到净化目的。
推荐理由:本书试图构建一个分析思考的理论框架,以兼收并蓄的融合视角探讨新时代下“中华传统的道德与和谐、西方文明的科学与理性、社会主义的理想与奉献”三源合流的可能性及逻辑基础。作者从文化理念的深层角度,对当下如何走出迷茫,依靠何种“定力”实现民族的伟大复兴进行了探究。

图3 固相萃取柱饲料中抗菌肽的高效液相色谱图
2.5 饲料中抗菌肽含量的线性关系分析 以抗菌肽的标准溶液为参照对象,依据优化的抗菌肽标准色谱条件进行饲料抗菌肽的含量定量分析。以标准抗菌肽溶液为纵坐标,色谱峰的面积值为横坐标建立线性标准方程。
该标准方程图如4所示:
由图4可知,标准曲线方程为:y=aX+b,a=554.25,b=321622,R2=0.9644,结果表明,饲料中抗菌肽样品浓度和色谱峰面积呈现线性关系,相关系数是0.964。

图4 饲料中抗菌肽含量的线性关系
抗菌肽溶液按照相关稀释倍数进行稀释,液相色谱仪测定进样抗菌肽浓度为0.5 mol/L,确定其本实验抗菌肽的测定量为3mg/kg。
2.6 液相色谱的稳定性分析 采用液相色谱分析法对动物饲料添加剂、水产动物饲料和家禽饲动物料抗菌肽含量进行测定,按照上述要求进行处理,在高效液相色谱仪中连续进样10次,测定不同类型饲料样品的起峰时间和峰值大小,并计算其相对偏差。结果表明:动物饲料添加剂,水产动物饲料和家禽动物饲料中抗菌肽色谱图中,不同样品的起峰时间和峰值大小的相对标准偏差低于0.5%,平均值较为稳定,结果证实该高效液相色谱的测定结果较为稳定。
2.7 液相色谱的精密度和准确性分析 参照前面的饲料抗菌肽添加水平,对不同类型的饲料添加不同含量的抗菌肽,每组测定10个重复。由表3可知,动物饲料添加剂、水产动物饲料和家禽饲动物料的抗菌肽回收率分别为96.4%、98.4%和99.7%,且相对标准偏差均小于0.5%,结果表明,液相色谱仪测定数据的精密度和准确性良好。
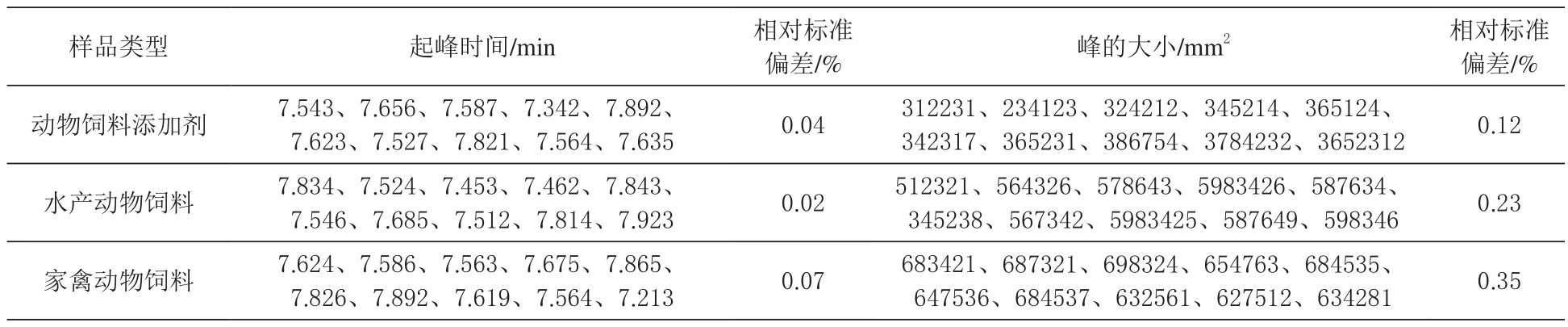
表2 液相色谱的稳定性分析

表3 液相色谱的精密度和准确性分析
2.8 饲料中抗菌肽的含量测定 本研究采用液相色谱仪测定标准不同类型饲料中抗菌肽含量。结果发现,液体动物饲料添加剂的抗菌肽测定值为2.45 mg/kg,水产动物饲料和家禽动物饲料的抗菌肽测定值分别是3.14和2.56 mg/kg。图谱(图5-6)结果表明,标准样品中抗菌肽没有杂质干扰,只有抗菌肽一个峰,饲料中抗菌肽样品峰值与标准峰值完全重合,说明色谱的前期处理和液相色谱条件较好。

表4 饲料中抗菌肽的含量测定

图5 抗菌肽标准溶液的色谱图

图6 待测饲料中抗菌肽样品中色谱峰图
3 讨论
3.1 高效液相色谱测定方法的优势分析 抗菌肽作为一种绿色饲料添加剂,在动物生长发育和免疫防护中起到重要作用。从饲料添加剂中分离纯化抗菌肽具有广阔的发展空间。根据抗菌肽的物理特性,凝胶过滤分析和离子交换层析被应用于抗菌肽的初步过滤,将初步处理的抗菌肽液体放入高效液相色谱仪进行分离纯化。樊陈等(2013)对地衣芽孢杆菌的抗菌肽分离纯化进行研究,结果发现,初步发酵地衣芽孢杆菌,发酵液被离心机分离后,经超滤浓度和离子交换层析等步骤,浓缩液被分子筛凝胶过滤和层析后,将浓缩液体放入液相色谱仪中获得分离纯化的抗菌肽。本实验中地衣芽孢杆菌的抗菌肽分离纯化分4步,但其浓缩液进行2次层析,将会增加样品分离纯化的成本,操作过程繁琐。陈雪丽等(2007)对芽孢杆菌的菌体蛋白分离纯化过程进行深入研究,本实验采用硫酸铵分级沉淀和固体液相柱层析获得菌体蛋白,该方法提取的蛋白含量较低,损耗较大。于佳民等(2021)采用超滤浓缩对芽孢杆菌中抗菌肽进行初步分离,且损耗较少,分离速率快,便于操作,凝胶层析采用层析柱来分离不同大小的蛋白,分离范围较为精准,符合抗菌肽的分离条件。本研究对饲料中抗菌肽样品进行研磨,用超滤过滤方法进行初步分离,再用固相萃取柱对饲料样品溶液进行浓缩,浓缩液均采用滤膜过滤后,最后浓缩液放入高效液相色谱仪即可获得饲料中分离纯化的抗菌肽,该方法操作简单,且分离速率快,灵敏度高,方法准确。
本研究表明,抗菌肽在甲醇、磷酸中均可溶解,此次选用甲醇作为液态流动相,且溶解效率高。因此,本研究用甲醇作为溶剂,溶解效率高,便于提高实验结果的准确度。采用高效液相色谱仪分离纯化饲料中的抗菌肽,对抗菌肽的色谱条件进行优化,发现流动相的流速、比例及固相萃取柱温度都会影响实验结果。因此,本实验对饲料中抗菌肽的分离纯化高效液相色谱条件进行优化,精准测定饲料中抗菌肽的含量,为饲料中抗菌肽添加量提供参考依据。
3.2 采用高效液相色谱测定方法对不同类型饲料抗菌肽含量精确分析 本实验对不同类型饲料抗菌肽添加量结果的稳定性和精密度进行分析、比较,采用高效液相色谱仪测定不同类型饲料样品抗菌肽的起峰时间和峰值大小,分析不同类型样品的相对偏差,结果表明,不同类型饲料抗菌肽的起峰时间和峰值面积相对偏差较小,测定抗菌肽的结果稳定性强,精密度高,准确度强。张二鹏等(2021)利用高效液相色谱法测定保健食品中鞣花酸的含量,结果发现,经高效液相色谱仪测定的结果准确性、灵敏度、精密度高,稳定性强,与本研究结果类似。
本研究采用高效液相色谱分析法对不同类型饲料中抗菌肽进行分析,结果发现,标准样品中抗菌肽峰值与饲料待测样品的抗菌肽峰值相似,表明结果的精密度高,准确度强,且能有效测定饲料中不同类型的蛋白大分子含量,也为饲料样品含量的测定研究提供了理论依据。
4 结论
本研究最佳的饲料抗菌肽分离纯化方法是高效液相色谱法,发酵液采用超滤层析和固相萃取法对其进行浓缩和层析,样品溶液经过滤后放入高效液相色谱仪获得分离纯化的抗菌肽,在此基础上,抗菌肽的保留时间为7.25 min,当浓度为500~3800g/L时,饲料中抗菌肽的峰面积与抗菌肽样品浓度呈线性关系,且准确度高,精密度强。该方法具有操作方便、检测速率快、灵敏度高和应用范围广泛等优点。
